[导读] 作者:陈旭
导读
卡波西样淋巴管瘤病(Kaposiform lymphangiomatosis,KLA)是一种罕见的泛发性淋巴管异常疾病,具有侵袭性、弥漫性、多灶性及不良预后的特点。目前尚无有效治疗方案,多累及呼吸系统引起胸腔积液,常导致呼吸窘迫和呼吸困难。2022年7月,哈佛医学院医学院附属波士顿儿童医院的Harry P.W. Kozakewich教授团队在病理学顶尖期刊《American Journal of Surgical Pathology》(IF值为6.298分)上发表了题为“Kaposiform Lymphangiomatosis:Pathologic Aspects in 43 Patients”的文章,详尽总结了KLA的临床病理特点,下面笔者将这篇文献总结归纳如下,供相关医师参考。
起源
2004年,Perez-Atayde AR等人首次发现并提出KLA概念,指定一种具有独特的临床、放射学和病理特征的疾病。由于病例数量过少,直到2018年,国际脉管性疾病研究学会(International Society for the Study of Vascular Anomalies,ISSVA)定义卡波西样淋巴管瘤病(Kaposiform lymphangiomatosis,KLA)为泛发性淋巴管异常的一种预后不良的新型亚型。
临床特点
①儿童、青少年多见,偶尔见于成年人。
②最常见的受累部位为纵隔、肺、心包、腹膜后、脾脏、骨、皮肤和软组织,凝血功能障碍很常见。最常见的最初症状是咳嗽、呼吸困难和胸痛,半数患者伴有心包积液及胸腔积液。
③肢体或胸壁受累的患者表现为皮肤棕色、水肿性斑块,并伴有各种出血性囊泡或斑块,通常也累及皮下炎。
④患者预后不良,死因包括呼吸衰竭、心肺衰竭、多器官系统衰竭、张力性气胸、出血、带血积液和肺血肿。
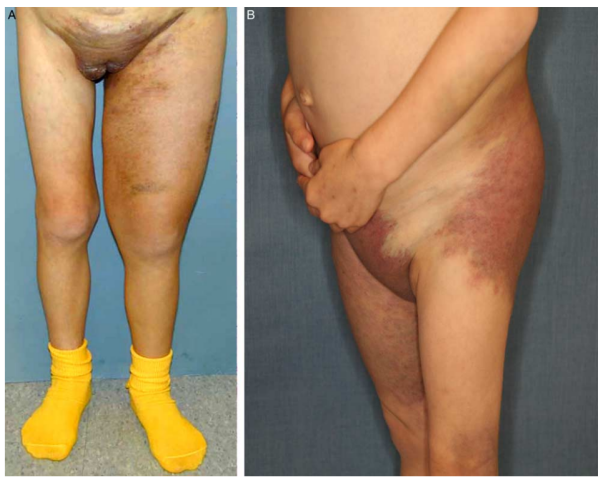
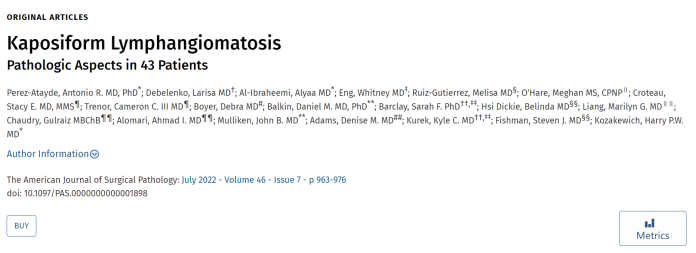
图1.KLA皮肤表现。(A)患者为12岁女孩,紫罗兰色皮肤和皮下斑块。(B)患者为3岁女孩,大腿和躯干的皮肤和皮下炎有红斑和出血性硬化斑块。
影像学表现
①支气管血管束信号异常,伴或不伴实质实变。
②影像学受累区域包括:纵隔(31例);肺(29例);骨骼(30例);脾脏(20例);腹膜后及肠系膜(17例);软组织(8例);肝脏(4例);肾脏(2例)。
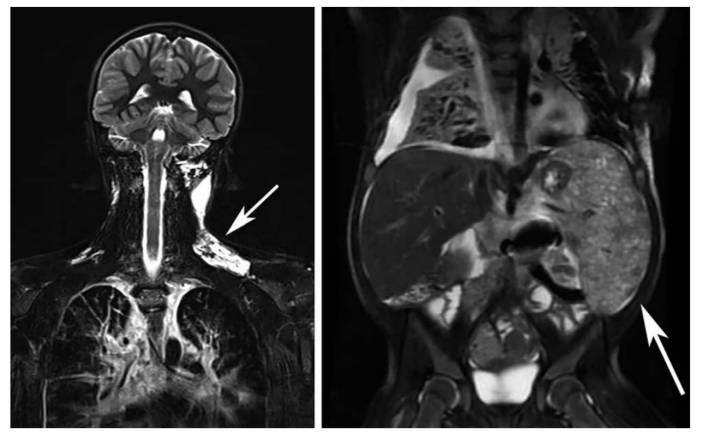
图2.KLA影像学改变。(A)患者为一名13岁女孩,左侧颈软组织、锁骨上窝(箭头)、纵隔及支气管血管束沿线均有高信号异常(轴向STIR磁共振成像序列)。(B)患者为一名20个月大的女孩,脾肿大(箭头),腹膜后、纵隔和肺信号增加和软组织高信号,伴有右侧胸腔积液(冠状STIR图像)。
病理学改变
(1)皮肤组织改变特点(图3、图4)
①皮肤凝结或褐色变色;表皮黏膜形成囊泡并扩张,可见出血或血栓形成的淋巴管,以及组织、器官的出血及浆液渗出。
②受累及的皮肤组织中,可见扩张、形状异常、大小不同的淋巴管,内衬内皮数量减少。淋巴管腔不规则地覆盖着平滑肌,管腔要么是空的,要么含有嗜酸性蛋白、淋巴细胞或巨噬细胞簇,有时还含有血液。
③淋巴管腹肌可观察到稀疏、小、不规则、卵圆形或椭圆形的细胞簇,这些簇由平行的、均匀的、淡纺锤形的细胞组成。细胞核均匀,染色质细,核仁小。胞浆稀疏、淡色或粉红色,通常含有丰富的含铁血黄素颗粒。
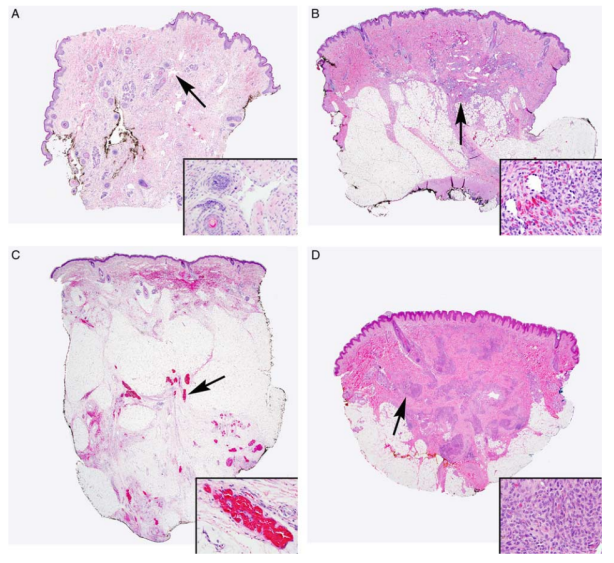
图3.KLA皮肤组织学特点,箭头表示插图中描述的区域。(A)第一次活检显示只有少量淋巴管扩张,网状真皮水肿。薄壁淋巴管。(B)患者的第二次活检显示真皮淋巴通道扩张,真皮和皮下细胞簇形成,这些细胞簇中含有新生血管。(C)淋巴管和细胞簇伴局灶性出血。大多数细胞簇无异型性改变。(D)病变区域呈实性,轮廓清晰,由相连的细胞簇组成。这些细胞簇由纺锤形细胞和散布的红细胞组成。
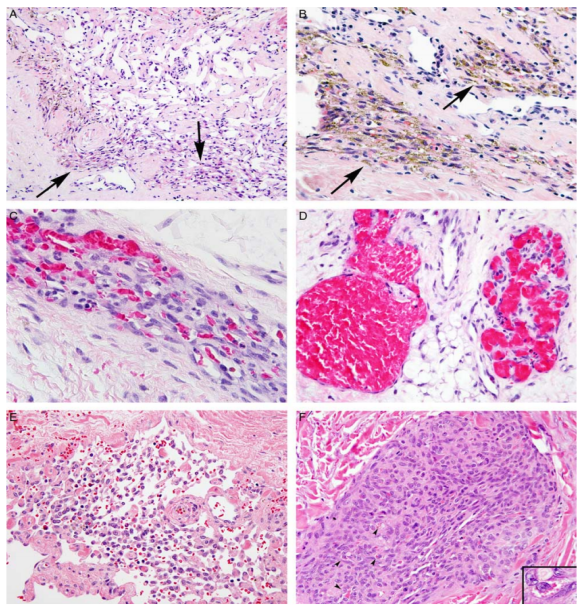
图4.KLA中真皮/皮下淋巴管和细胞簇的变化。(A)海绵状淋巴管,内皮减少,纺锤体细胞簇在淋巴管周围聚集(箭头)。(B)纺锤形细胞簇有明显的含铁血黄素颗粒(箭头)。(C)细胞簇聚集呈巢状。(D)充满血细胞的淋巴管。(E)淋巴管松散,呈筛状。(F)梭状细胞簇,具有不明显的管状,部分细胞有胞质嗜酸性的包涵体(箭头和插图)。
(2)肺和胸膜的改变(图5、图6)
①脏层和壁层胸膜增厚,可见出血及粘连(图5A,5B)。
②淋巴管经常充满血液,可在纵隔中看到(图5B,5C)。血管沿着支气管肺根、小叶间隔和胸膜行走(图5D)。
③在肺,扩张的淋巴管中,可见稀疏、梭形和含铁血黄素聚集体(图6)。薄壁组织常显示非特异性慢性炎症。肺泡间隔间充满巨噬细胞,有时还有红细胞和含铁血细胞。
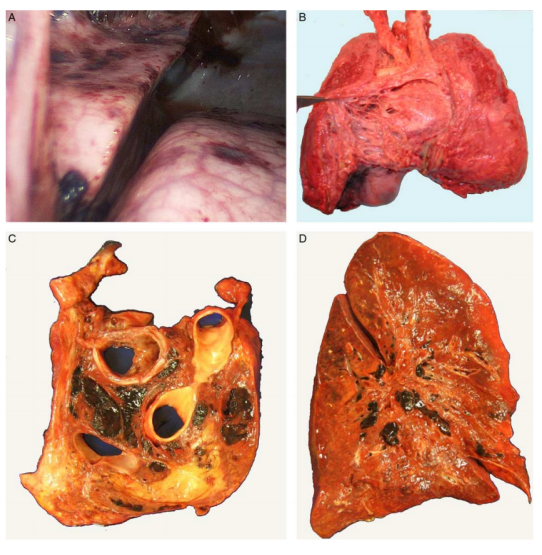
图5.KLA纵隔和肺部的表现。(A)出血性胸膜斑块和小叶间隔扩大。(B)后纵隔有淋巴大囊肿,胸膜增厚。(C)在隆突和主动脉弓水平的横切面上被血栓闭塞的大量扩张的纵隔淋巴管。(D)淋巴管扩张,支气管中可见血栓。
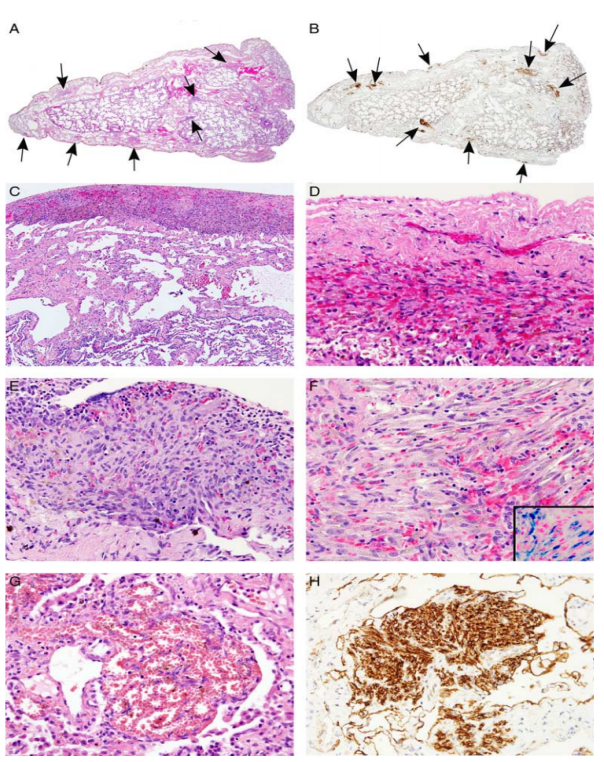
图6.KLA肺组织病理改变。(A)胸膜和小叶间隔中扩张的淋巴管和其周围的细胞簇(箭头)。(B)D2-40 阳性(箭头)的细胞簇。(C)大的胸膜斑块,可见细胞成分和淋巴管扩张。(D)胸膜斑块的细胞成分,由梭形细胞和红细胞组成。(E)细支气管周围结节,呈卵圆形和梭形细胞,散布着红色细胞浸润。(F)具有含铁血黄素的梭形细胞,周围散布着红细胞、淋巴细胞和嗜酸性粒细胞,普鲁士蓝染色强化含铁血黄素(插图)。(G)管腔分化良好的内皮细胞簇,内腔充满血液。(H)细胞簇和邻近畸形淋巴管中 D2-40染色阳性。
(3)胃肠道的改变(图7)
胃肠道可见黏膜瘀点或出血,可见扩张的黏膜淋巴管。有时在固有层中可见梭形细胞灶。
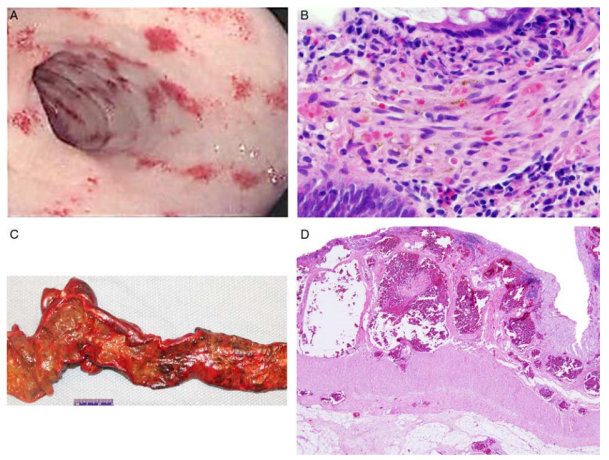
图7. KLA胃肠道改变。(A)十二指肠黏膜内镜下,有瘀点和红色、棕色、半透明绒毛。(B)固有层有纺锤状细胞簇。活检中其他区域的粘膜淋巴管扩张(未显示)。(C)结肠黏膜和浆膜出血,并有微小的黄色黏膜斑点,可能是由于淋巴管扩张造成的。(D)粘膜下充血的淋巴管。
(4)脾脏病理改变(图8)
①脾脏肿大,呈局灶性或弥漫性海绵状变化,有时肉眼可见的囊性变。(图8A-D),这是由于脾窦扩张造成的。
②血窦局部增大、可见纺锤形、含铁血黄素颗粒和局部增生的内皮细胞(图8E)。
③脾窦中有时可见含有PAS、抗淀粉酶的胞浆小球的细胞。囊性间隙与相邻扩张的脾窦相连(图8F)。一些囊性间隙包含淋巴细胞、单核细胞和造血前细胞(图8G)。
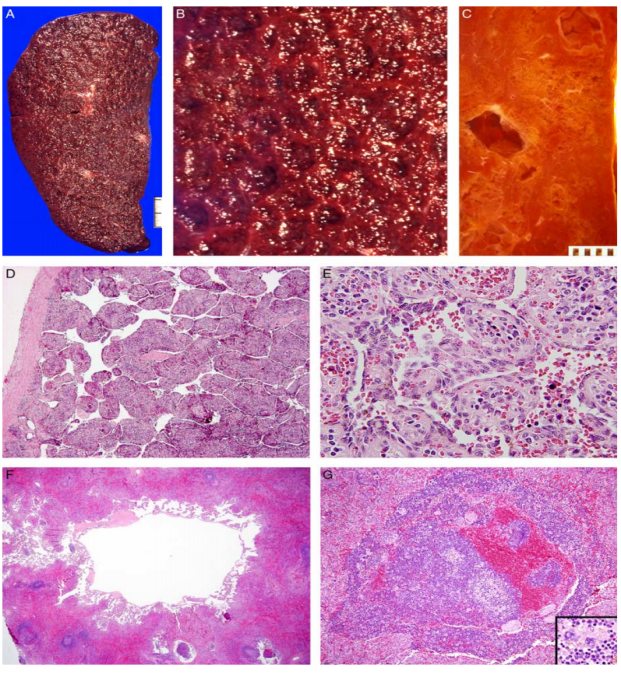
图8.KLA中脾脏改变。(A)患者为一名3岁男孩,脾脏肿大,弥漫性海绵状改变。(B)海绵状改变,窦下扩张。(C)除了局灶性海绵状改变外,还有几个小的“囊肿”。(D)扩张的脾窦。(E)窦内有增大的内皮细胞,胞浆可见含铁血黄素。(F)脾窦内的囊肿形成。(G)“囊肿”主要包含淋巴细胞和包括巨核细胞在内的造血前体(插图)。
(5)免疫组织化学染色
D2-40、PROX1、LYVE 1、CD31强阳性,CD34弱阳性,因子 VIII-RAg、ERG和 Fli-1阳性,HHV-8阴性,MIB1免疫染色的增殖指数<5%。
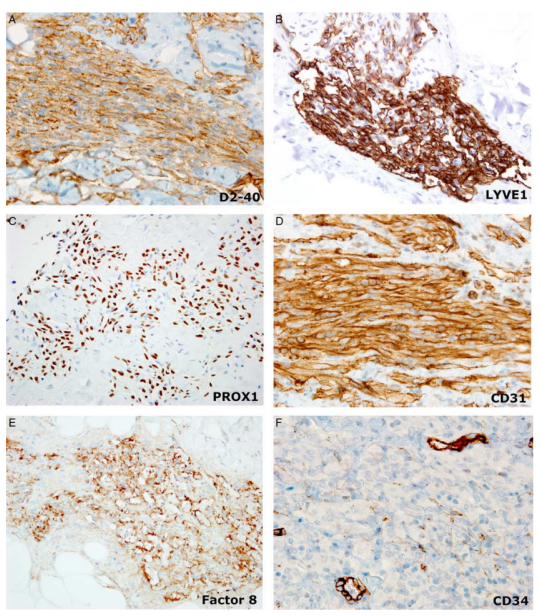
图9.KLA免疫组织化学染色。
(6)电镜改变
①皮肤病变的超微结构检查
内皮细胞轻度增大,有嗜锇含铁血黄素颗粒,胞饮小泡少,基底层不连续,细胞间连接少,
没有Weibel-Palade结构。
②脾脏病变的超微结构检查
脾窦由富含铁血黄素、丰满的内皮细胞胞饮小泡和少量不明显的细胞间路口;Weibel-Palade小体不存在,基底层不连续。
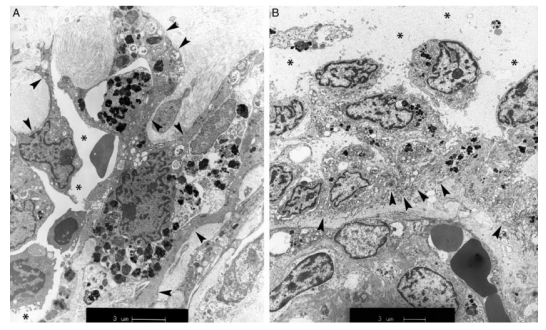
图10.超微结构特征。 A,皮肤病变:异常通道,管腔不规则(*),含有淋巴细胞和红细胞。 通道内衬有大量胞质嗜锇含铁血黄素颗粒的丰满内皮细胞。
在内皮细胞中,可见不连续基底层和亚质膜下富含肌动蛋白的增厚(箭头),内皮细胞周围可见周细胞。 Weibel-Palade 小体未识别。 B,脾窦通道内衬有分层的富含铁血黄素、丰满的内皮细胞,即为突入管腔的细胞 (*), Weibel-Palade 小体未见。 箭头指示不连续的基底层。
(7)分子遗传学改变
90%的病例存在Q61R变异。
鉴别诊断
(1)中央传导淋巴管异常(CCLA)和全身性淋巴管异常(GLA)
KLA、CCLA和GLA都有畸形淋巴管形成,但KLA可观察到特征性内皮细胞形成的细胞簇。
(2)角状血管内皮瘤(KHE)
KHE通常表现为坚实、紧张和栗色的皮肤,组织学具有纺锤形细胞簇、D2-40和PROX1阳性的内皮细胞以及畸形淋巴管。但是,KHE通常有明确汇合的结节,拥有充满血液的毛细血管,有时是“肾小球”病灶,通常形成腔内血栓。穿刺活检可能与KLA无法区分。
(3)丛状血管病(TA)
TA表现为红斑或棕色斑块或儿童和年轻人的斑块,组织学可见炮弹样的真皮毛细血管小叶。
(4)卡波西肉瘤(KS)
KS中HHV-8标记阳性,KLA中HHV-8标记阴性。
























共0条评论