[导读] 译者:薛德彬
脐尿管癌的管理:加拿大泌尿外科协会和加拿大泌尿生殖医学肿瘤学家的共识声明
Management of urachal cancer: A consensus statement by the Canadian Urological Association and Genitourinary Medical Oncologists of Canada
1、引言
脐尿管是尿囊的纤维性残余物。出生后,它成为从膀胱顶端到脐的内侧脐韧带,终身不变,也没有任何更多的生理作用。脐尿管癌由Begg在1931年首次描述,是一种罕见的病理学类型,占膀胱癌的1%以下。1肿瘤通常位于膀胱顶端的浆膜侧,因位于膀胱外和腹膜外,故通常无症状。因此,大多数患者存在局部浸润或转移性疾病,发现时已是较高分期。
由于脐尿管癌罕见,目前还没有针对脐尿管癌症的大型前瞻性随机试验,也没有关于该疾病治疗的循证指南。医学文献中的现有证据来自病例系列。
在这篇文章中,由加拿大泌尿生殖医学肿瘤学家(GUMOC)领导,我们旨在回顾这一罕见疾病的文献,以建立关于脐尿管癌治疗的加拿大共识声明。据我们所知,没有其他共识声明。
2、方法
我们使用以下关键词对Pubmed、Embase和Cochrane进行了搜索:脐尿管癌(urachus carcinoma)、脐尿管癌症(urachus cancer)、脐尿管的癌(carcinoma of the urachus)、脐带癌症(urachal cancer)。
回顾了欧洲泌尿外科协会(EAU)、国家综合癌症网络(NCCN)和不列颠哥伦比亚省癌症局(BCCA)的省级指南。只有BCCA指南提到脐尿管癌。
第一稿由项目负责人(ZH和NB)编写和审查,并分发给GUMOC成员进行初步审查。更新后的版本再次提交给该小组,以及泌尿肿瘤学、放射肿瘤学和病理学领域的主要加拿大代表,并提交给一位患者倡导者。在达成一致意见之前(通过电子邮件交流或在GUMOC年度会议上亲自讨论),小组内部通过修订总结报表达成了共识。
使用世界卫生组织(WHO)修改的牛津循证医学中心分级系统描述推荐指南。根据以下内容描述证据水平:1级:随机对照试验的系统回顾(RCT);2级:个体RCT,包括低质量RCT;3级:对照队列;4级:病例对照研究或病例系列;5级:专家意见,基于机制的推理。2
2.1 数据来源
从1960年起,大约有300种出版物。由于该病罕见,因此没有前瞻性或3期研究。在本文中,我们包括了10名或10名以上脐尿管癌患者的回顾和病例系列,但关于分子生物学和新兴疗法的文章除外,这些文章包括较少的患者。有趣的是,过去两年发表了两篇重要的信息丰富的论文。首先,发表了利用国家癌症研究所的监测、流行病学和最终结果(SEER)数据库进行的最大规模的基于人群的研究。这项研究包括基于2010年美国人口普查的18个癌症登记处的数据,包含420名脐尿管癌患者。3其次,现在可以获得荟萃分析,包括大多数已经描述和发表的病例系列,共有1010名患者。4
3、背景
3.1 解剖学
脐尿管是尿囊的纤维残余物,尿囊是位于膀胱顶端的一条管道,用于排出胎儿的膀胱。5它从膀胱前顶部向上延伸至脐,长度为3-10cm,直径为8-10mm。6脐尿管通常在胎儿期退化,但脐尿管管腔在大约1/3成人中持续存在,并作为一种临床意义不大的中线管状或囊性结构穿过膀胱壁。7,8脐尿管包括三个不同的组织层:由尿路上皮衬覆的上皮性管道、粘膜下结缔组织和外层平滑肌。脐尿管肿瘤可以发生在这些层中的任何一层,并且可以是上皮性或间质性。此外,上皮通常表现为局灶性腺体化生,为肠型肿瘤的发生提供了形态学基础。1
3.2 流行病学
在北美和欧洲,膀胱癌的主要组织学类型是尿路上皮(移行细胞)癌,占比90%以上。膀胱腺癌仅占1.4%。在这些罕见的膀胱腺癌病例中,脐尿管癌占10-40%。据报道,该肿瘤在普通人群中的估计年发病率为每500万人中就有一人。9区分膀胱脐尿管腺癌和非脐尿管癌很重要,因为这两种肿瘤的手术方法不同(前者扩大部分膀胱切除术,后者根治性膀胱切除术)。此外,虽然认为脐尿管腺癌与膀胱腺癌的生物学特性相似,但在文献中尚未得到充分研究。
脐尿管癌患者更可能是男性,SEER数据库中的男女比例为1.44:1,荟萃分析中的男性比例为60%。3,4根据17份报告,诊断时的中位年龄为52岁(20-90岁),比非脐尿管腺癌(中位年龄69岁)年轻。4,9-14
在最大的系列中,五年总生存率约为50%。9,10,12,13预后不良的主要原因是,由于局部疾病相对缺乏症状,难以通过膀胱镜进行识别,因此就诊时已是晚期;以及由于在局部和晚期疾病的调查和治疗中缺乏明确共识。5尽管如上所述,脐尿管癌的发病年龄较低,预后不良,但与非脐尿管腺癌相比,脐尿腺癌的生存率较高。13,15
3.3 组织学
腺癌是脐尿管癌最常见的组织学亚型,分别占Mayo诊所系列(420名患者)的90%和SEER数据库病例的82.4%。3,10腺癌亚型包括报道最多的粘液腺癌、12非特殊型腺癌和伴印戒细胞形态的腺癌。其他组织学亚型相对少见,包括鳞状细胞癌、尿路上皮癌和肉瘤。7,10同一患者可能存在一种以上的组织学亚型。12脐尿管癌的不同组织学的总体存活率似乎不同,其中尿路上皮细胞亚型较好。在SEER数据库中,尿路上皮细胞癌亚型的癌症特异性死亡率低于伴印戒细胞的腺癌(风险比[HR]6.14;95%可信区间[CI]2.14–17.6;p<0.001)、非特殊型腺癌(HR 3.09;95%CI 1.21–7.84;p=0.001)和粘液腺癌(HR 3-01;95%可信区间1.21-7.5;p=1.01)。
3.4 免疫组化
没有特异性标记物来证实或排除脐尿管癌。此外,这些细胞与胃和结肠粘膜相似,可能会导致诊断混淆。事实上,一种理论认为脐尿管肿瘤的祖细胞来自胚胎发育过程中留下的肠道残留物。
首先,关于CK7、CK20和CDX2的染色结果,肠、卵巢和脐尿管来源的腺癌之间似乎存在显著重叠。然而,CK7在结肠的或胃的印戒细胞癌中呈阴性,而脐尿管癌通常为CK7阳性。16
其他潜在标记物包括34βE12和β-catenin。Gopalan等人使用CDX2、CK7、CK20、β-catenin和34βE12对15例脐尿管腺癌进行免疫组化染色,并与81例结肠腺癌进行比较。所有病例的CK20和CDX2染色均为阳性,其中一半的CK7染色为阳性。约2/3患者的肿瘤显示34βE12染色,其中大多数仅有局灶性染色。超过90%的脐尿管肿瘤显示出强而弥漫的细胞膜呈34βE12染色,而核不染色。相比之下,25%的结肠腺癌显示细胞膜呈34βE12染色伴局灶性或弥漫性核染色增强,只有11%的结肠癌显示罕见或局灶性胞质呈34βE12显色。作者结论,免疫染色不能明确区分脐尿管癌和肠癌,但34βE12的弥漫阳性支持脐尿管癌的诊断,而β-catenin的弥漫性核显色不支持。17
3.5 分子生物学
直到2016年,医学文献中几乎没有关于这种特殊肿瘤的生物学数据。2016年,Modos等人报告了22例脐尿管癌样本中的突变热点,特别是KRAS、NRAS、BRAF、EGFR和PIK3CA基因。18选择这五个基因是因为脐尿管癌和大肠腺癌之间的相似性。他们在22例患者中的10例中发现了11种突变。KRAS受影响最频繁(27%),其次是BRAF(18%)和NRAS(5%)。不幸的是,在突变状态和临床病理特征之间没有发现相关性,包括印戒细胞分化、钙化、临床分期、肿瘤分级、淋巴结或远处转移的存在和生存率。值得注意的是,KRAS突变仅出现在非转移性病例中。其他较小的病例系列研究了脐尿管癌中KRAS的突变状态。Sirimpun等人观察到七例中有三例出现KRAS突变,而Alexander等人发现五例中有一例出现突变。19,20基于这些小序列,与尿路上皮癌相比,脐尿管癌(类似于结直肠癌)中的KRAS突变可能更为频繁,因为尿路上皮细胞癌并不常见。同样,BRAF突变在膀胱尿路上皮癌和腺癌中罕见,但在Modos等人所述的系列中,18%的脐尿管癌中存在。18
3.6 临床表现
约80%患者的常见临床表现为肉眼或显微镜下血尿,这意味着肿瘤已经越过粘膜肌层并侵入尿路上皮表面。10其他不常见的症状包括细菌尿、黏液尿、疼痛、腹部肿块和脐部感染。5,12据报道,按最大径评估,肿瘤大小的中位数为3.0-6.3 cm。不幸的是,由于韧带位于膀胱外,许多患者出现局部晚期疾病。例如,在Wright等人的151例脐尿管腺癌和1374例非脐尿管腺癌的膀胱患者中,只有20%的患者表现为局限性疾病。13肿瘤可向附近器官延伸,转移主要发生在盆腔淋巴结、腹膜后淋巴结、肺和骨骼。关于转移部位的频率没有精确的统计数据,然而,在Ashley等人对66名患者进行的一系列研究中,39名患者在疾病发展的某个阶段发生全身转移(诊断时13名患者,随访期间26名患者)。肝脏、肺和骨骼是最常见的。10
3.7 诊断方法
用于确定诊断的不同方法学包括细胞学、影像学和膀胱镜检查。膀胱镜检查可在约80%的患者中识别可见的肿块,而尿液细胞学检查的阳性率仅为38%。10,12由于肿瘤位于膀胱外,尿液细胞学检查可能为阴性。
CT为诊断提供了强有力的支持信息。在CT扫描中,脐尿管癌可能表现为实性、囊性或两者结合。60%的病例可见低衰减成分,反映黏液含量。此外,50-70%的病例中会出现肿瘤内钙化,可能是点状、点状、曲线状和周边钙化。6因此,膀胱穹窿上的中线肿块,无论是实性还是囊性,尤其是伴有小钙化的肿块,对脐尿管癌即使没有足够的诊断特异性,也是高度可疑的。21
MRI显示肿瘤不均匀,T2加权图像显示高强度。总之,MRI具有多平面成像的优势,在确定邻近器官(如膀胱)的受累方面可能比CT更有用。总之,CT和MRI可用于临床评估,以明确前者的诊断,并评估后者的局部区域扩展。22
最后,40-60%的患者的CEA、CA-125、CA 19-9等生物标志物可能升高;然而,它们没有特异性,在其他来源的癌症中也可以升高。这些标记物的反应通常与放射反应相关。21
3.8 分期
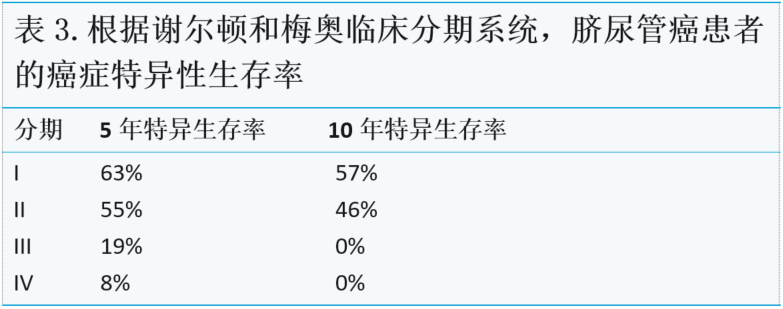
目前,尚无经验证的脐尿管癌分期系统。已经描述了不同的分期方法,即Sheldon、Mayo和改进的TNM分期系统。其中,前两种是最常用的。9,10,12

Sheldon在1984年首次描述了分级系统(表1),尽管从未正式验证,但它仍然是报告最多的分类。梅奥诊所的Ashley等人描述了基于66名患者的第二种系统(表2)。他们发现Sheldon分期系统更为复杂,有八个类别,其中四个类别由≤2名患者组成,10而梅奥系统在患者分布方面更为平衡。尽管如此,两种系统预测癌症特异性死亡率的效果相同,如表3所示。10
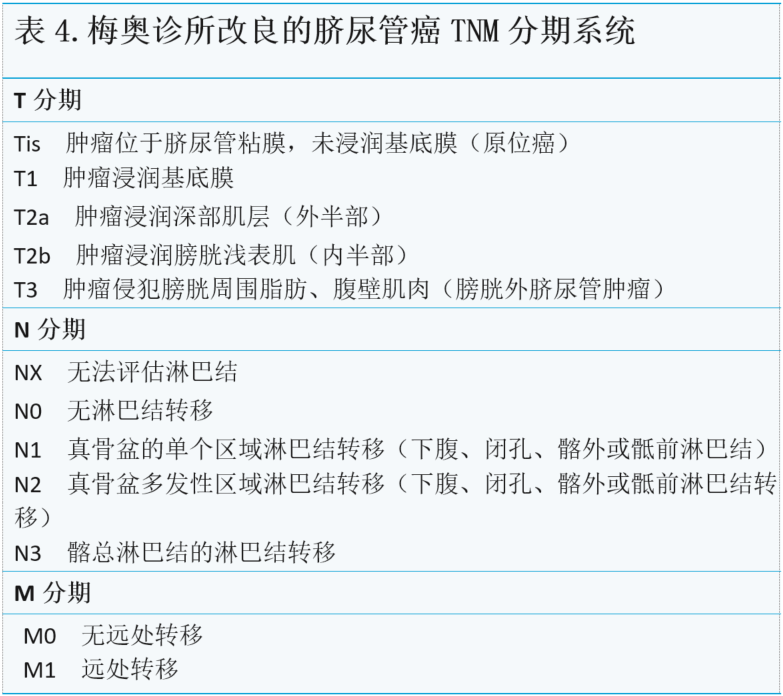
在最近的一份出版物中,梅奥诊所的第二个团队选择将更通用的TNM分期系统应用于脐尿管癌(表4)。
共识声明:专家组赞成使用改进的TNM分期系统。然而,所有三种分期系统都提供了预后效用的相关信息,应为每个患者提供分期信息(证据等级4,C级)。
4 诊断
4.1 诊断标准
最一致的脐尿管癌诊断标准是Sheldon等人23和Mostofi等人24所述的标准,包括:1)位于膀胱顶部的肿瘤;2) 无囊性膀胱炎和囊性腺性膀胱炎;3) 主要侵犯肌层或较深组织,肿瘤与膀胱表面尿路上皮之间界限清晰,无腺体增生或息肉样增生;4) 肿瘤内存在脐尿管残余物;5) 肿瘤延伸至膀胱壁,并累及耻骨后间隙(Retzius间隙)、前腹壁或脐;6)其他部位无原发性肿瘤的证据。17 2016年,Paner等人发表了脐尿管上皮性肿瘤病理诊断和分类的最新进展。15他们发现上述原始标准过于严格,建议修改标准。事实上,只有15-62.5%的病例报告了脐尿管残留。17在17–21%的病例中,局部发现囊性膀胱炎和囊性腺性膀胱炎,而大多数脐尿管肿瘤位于顶部,4%的病例可能位于前壁。17,25
根据Paner等人的建议,该小组支持使用以下修改标准:1)肿瘤位于顶部或前壁;2) 肿瘤主体位于膀胱壁;3) 膀胱壁无广泛的腺瘤性改变和广泛的囊性膀胱炎/囊性腺性膀胱炎;4) 膀胱无尿路上皮内瘤变(neoplasia);以及5)其他部位缺乏已知的原发性肿瘤。

4.2 预后因素
较常描述和最有效的五个预后因素包括:疾病分期、术后阳性切缘、肿瘤病理分级、阳性淋巴结和手术类型。后者是指脐尿管和脐带的完全整块切除,而不是不完全切除。
一些研究表明,晚期疾病的存在与不良预后相关。13,14使用上述TNM分期系统,Mayo诊所的Molina等人表明,I期的中位生存期超过10年,II期为7.5年。然后,3期和4期分别显著减少到1-2年和不到1年。12
其次,实现阴性切缘对生存有很大影响。在Ashley等人的研究中,阳性切缘的存在与癌症特异性死亡率的风险比为3.8(p<0.001)。10
第三,肿瘤分级仍然是多变量分析中最重要的预后因素之一。在Pintus等人的研究中,与所有死亡的低分化肿瘤患者相比,高分化、手术可切除的原发肿瘤患者的长期疾病特异性生存率高达90%。9
第四,在不同系列的多变量分析中,发现淋巴结转移,无论是否隐匿,都与不良预后相关。同样,在Ashley等人的研究中,淋巴结转移的存在与癌症特异性死亡率的风险比为5.1(P<0.001)。10
共识声明:每个患者应评估的脐尿管癌的五个主要预后因素包括:疾病分期、手术切缘状态、肿瘤病理分级、阳性淋巴结的是否存在和手术类型(证据等级4,C级)。
5 治疗
5.1 手术
局部脐尿管癌的推荐治疗方法是整体手术切除脐尿管韧带和部分膀胱切除术。与不进行脐部切除的膀胱切除术相比,这种干预与最高的中位生存率相关。12,26,27 Herr等人报告了50例脐尿管癌患者的生存情况。他们发现,脐尿管肿瘤和脐尿管的整体切除联合部分膀胱切除术治愈了70%的临床局限性脐尿管癌患者。11在另一个系列中,虽然整体切除与存活率无统计学相关性(P=0.09),但16例切除术后长期存活者中有13例属于整体切除和脐切除组。26
大型荟萃分析包括957例患者的手术治疗4:66%的患者接受了部分膀胱切除术,12%的患者进行了根治性膀胱切除术。67%的患者进行了脐带切除术。这些数据表明,在部分膀胱切除术的同时进行脐韧带的整体手术切除是常见的,并且基于回顾性系列,可能与更好的结果相关。4
至于广泛的盆腔淋巴结清扫术,与上述手术相比,似乎并没有提高生存率,而且似乎与更多的并发症有关,这在大多数文献中都有报道。14荟萃分析中仅有38%的患者进行了淋巴结切除术,其中17%的患者淋巴结阳性。在SEER数据库中,淋巴结切除术似乎与根治性膀胱切除术相关,分别有8%、44.1%和78%接受局部切除、部分切除和根治性膀胱手术的患者记录了淋巴结切除。总的来说,只有13.4%的淋巴结呈阳性。3虽然主张对脐尿管癌患者进行盆腔淋巴结切除术,但其治疗作用以及切除方式需要进一步定义和研究。
最后,与部分膀胱切除术相比,完全膀胱切除术没有明显的生存优势。27根据Siefker-Radtke等人的观点,只有在必需获得阴性切缘时才能考虑进行完整的膀胱切除术,同时整体切除脐韧带和脐,或,如果部分膀胱切除术会导致膀胱容量和功能不足,也可以考虑上述术式。21
共识声明:
-整体手术切除脐带、脐韧带和部分膀胱切除加盆腔淋巴结切除术是首选的干预措施。当部分膀胱切除术不可能实现膀胱手术切缘阴性时,应考虑在选定的病例中进行根治性膀胱切除术,同时整体切除脐韧带和脐(证据等级4,C级)。
-对于切缘阳性和/或手术程序不完整的患者,应考虑二次手术(证据等级5,专家意见)。
-在少量转移性疾病或局部复发的情况下,手术切除可在个案基础上进行讨论(证据等级5,专家意见)。
5.2 放疗
脐尿管肿瘤对放射并不特别敏感,很少使用放射治疗。在SEER数据库中,只有10%的患者(共414名患者)接受了放射治疗,29名患者接受了手术治疗(13例为IV期,10例为III期,5例为II期),13名患者接受单一治疗(其中11例为IV期)。3有时用于术后阳性切缘或局部不可手术疾病,但没有任何有力证据表明可改善治愈性。21
共识声明:手术应是局部疾病的首选方式。当患者被认为不适合手术时,可以考虑放射治疗,但其获益尚不清楚。可以考虑对术后阳性切缘进行放射治疗,特别是如果认为第二次手术不可行的话。姑息性放射治疗可考虑用于不可治愈的疾病(证据等级5,专家意见)。
5.3 化疗
关于围手术期化疗(新辅助或辅助)的使用和类型,没有任何建议。
然而,也有一些病例报告,患者因切缘阳性、淋巴结或腹膜受累或未切除脐部而接受术后化疗,复发的可能性很高。21
在晚期疾病中,很难从已发表的系列中得出关于最佳化疗方案的任何结论,因为所使用的治疗类型是异质性的,且患者数量较少。由于转移性疾病的五年总生存率不到20%,因此确定最佳和更有效的治疗方法无疑是医学上的需要。尽管如此,主要使用的药物是顺铂单独或联合使用,如顺铂、甲氨蝶呤和长春花碱(CMV)、甲氨蝶呤-长春花碱-阿霉素-环磷酰胺(MVAC)、顺铂-5-FU-吉西他滨或其他药物。其他报道的药物包括紫杉醇、顺铂和异环磷酰胺。5,21,28由于在免疫组织化学、CEA升高和肿瘤产生黏液方面与结肠癌有一定的相似性,最近发表的病例报告中描述的治疗方案源自胃肠道癌中经常提供的治疗方案--FOLFOX和FOLFIRI。29,30
表5脐尿管癌患者的化疗方案和化疗反应
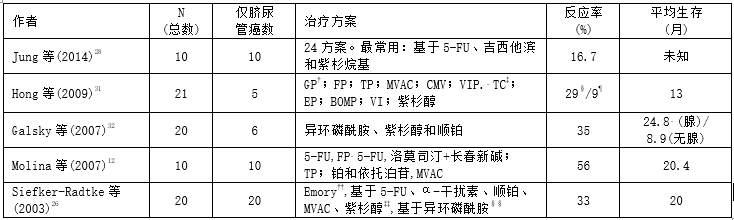
†一线化疗方案。‡二线或三线化疗方案。‡一线化疗的反应率。¶二线化疗的反应率。††5-FU、亚叶酸+吉西他滨+顺铂。‡‡紫杉醇+卡铂、紫杉醇+顺铂、紫杉醇+甲氨蝶呤+顺铂和单独紫杉醇。§§异环磷酰胺、顺铂+吉西他滨、5-FU。BOMP:博莱霉素+长春新碱+丝裂霉素+顺铂;CMV:甲氨蝶呤+长春花碱+顺铂;EP:依托泊苷+顺铂;FP:5-FU+顺铂;GP:吉西他滨+顺铂;MVAC:甲氨蝶呤+长春花碱+阿霉素+顺铂;TC:紫杉醇+卡铂;TP:紫杉醇+顺铂;IV: VP-16+异环磷酰胺;VIP:VP-16+异环磷酰胺+顺铂。
在大型荟萃分析中,作者比较了基于顺铂、5-FU、5-FU+顺铂联合化疗和其他化疗的疗效。共分析了74例患者。5-FU组和5-FU+顺铂组的反应率较高(分别为44%和43%),而非5-FU的反应率较低(9%)。5-FU+顺铂的联合治疗也具有最低的进展率,因此,在本报告中似乎具有最佳的结果。在本文中,使用这两种药物的方案包括:5-FU+亚叶酸、吉西他滨、顺铂;5-FU+IFN-a、顺铂;5-FU+奥沙利铂;5-FU+顺铂。4
其他可用的病例系列,如表5所示。由于疾病罕见,所有病例都包括较少的患者。Hong等人最近报告了对21例非移行细胞膀胱癌患者的回顾性研究,其中包括4例脐尿管癌患者。总反应率为33%,中位生存期为13个月。在研究中,11名患者接受了吉西他滨顺铂、6名接受5-FU顺铂、1名接受紫杉醇顺铂、1名接受MVAC、1名接受CMV和1名接受VIP(依托泊苷-异环磷酰胺-顺铂)。31
在Galsky等人的另一项前瞻性研究中,20名患者,包括6名脐尿管癌患者,接受了异环磷酰胺、紫杉醇和顺铂治疗。总体而言,35%的患者获得了主要缓解,腺癌患者的中位生存时间为24.8个月。32
最后,Siefker-Radtke等人的另一个主要系列报道了使用铂类方案获得33%的总反应率。在接受化疗的20名患者中,观察到4例部分或完全缓解,其中3例采用基于5-FU和顺铂的方案。26
Jung等人最新发表的文章证明了10名脐尿管癌患者接受总共24种不同的姑息化疗方案的治疗的异质性。以5-FU、紫杉烷和吉西他滨为基础的方案是最常见的,所有化疗方案的总反应率为16.7%。2
5.4 靶向治疗
由于先前描述的脐尿管癌和结直肠癌之间的相似性,EGFR抑制剂在结直肠癌中的应用在理论上是可行的。关于这一主题,可获得的数据很少,但却很有趣。在2005年发表的一项吉非替尼1期研究中,包括一名脐尿管癌患者,肿瘤大小短暂减少55%。33最近,Collazo Lorduy等人发表了一份关于转移性脐尿管癌患者的报告,其中靶向外显子组测序显示EGFR扩增和野生型KRAS。34患者使用西妥昔单抗作为单一药物进行治疗,使其反应持续8个月以上。随后,对另外九个样本进行了靶向外显子测序,在九个样本中的四个样本中发现有丝分裂激活蛋白激酶(MAPK)途径突变,但没有EGFR扩增。此外,两例患者携带APC突变。综上所述,EGFR抑制剂治疗在这些病例中肯定是有意义的,然而,需要对该疾病的遗传特征进行进一步评估,并可能导致未来更合理的靶向治疗方法。
5.5 免疫治疗
在过去几年中,免疫疗法改变了许多癌症的治疗模式。不幸的是,据我们所知,迄今为止还没有发表过用检查点抑制剂治疗脐尿管癌的病例。然而,最近的研究表明,错配修复状态预测了免疫检查点阻断与抗PD1治疗的临床益处。35有趣的是,Sirimpun等人评估了7例脐尿管癌患者的微卫星不稳定性(MSI)。19三例显示MSI,1例为MSH2和MSH6,2例为PMS2丢失。为了探索用免疫化合物治疗的可能性,对更大的队列进行进一步评估当然是可取的。
共识声明:
-辅助化疗的益处目前尚不清楚,不建议常规使用。其最佳方案尚未确定。
-在缺乏高水平证据的情况下,我们建议FOLFOX作为首选方案。化疗方案可以根据免疫组化病理学发现进行调整,特别是如果存在组织学上的尿路上皮癌特征(证据级别4,C级)。
-鉴于该肿瘤罕见,应在多学科论坛上讨论该诊断的患者,并应尽一切努力与具有该癌症经验的专家合作观察或讨论该患者。理想情况下,应获得分子学检测数据,以确定潜在的生物途径和可操作的靶点,以指导治疗。最后,鼓励尽可能参与临床试验。
6 结论
脐尿管癌是一种罕见肿瘤,晚期患者预后差。为了改善患者的预后并使治疗模式正规化,需要进行协作。例如,建立国家或国际临床数据库,以及参考癌症机构治疗方法的标准化。更好地了解这种肿瘤的分子特征也可以改善病理学定义,并为这种晚期疾病确定靶向治疗方法。


















共0条评论