[导读] 编译者:wangxiaoxi
往期回顾:
少突胶质细胞瘤,IDH突变和1p/19q共缺失(一)
相当于直径0.55mm、面积0.24 mm^2的≥6个核分裂/10 HPF)被报告为生存期短的指标{11245209}。其他对1p/19q共缺失的CNS WHO 3级少突胶质细胞瘤的研究表明,微血管增生和微血管增生伴坏死比有丝分裂活性升高≥2.5个核分裂/mm^2(相当于≥6个核分裂/10HPF,直径0.55mm,面积0.24 mm^2)而无微血管增生和坏死的生存期更短{24723566;27175000}。然而,定义有丝分裂计数的明确临界点以区分CNS WHO2级与CNS WHO 3级IDH突变和1p/19q共缺失的少突胶质细胞瘤的数据尚不可用。然而,在切除标本中检测罕见的有丝分裂不足以诊断CNS WHO3级IDH突变和1p/19q共缺失的少突胶质细胞瘤。在临界病例中,增殖标志物如Ki-67(MIB1)以及对临床和神经放射学特征的关注(例如,快速症状性生长和对比增强)可能提供有用的额外信息。在CNS WHO3级少突胶质细胞瘤的一小部分(< 10%)中发现CDKN2A和/或CDKN2B位点纯合子缺失,但在CNS WHO2级少突胶质细胞瘤中未发现,它与生存率降低相关,独立于微血管增生伴或不伴坏死{31832685}。因此,CDKN2A纯合性缺失可能作为IDH突变和1p/19q共缺失少突胶质细胞瘤CNS WHO 3级的分子标志物。尽管在组织学上可明确归类为CNS WHO2级或CNS WHO3级的肿瘤中可能不需要常规评估该标志物,但检测CDKN2A纯合性缺失可能有帮助,例如在具有临界组织学特征的肿瘤样本中(即,当存在时,CDKN2A纯合性缺失表明CNS WHO3级肿瘤)。
免疫表型
大多数少突胶质细胞瘤都表现出抗IDH1 p.R132H抗体的免疫反应性{19798509},这有助于与其他透明细胞肿瘤以及非肿瘤和反应性病变进行鉴别诊断{21069360;20661018}。IDH突变和1p/19q共缺失的少突胶质细胞瘤保留ATRX的核表达{22886134;25427834},并且通常缺乏广泛的核p53染色,这与IDH突变胶质瘤中ATRX和TP53突变与1p/19q共缺失的近乎排他性一致{26061751;25848751}。少突胶质细胞瘤对MAP2、S100和CD57(LEU7)呈免疫阳性{11589429;2435103;3314309};然而,这些标志物在星形胶质细胞瘤中也呈阳性。同样,少突胶质细胞谱系转录因子OLIG1、OLIG2和SOX10在少突胶质细胞瘤中表达,但也在星形胶质细胞瘤中表达{16205963;15198128}。GFAP可在混杂的反应性星形胶质细胞中检测到,但也可能染色肿瘤细胞,如小肥胖细胞和胶质纤维少突胶质细胞{6391068;3314309}。正常少突胶质细胞表达的抗原,包括髓鞘碱性蛋白(MBP)、髓鞘蛋白脂蛋白(PLP)、髓鞘相关糖蛋白(MAG)、半乳糖脂(如半乳糖脑苷脂和半乳糖硫脂)、某些神经节苷脂和几种酶(如CAII[碳酸酐酶C]、CNP、甘油-3-磷酸脱氢酶、和LDH)不是少突胶质细胞瘤的诊断有用标志物{2435103;8781974;3110380}。肿瘤细胞间残留神经毡的突触素免疫反应性很常见,不应被误认为神经元或神经细胞分化。然而,少突胶质细胞瘤也可能含有表达突触素和/或NeuN以及神经丝的肿瘤细胞{20464403;12430711}。α-内联蛋白的免疫染色较为常见{19139367}(例如,在一项研究中,发现88.5%的IDH突变和1p/19q共缺失的CNS WHO 3级少突胶质细胞瘤中存在α-内联蛋白免疫染色{24723566}),但不能将其视为1p/19q共缺失的替代标志物{22002423}。同样,NOGO-A阳性也很常见,但不是排他性的{21835431}。H3 p.K28me3(K27me3)的核表达减少与IDH突变胶质瘤中1p/19q共缺失有关{31065834;31773240},但它不能替代1p/19q检测{31912209}。
鉴别诊断
IDH突变和1p/19q共缺失的少突胶质细胞瘤在组织学上可能酷似其他各种病变。富含巨噬细胞的病变,如脱髓鞘疾病的特征或脑梗死导致的病变,通过巨噬细胞标记物的免疫染色和缺乏IDH突变很容易区分。在治疗难治性癫痫发作的部分脑叶切除术标本中有时可见少突胶质细胞的相对增加也缺乏IDH突变。IDH突变的星形细胞瘤缺乏1p/19q共缺失,表现为频繁的核p53免疫染色和核ATRX的缺失。事实上,核ATRX缺失足以诊断IDH突变的星形细胞瘤,而无需额外检测1p/19q共缺失{29497819}。TERT启动子突变常见于IDH突变和1p/19q共缺失的少突胶质细胞瘤,但也有罕见病例报告缺乏TERT启动子突变,并且一些IDH突变但1p/19q完整的星形细胞瘤可能携带TERT启动子突变{23764841;24154961;25314060;25848751}。其他形态学模拟物,如神经细胞瘤、脂肪神经细胞瘤和胚胎发育不良性神经上皮肿瘤,可通过其缺乏IDH突变排除。含有透明细胞的室管膜瘤与少突胶质细胞瘤的不同之处在于其血管周围假菊形团和点片状或环状EMA免疫反应性,以及缺乏IDH突变和频繁的ZFTA(C11orf95)融合。透明细胞脑膜瘤可以通过EMA和desmoplakin阳性、IDH野生型状态和核SMARCE1缺失来区分{28474749}。转移性透明细胞癌与少突胶质细胞瘤的不同之处在于其肿瘤边界清晰,细胞角蛋白和EMA阳性,缺乏IDH突变。具有少突胶质细胞特征的毛细胞型星形细胞瘤是IDH野生型,携带MAPK通路基因改变,尤其是FGFR1改变{31729570}。然而,罕见的IDH突变和1p/19q共缺失的少突胶质细胞瘤伴KIAA1549::BRAF融合病例已有报道{22591444;22568401}。在儿童中,伴有MYB、MYBL1、FGFR1或BRAF改变的弥漫性胶质瘤可能具有少突胶质细胞瘤或少突星形细胞瘤的组织学特征,但在生物学上是不同的肿瘤{30848347}。弥漫性软脑膜胶质神经元肿瘤的临床表现以及MAPK通路基因改变(尤其是KIAA1549:BRAF融合)和1p缺失(或1p/19q共缺失)但无IDH突变的组合有助于鉴别诊断{25720745}。恶性小细胞星形细胞肿瘤,包括IDH野生型胶质母细胞瘤和H3 G34突变型弥漫性半球胶质瘤,必须通过其IDH野生型状态和特异性改变(包括频繁的EGFR扩增和10号染色体丢失或导致H3 p.G35(G34)变异的突变)与细胞丰富少突胶质细胞瘤区分开来{23041832;15470710}。
少突胶质细胞瘤NOS、少突星形细胞瘤NOS和少突星形细胞瘤NEC
伴有典型少突胶质细胞瘤组织学的弥漫性胶质瘤罕见病例,其中IDH突变和1p/19q共缺失的分子检测失败(例如,由于组织可用性有限、肿瘤细胞含量低、检测结果不确定、或其他阻碍分子检测的情况)或无法完成的情况在组织学上可归类为少突胶质细胞瘤NOS{29372318},并根据是否存在间变的组织学特征指定为CNS WHO 2级或3级。免疫组化显示IDH突变和ATRX保留核阳性可能支持少突胶质细胞瘤的诊断。然而,除非成功检测1p/19q共缺失,否则这类肿瘤不能归类为少突胶质细胞瘤,IDH突变和1p/19q共缺失。少突胶质细胞瘤相关标记物的免疫组化阳性,如α-内联蛋白{19139367;22002423}和NOGO-A{21835431},核H3 p.K28me3(K27me3)免疫染色减少{31065834;31773240},以及核CIC或FUBP1表达的免疫组化缺失{24117486;24030748}不足以替代1p/19q共缺失检测。
少突星形细胞瘤NOS的诊断仅适用于弥漫性胶质瘤,该弥漫性胶质瘤由明显的两种不同的肿瘤细胞类型混合组成,形态学上类似于少突胶质细胞或星形细胞特征的肿瘤细胞,检测IDH突变、核ATRX表达、和1p/19q共缺失失败或无法完成。在这种情况下,具有少突胶质细胞或星形胶质细胞特征的肿瘤细胞可以弥漫性混合或分离成不同的双相区域。然而,少突星形细胞瘤的诊断是不鼓励的,因为分子分析表明这些肿瘤携带IDH突变星形细胞瘤或IDH突变和1p/19q共缺失少突胶质细胞瘤的典型遗传特征{26061751;25143301;25848751}。因此,对于具有混合或不明确组织学特征的弥漫性胶质瘤,应评估IDH突变和核ATRX表达缺失,以及保留核ATRX时1p/19q共缺失{29497819}。
已报告双基因型少突星形细胞瘤的罕见病例。这些肿瘤具有两种不同的IDH突变肿瘤细胞群特征:一种显示星形细胞瘤相关改变,如ATRX缺失和TP53突变,另一种显示少突胶质细胞瘤相关1p/19q共缺失{17031656;28419269;25359109;25304041}。WHO肿瘤分类不认为这些肿瘤是IDH突变型弥漫性胶质瘤的一种独特类型或亚型,但可将其暂定为双基因型少突星形细胞瘤NEC{29372318}。
细胞学
在细胞学制片中,少突胶质肿瘤细胞的细胞核呈均匀圆形,细胞质清晰,只有中等程度的胶质纤维。核周晕是组织学制片的典型表现,但在涂片制片中并不常见。在CNS WHO 3级少突胶质细胞瘤中,偶尔观察到强烈的嗜酸性细胞质颗粒。也可能存在携带具有多极突起的嗜酸性细胞质的反应性星形胶质细胞。在某些情况下,可以看到微钙化和突出的血管。
诊断分子病理学
少突胶质细胞瘤在分子上由IDH1或IDH2突变和1p/19q共缺失定义。几乎所有的肿瘤都有TERT启动子突变,缺乏ATRX突变,并显示保留的核ATRX表达。TP53突变不常见{26061751;31025086;28572459}。少突胶质细胞瘤的诊断需要通过IDH1 p.R132H免疫组化和/或IDH1或IDH2基因测序证明IDH突变,以及通过FISH、显色原位杂交或分子遗传学检测证明1p/19q共缺失。在没有IDH1 p.R132H阳性免疫组化的情况下,应进行IDH1(密码子132)和IDH2(密码子172)较少见突变的测序。1p/19q共缺失的分子检测不需要特殊的方法,但建议1p/19q检测能够检测全臂染色体丢失。只有两个染色体臂的完全缺失才能诊断少突胶质细胞瘤,因为在一些IDH野生型胶质母细胞瘤和IDH突变型星形细胞瘤中可能存在1p或19q的部分或单独缺失。常见缺失区域中的FISH探针或在杂合性缺失分析中仅丢失少数PCR探针可能无法反映全臂丢失,从而可能导致假阳性结果{21129060}。此外,任何拷贝数分析都需要足够的肿瘤细胞含量,最好是>30%,以避免评估1p/19q共缺失时的假阴性结果。免疫组织化学检测IDH1 p.R132H的表达和保留的核ATRX表达,而不显示1p/19q共缺失,不足以诊断IDH突变和1p/19q共缺失的少突胶质细胞瘤,即使是经典的组织学。在免疫组化保留核ATRX表达的IDH突变胶质瘤中,1p/19q分析仍然是准确分子诊断的关键。大多数IDH突变和1p/19q共缺失的少突胶质细胞瘤携带TERT启动子突变{23764841};然而,在IDH突变胶质瘤中检测TERT启动子突变不足以诊断少突胶质细胞瘤,因为罕见病例为TERT野生型,包括青少年患者的肿瘤{30231927}。在1p/19q完整的IDH突变星形细胞瘤亚组中也观察到TERT启动子突变{28255664;23955565}。DNA甲基化阵列分析通过结合少突胶质细胞瘤相关甲基化标记和1p/19q共缺失的检测揭示了诊断性分子特征{29539639;29967940}。通过FISH进行的拷贝数分析还提供了1q和19p多体性信息,已在CNS WHO 2级和3级1p/19q共缺失的少突胶质细胞瘤亚组中检测到,并且与生存期缩短相关{31140557;19808867;22710961}。在一小部分CNS WHO 3级IDH突变和1p/19q共缺失的少突胶质细胞瘤中检测到CDkN2A纯合子缺失,但在CNS WHO 2级中未检测到,据报告,这是生存期缩短的独立标志物{31832685}。
无法充分分析IDH突变和1p/19q共缺失,但表现出少突胶质细胞瘤典型组织学特征的肿瘤被归类为少突胶质细胞瘤NOS{29372318}。这表明该肿瘤是一种组织学上典型的少突胶质细胞瘤,可能表现出与IDH突变和1p/19q共缺失的少突胶质细胞瘤相似的临床表现,但无法进行分子分析或其检测结果不确定或信息不充分{29372318}。具有少突胶质细胞组织学但缺乏IDH突变和1p/19q共缺失的肿瘤不应归类为少突胶质细胞瘤NOS,但必须进一步评估以排除组织学模拟,如胚胎发育不良性神经上皮肿瘤、透明细胞室管膜瘤、神经细胞瘤、多形低度恶性青年神经上皮肿瘤、和毛细胞型星形细胞瘤,以及以BRAF、FGFR1、MYB或MYBL1改变为特征的分子不同的弥漫性胶质瘤{30848347}。
必要和理想的诊断标准
见框2.02。
分期
无临床相关性。
预测和预后
在较早的研究和基于人群的登记研究中,组织学诊断的肿瘤的生存数据被纳入的无IDH突变和1p/19q共缺失的胶质瘤所混淆。较早系列的回顾性分子分层证实,只有肿瘤亚群(30-80%)对应于IDH突变和1p/19q共缺失的少突胶质细胞瘤{24723566;27573687;26354927}。总体而言,IDH突变和1p/19q共缺失的少突胶质细胞瘤与治疗的良好反应和 > 10年的中位生存时间相关。例如,参加前瞻性临床试验并接受放疗联合丙卡巴肼、洛莫司汀和长春新碱(PCV)化疗的CNS WHO3级IDH突变和1p/19q共缺失少突胶质细胞瘤患者的中位生存期≥14年{28640702}。少突胶质细胞瘤一般局部复发但可表现为软脑膜扩散。复发时的恶性进展很常见,但少突胶质细胞瘤的恶性进展时间通常长于IDH突变的星形细胞瘤{21153680}。
临床因素
与更有利结局相关的临床因素包括诊断时患者年龄较小、额叶位置、癫痫发作、术后Karnofsky评分较高和肉眼可见的手术切除完全{18272388}。其中许多因素(包括年龄)在分子定义的少突胶质细胞瘤研究中得到证实,但有限的随访仍然是一个问题{31561286;28532485}。
影像
成像时存在对比增强提示IDH突变CNS WHO2级和3级胶质瘤(包括少突胶质细胞瘤)的结局更差{30417117;30529899}。随访MRI显示的生长速率增加与间变的组织学特征(包括微血管增生和有丝分裂计数增加)、神经影像学对比增强以及无进展生存期(PFS)缩短有关{32025725}。
手术
切除范围越大,CNS WHO 2级少突胶质细胞瘤患者的总生存期(OS)和PFS越长,但不会延长至恶性进展的时间{24313617}。使用体积肿瘤评估的研究显示,广泛切除与结局改善相关。然而,与IDH突变星形细胞瘤患者相比,留下一些肿瘤组织似乎对少突胶质细胞瘤患者的生存影响更小{29016833;31248860;30206763},这可能是因为少突胶质细胞瘤对放疗和化疗的敏感性更高。
组织学特征
与较差预后相关的组织学特征包括坏死、高有丝分裂活性、细胞丰富、核异型性、细胞多形性和微血管增生。然而,这些因素的预后意义需要在分子特征肿瘤患者中重新评估。在单变量和多变量分析中,IDH突变和1p/19q共缺失的CNS WHO3级少突胶质细胞瘤的高有丝分裂计数(≥2.5个核分裂/mm^2,相当于≥6个核分裂/10HPF,直径0.55 mm,面积0.24 mm^2)与PFS和OS缩短相关{27175000}。在缺乏CDKN2A纯合性缺失的病例中,微血管增生和/或坏死的存在具有预后意义{31832685}。
CNS WHO 分级
较早的研究报告CNS WHO分级是少突胶质细胞瘤患者生存的独立预测因素{15193024;11245209;15159478;15977639}。然而,这些研究早于少突胶质细胞瘤的分子标准。在一项对同时发生IDH突变和TERT启动子突变的胶质瘤患者进行的研究中,2级肿瘤患者的生存时间长于3级肿瘤患者(中位OS:分别为205.5个月和127.3个月){24722048}。最近的一项多中心研究观察到2级少突胶质细胞瘤患者的中位OS为188个月,而3级肿瘤患者的中位OS为119个月{32721633}。在多变量分析中,该差异仍然显著。一项针对176例IDH突变和1p/19q共缺失的少突胶质细胞瘤(CNS WHO 2级和3级)患者的研究也显示,CNS WHO 3级肿瘤患者的OS更短{28532485}。相反,对212例IDH突变和1p/19q共缺失少突胶质细胞瘤患者的回顾性分析未检测到CNS WHO分级是OS的显著预测因素{25701198}。同样,来自日本和癌症基因组图谱(TCGA)的联合队列数据表明,分级的预后作用有限{25848751}。这些回顾性研究的解释需要谨慎,因为未考虑其他预后相关因素,如切除范围,患者接受了不同的术后治疗。
增殖
一项针对220例IDH突变和1p/19q共缺失的CNS WHO 3级少突胶质细胞瘤患者的研究显示,在单变量和多变量分析中,MCM6标记指数值≥50%和Ki-67标记指数值≥15%与OS缩短相关{31561286}。在30例CNS WHO2级少突胶质细胞瘤患者中,MCM6和Ki-67指数也与OS相关{31561286}。CNS WHO2级和3级少突胶质细胞瘤患者的高有丝分裂计数(≥2.5个核分裂/mm^2,相当于≥6个核分裂/10 HPF,直径0.55 mm,面积0.24 mm^2)与随访MRI显示的生长速率增加和PFS缩短相关{32025725}。
遗传学改变
回顾性研究的现有证据表明,FISH检测到的1q和19p共多体性伴1p/19q共缺失与早期复发和较短生存期相关{31140557;19808867;22710961}。在约三分之一的CNS WHO2级IDH突变和1p/19q共缺失的少突胶质细胞瘤中检测到9p等位基因丢失,但它们与生存期缩短无关{29663171}。其他研究报告称,9p21.3(CDkN2A基因位点)的等位基因丢失与CNS WHO3级少突胶质细胞瘤患者的生存期缩短相关{15099021;26385879}。在CNS WHO2级少突胶质细胞瘤中未观察到涉及CDkN2A基因位点的纯合子缺失{29663171;31832685},但在一小部分CNS WHO3级少突胶质细胞瘤中观察到CDKN2A基因位点的纯合子缺失,其与不良结局相关{31832685}。与CNS WHO3级少突胶质细胞瘤患者不利结局相关的其他变化包括PIK3CA突变{30975663;15289301}、TCF12突变{26068201}和MYC信号转导增加{27090007}。PTEN突变与CNS WHO2级少突胶质细胞瘤患者的生存期缩短相关{29663171}。研究发现,较高的肿瘤突变负荷预示着IDH突变胶质瘤(包括少突胶质细胞瘤)的生存期较短{32642696}。CIC突变已被报告为预后不良的标志物{26017892},但在其他系列中未证实该结果{26354927;29663171}。未观察到CDK4扩增或RB1纯合性缺失对结局产生影响{31832685}。
治疗
IDH突变和1p/19q共缺失的CNS WHO2级少突胶质细胞瘤患者的最佳术后治疗是一个正在讨论的问题。肿瘤切除后,由于治疗相关的神经毒性是一个主要问题,因此通常会推迟放疗和化疗直至肿瘤进展{28483413}。患有症状性和进展性肿瘤、CNS WHO 3级肿瘤或术后残留较大肿瘤的患者通常会立即接受进一步的放疗和/或化疗{28483413}。欧洲癌症研究与治疗组织(EORTC)22845试验表明,辅助放疗可延长进展性CNS WHO2级胶质瘤患者的PFS,但不会延长OS{16168780}。随机试验的长期随访数据显示,CNS WHO 3级少突胶质细胞瘤患者接受放疗 + PCV化疗后,OS显著延长{27050206;23071237;23071247}。对于进展性CNS WHO2级少突胶质细胞瘤患者,替莫唑胺或PCV辅助化疗也可能是一种可行的治疗策略{15284265;19118062;16541434;25344884}。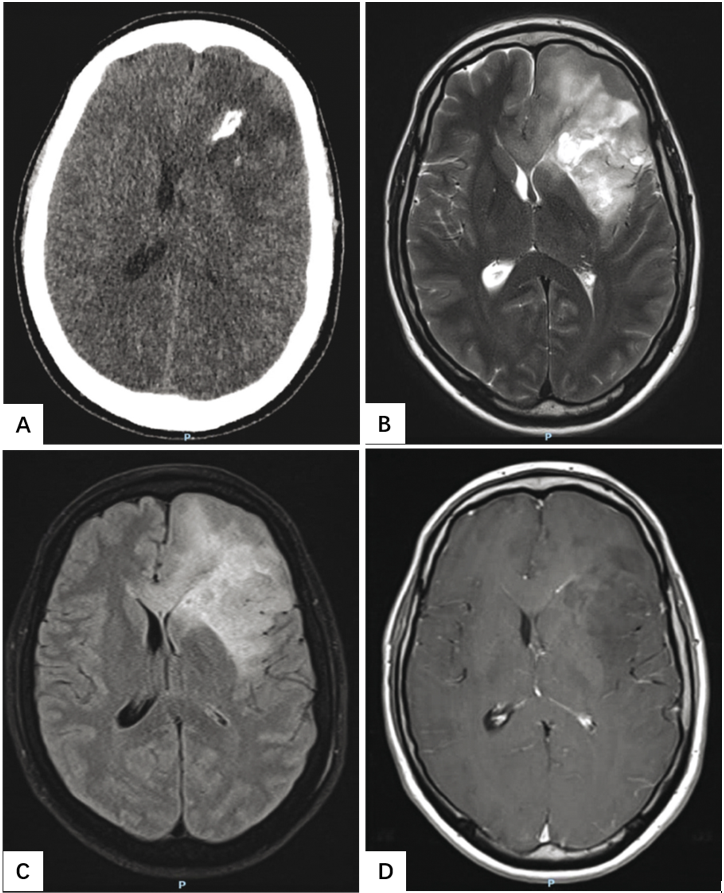
图2.15少突胶质细胞瘤,IDH突变和1p/19q共缺失,CNS WHO2级。以左额叶低级别少突胶质细胞瘤为主。
A 累及胼胝体并有占位效应;无静脉造影剂的CT显示低密度区存在钙化。
B T2加权MRI的胼胝体受累和占位效应。
C 肿瘤在FLAIR MRI上产生高信号病灶,皮质受累,边界弥散,信号不均匀。
D 在T1加权MRI上,静脉给予钆后无对比增强。
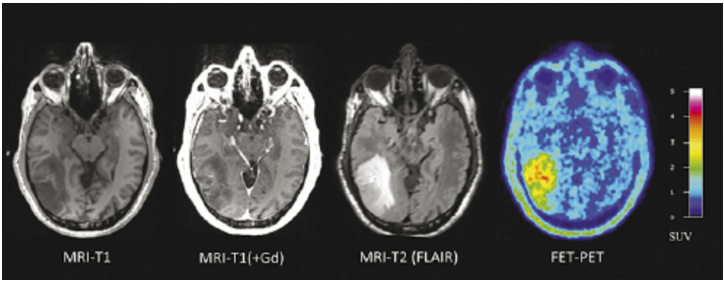
图2.16少突胶质细胞瘤,IDH突变和1p/19q共缺失,CNS WHO3级。神经影像学特征。钆给药后(+ Gd)T1低信号病灶伴局灶性对比增强。T2-FLAIR显示病变范围,FET PET显示代谢活性增加。
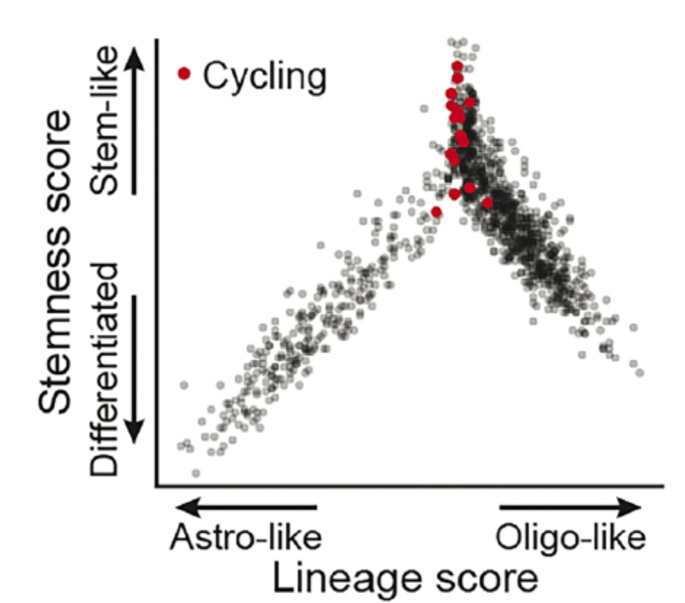
图2.17少突胶质细胞瘤,IDH突变和1p/19q共缺失。人少突胶质细胞瘤的单细胞RNA测序分析。基于全基因组表达程序推断的发育层级,显示少突胶质细胞瘤细胞可以再现干细胞样状态或沿少突胶质细胞或星形细胞谱系的更分化的状态。循环细胞(用红色标记)富集于干细胞样状态(3080,3202)。

图2.18少突胶质细胞瘤,IDH突变和1p/19q共缺失,CNS WHO2级。
A 少突胶质细胞瘤常浸润皮质,个别肿瘤细胞聚集在神经元胞体周围。
B 少突胶质细胞瘤细胞有时嵌入浅蓝色黏液基质内。

图2.19少突胶质细胞瘤,IDH突变和1p/19q共缺失,CNS WHO3级。
A 细胞丰富区域。许多肿瘤细胞保留圆形至卵圆形的核形态。
B 广泛的神经周围和血管周围卫星灶。
C 微血管增生。
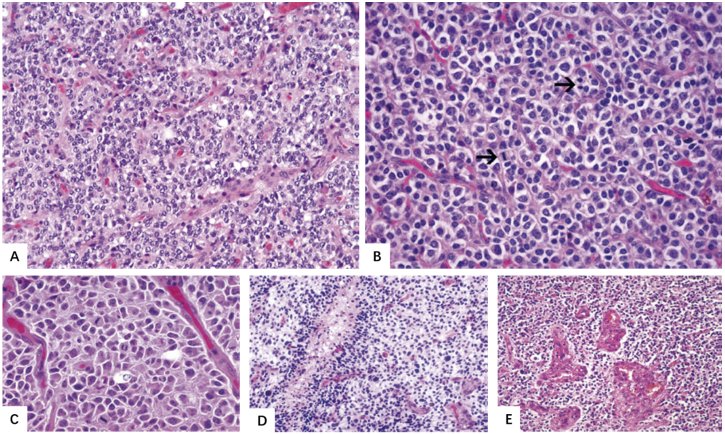
图2.20少突胶质细胞瘤,IDH突变和1p/19q共缺失,CNS WHO3级。
A 少突胶质细胞瘤中细胞过多的程度可以非常高。血管在细胞过多区域变得肥大和增生。
B 具有蜂窝样细胞和有丝分裂活性(箭头)的细胞丰富胶质瘤的典型图像。
C 明显的核异型性和活跃的有丝分裂活性。
D 局灶性坏死伴栅栏状肿瘤细胞。
E 显著的微血管增生。
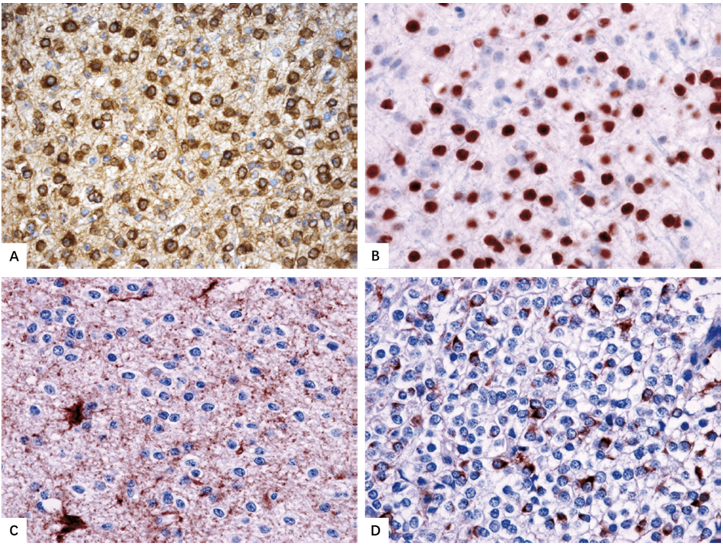
图2.21 IDH突变和1p/19q共缺失少突胶质细胞瘤的免疫组化特征。
A MAP2。
B OLIG2。
C GFAP。
D 胶质纤维少突胶质细胞(GFAP染色)。
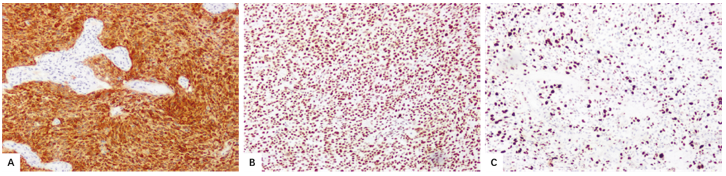
图2.22少突胶质细胞瘤,IDH突变和1p/19q共缺失,CNS WHO3级。
A IDH1 p.R132H具有强弥漫性免疫反应性。
B 肿瘤细胞核内保留的ATRX免疫反应性。
C Ki-67标记指数升高是典型的。
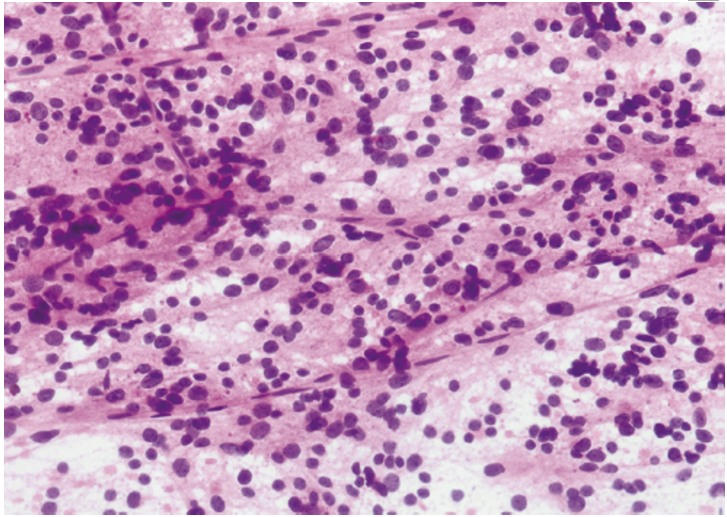
图2.23少突胶质细胞瘤,IDH突变和19q共缺失,CNS WHO2级。少突胶质细胞瘤的术中涂片切片显示肿瘤细胞在纤维背景下与纤细的脉管系统相关。

图2.24少突胶质细胞瘤,IDH突变和1p/19q共缺失,CNS WHO2级。
FISH显示1p/19q共缺失(无多体性)。
A 1p信号为红色,1q信号为绿色。
B 19q信号为红色,19p信号为绿色。

图2.25少突胶质细胞瘤,IDH突变和1p/19q共缺失。前瞻性随机欧洲癌症研究与治疗组织(EORTC)26951研究中,80例患者在59.4 Gy放疗(RT)后接受丙卡巴肼、洛莫司汀和长春新碱(PCV)辅助化疗的无进展生存期(PFS);接受RT联合PCV化疗的患者的20年PFS率为31.3%,而仅接受RT的患者为10.8%。
框2.02少突胶质细胞瘤、IDH突变和1p/19q共缺失的诊断标准必要标准:
弥漫浸润性胶质瘤和IDH1密码子132或IDH2密码子172错义突变a和1p和19q的联合全臂缺失
理想标准:
少突胶质细胞瘤、IDH突变和1p/19q共缺失的DNA甲基化组谱
保留ATRX的核表达、TERT启动子突变
a当进行DNA甲基化组谱分析并明确将肿瘤分配到甲基化类别少突胶质细胞瘤、IDH突变和1p/19q共缺失时,可能不需要IDH突变分析。
——全文完——
























共0条评论