[导读] 编译整理:wangxiaoxi
脑膜瘤
定义
脑膜瘤包括一个肿瘤家族,最有可能来源于蛛网膜的脑膜上皮细胞(CNS WHO 1、2或3级)。
ICD-O编码
9530/0 脑膜瘤
ICD-11编码
2A01.0Z 脑膜瘤 , 非特指的
相关术语
无
亚型
参见框7.01。

部位
脑膜瘤通常发生在颅内、椎管内或眼眶位置。最常见的部位包括大脑凸面(肿瘤通常位于矢状窦旁,与大脑镰和/或静脉窦相关)、嗅沟、蝶骨嵴、鞍旁/鞍上区域、视神经鞘、岩骨嵴、天幕和后颅窝。脑室内和硬膜外定位并不常见。大多数脊膜瘤发生在胸部。肿瘤位置与突变谱密切相关:凸面脑膜瘤和大多数脊膜瘤通常携带22q缺失和/或NF2突变,而颅底脑膜瘤携带AT1、TRA7、SMO和/或PI3CA突变。高级别脑膜瘤最常见于凸面和其他非颅底部位。罕见的原发性脑膜瘤发生在神经轴外(如肺)。
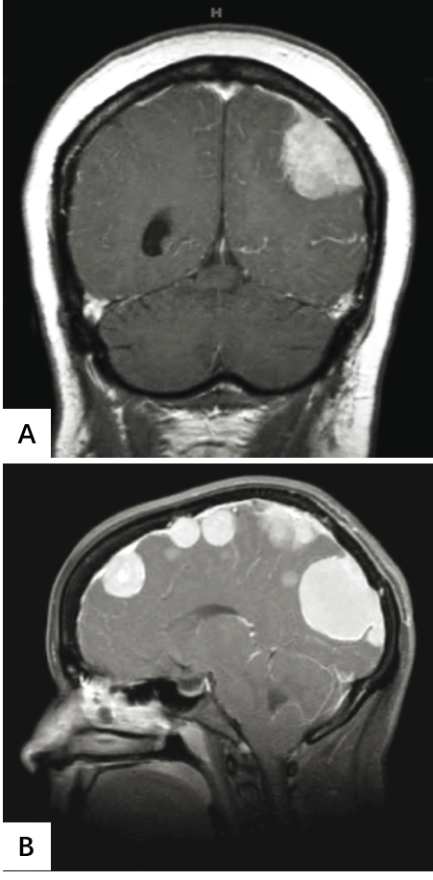
图7.01脑膜瘤。
A 增强后T1加权MRI显示轴外、左侧凸起肿块,对比增强均匀,有硬脑膜尾征。
B 多发性脑膜瘤。增强后MRI显示同一患者有数个硬脑膜肿块,符合多发性脑膜瘤。大多数此类病例来自单个克隆,被认为代表硬脑膜扩散。
临床特征
脑膜瘤通常生长缓慢,伴有神经功能缺损,根据肿瘤位置不同而不同。临床体征和症状可能由邻近结构压迫引起。头痛、无力和癫痫发作很常见,但对脑膜瘤无特异性。高级别肿瘤和具有侵袭行为分子生物标志物的肿瘤进展更快。
影像
脑膜瘤在MRI上特征性表现为等密度、均匀增强的硬脑膜肿块。钙化很常见,在CT上显示最好。常见的影像学特征是肿瘤周围出现对比增强硬脑膜尾征,通常对应于反应性纤维血管组织,不一定能预测硬脑膜受累。某些组织学亚型(如分泌型、血管瘤型/微囊型、富含淋巴浆细胞型和高级别脑膜瘤)的肿瘤周围脑水肿较为明显。脑膜瘤内部或周边可形成囊肿。神经影像学特征并不总是对脑膜瘤的诊断或估计预后具有特异性;但是,钆增强MRI的定量和定性影像学特征可以提示脑膜瘤的组织学分级,并预测更可能的患者结局。
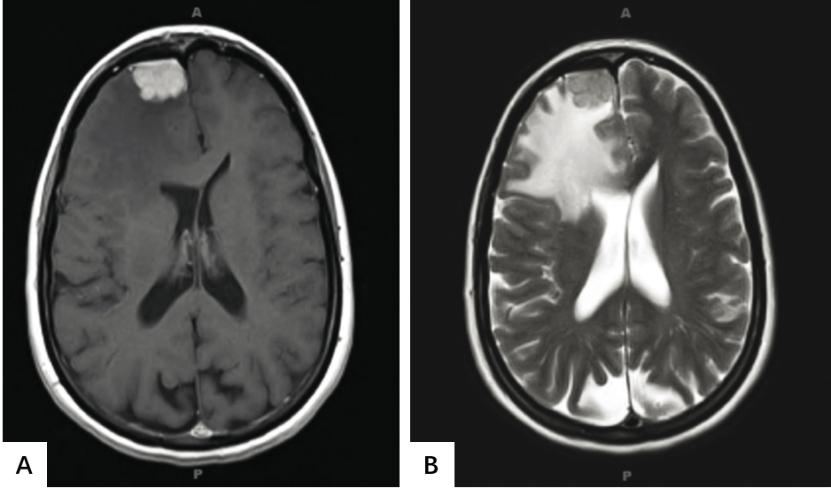
图7.02分泌型脑膜瘤。
增强后T1加权(A)和T2加权(B)MRI显示小的分泌性脑膜瘤,显示广泛的瘤周脑水肿。
传播
脑膜瘤通常侵犯邻近的解剖结构(尤其是硬脑膜),尽管在侵袭性较强的亚型中局部扩散的速度和范围往往更大。因此,根据其位置和分级,一些脑膜瘤产生了相当大的患者发病率和死亡率。颅外转移(例如肺、胸膜、骨和/或肝)罕见,最常与CNS WHO 3级脑膜瘤相关。在一个系列中,所有脑膜瘤的转移发生率为0.67%,CNS WHO 2级(2%)和3级(9%)脑膜瘤的发生率更高。
流行病学
发病率
脑膜瘤在美国的平均年年龄调整发生率为8.58例/100 000人,占CNS肿瘤的37.6%。它是成人中最常见的原发性脑肿瘤(估计在人群中的发生率高达1%),但在0-19岁儿童中最少见。
年龄、性别和种族分布
脑膜瘤的风险随年龄增长而增加;诊断时的中位年龄为66岁。在所有年龄中,女性1级脑膜瘤的发生率是男性的2.32倍,在绝经前观察到最大的风险差异(3.28),此后降低。黑人的发病率显著高于白人(9.25 vs 7.88例/10万人-年)。
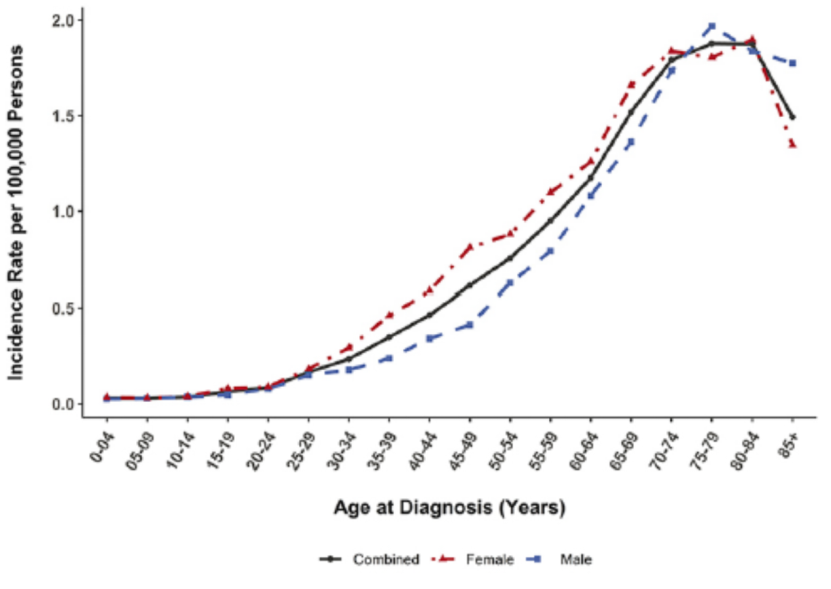
图7.03脑膜瘤。
按诊断时年龄和性别列出的非恶性脑膜瘤发生率(病例数/100 000人-年)。数据来自2012-2016年美国中央脑肿瘤登记中心(CBTRUS),包括所有50个州和波多黎各。脑膜瘤由ICD-O-3代码9530-9534和9537-9539定义。
病因
暴露于电离辐射是脑膜瘤的主要确定环境风险因素。儿童期接触电离辐射的人群比成年期接触电离辐射的人群,以及接触高水平电离辐射的人群,如原子弹幸存者和接受头部治疗性辐射治疗的患者,其风险更高。有证据表明,较低剂量的电离辐射也会增加脑膜瘤的风险,包括在儿童或青少年时期暴露于CT。头癣队列研究为暴露于电离辐射后发生脑膜瘤的遗传易感性提供了强有力的证据。
许多发现提示激素与脑膜瘤风险相关,包括女性发病率高于男性,一些脑膜瘤中存在激素受体,以及与内源性/外源性激素使用相关的风险适度增加的报告,体重指数和当前吸烟,以及与母乳喂养≥6个月相关的风险降低。一项研究发现接受孕激素治疗的患者脑膜瘤中存在PIK3CA突变富集。一项大型病例对照研究显示,患有脑膜瘤的女性比未患有脑膜瘤的女性更有可能报告激素相关疾病:子宫肌瘤(比值比:1.2;95%CI:1.0-1.5)、子宫内膜异位症(比值比:1.5;95%CI:1.5-2.1)和乳腺癌(比值比:1.4;95%CI:0.8-2.3)。将特定的化学物质、饮食、职业、头部创伤和手机使用与脑膜瘤联系起来的尝试一直没有定论。但是,过敏性疾病(如哮喘和湿疹)与脑膜瘤风险降低的相关性相当一致。
一些综合征增加了脑膜瘤发生的风险,最显著的是2型神经纤维瘤病,并且已经报告了与痣样基底细胞癌综合征(Gorlin综合征)的罕见相关性。在NF1、VHL、PTEN、PTCH1、BAP1、SUFU、SMARCE1和CREBBP生殖系缺陷的家族中也报告了脑膜瘤。其中许多综合征与放射敏感性增加有关。家族史研究表明,不能归因于已确定综合征的遗传易感性发挥作用,阳性家族史与发生脑膜瘤的个人风险高达4倍相关。全基因组关联研究最近在10号和11号染色体上检测到与脑膜瘤风险显著相关的SNP。10p12 SNP位于MLLT10基因中,该基因是多种基因融合的组分,可导致各种形式的白血病。
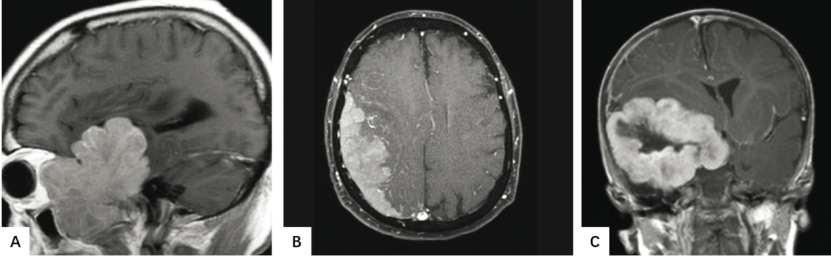
图7.04脑膜瘤。增强后T1加权MRI。
A 乳头状脑膜瘤。偶见乳头状脑膜瘤以菜花状影像学表现为特征。
B 非典型脑膜瘤。非典型脑膜瘤与邻近脑之间的不规则界面。
C 间变性脑膜瘤。中心坏死、对比增强的肿瘤具有明显的占位效应。
发病机制
22号染色体单体是脑膜瘤中最常报告的基因异常,> 50%的肿瘤显示22q12.2(编码NF2基因的区域)等位基因丢失。高级别脑膜瘤表现出更复杂的基因变化,1p、6p/q、10q、14q和18p/q丢失,2p/q、3p、4p/q、7p和8p/q丢失(频率较低),以及CDKN2A和/或CDKN2的杂合子或纯合子缺失。染色体臂的获得较少见,多见于血管瘤型、化生型和微囊型脑膜瘤。
两个散发性脑膜瘤系列的基因组测序确定了相似的脑膜瘤亚群,因其独特和相互排斥的突变分布以及其与临床行为和解剖位置的相关性而引人注目。脑膜瘤的第一个亚群由NF2突变和22号染色体丢失定义。第二个亚群缺乏NF2突变,其特征是AKT1中复发性致癌(p.E17K)突变,以及TRAF7、KLF4或SMO中的改变。这些发现已得到证实并得到扩展,还发现了致癌性PIK3CA突变。额外拷贝数丢失的积累、一般基因组不稳定性和TERT启动子突变的出现主要限于NF2突变和/或染色体22q丢失组,而AKT1、KLF4、SMO、PIK3CA和/或TRAF7突变病例具有平衡的拷贝数特征。YAP1的改变主要发生在没有NF2突变的儿童脑膜瘤亚组中,可能导致Hippo通路的激活。
NF2驱动的脑膜瘤的起始和恶性进展已在基因工程小鼠模型中得到证实。通过将编码腺病毒的重组Cre注射到携带floxed Nf2等位基因(Nf2flox/flox)且蛛网膜特异性缺失_Nf2的小鼠的硬膜下腔,使Nf2失活,可诱导脑膜瘤,证明Nf2失活是脑膜瘤形成的必要初始步骤。NF2改变见于所有CNS WHO分级的脑膜瘤,因此是脑膜瘤发展的早期事件。通过联合蛛网膜特异性缺失Nf2以及Cdkn2a和Cdkn2b,在小鼠中实现了脑膜瘤进展为CNS WHO 2级和3级。
相反,非NF2脑膜瘤的肿瘤起始迄今尚未充分建模,但实验证据支持其在肿瘤发生中的作用。脑膜瘤热点突变AKT1 p.E17K也见于乳腺癌和膀胱癌,导致AKT1的组成性激活并在小鼠中诱导白血病(不能仅由野生型AKT1诱导),表明AKT1 p.E17K突变是致癌驱动因素。SMO热点突变p.L412F和p.W535L与SMO反式激活活性增加和基底细胞癌的发生有关。KLF4与背景依赖性肿瘤抑制或肿瘤发生有关,它可能在脑膜瘤中起肿瘤抑制因子的作用。在功能上,KLF4 p.K409Q突变触发HIF1α的诱导。TRAF7与MAP3K3(MEKK3)相互作用,参与TNF-α/NF-κB信号转导通路的调节。携带TRAF7突变的非NF2脑膜瘤显示抑制性免疫检查点分子PDL1、IDO和TDO(TDO2)上调,将该突变与脑膜瘤中的免疫应答抑制联系起来。PIK3CA突变的致癌潜力已在几种肿瘤类型中得到证实,PIK3CA突变可激活脑膜瘤中的几种增殖相关信号通路。而且,PIK3CA突变与抗激素治疗有令人信服的联系。接受长期孕激素治疗的脑膜瘤女性比未接受激素治疗的女性更常携带PIK3CA突变,使用环丙孕酮进行高剂量抗雄激素治疗可导致PIK3CA突变的颅底脑膜瘤富集。POLR2A突变可能通过改变转录机制和必需脑膜基因来驱动脑膜瘤的发展。
肉眼外观
脑膜瘤一般为实性、球状、局限性肿块,有广泛的硬脑膜附着。有些呈分叶状或双叶状,另一些则呈扁平、地毯状、斑块状生长,如沿蝶骨硬脑膜生长者。脑膜瘤是坚硬的、橡胶状的或(有时)胶冻状或囊状的。一些脑膜瘤,特别是脊髓砂粒样亚型,由于砂粒体丰富,可有砂粒样质地;另一些则如纤维亚型,可表面光滑。大多数1级脑膜瘤移位压迫邻近脑但无粘连或侵袭性,易与脑分离。然而,高级别脑膜瘤可能广泛粘连和侵袭性,也可能以坏死区域为特征。脑膜瘤也可侵犯硬脑膜窦,例如矢状窦旁脑膜瘤可部分或完全阻塞上矢状窦。偶尔,脑膜瘤侵犯颅骨,诱发颅顶、蝶骨或眼眶骨等区域的反应性骨质增生。脑膜瘤也可附着或包绕脑动脉和(或)颅神经,但很少浸润这些结构。它们可通过颅骨浸润到头皮和皮肤的软组织,以及颅外间隙,如眼眶。
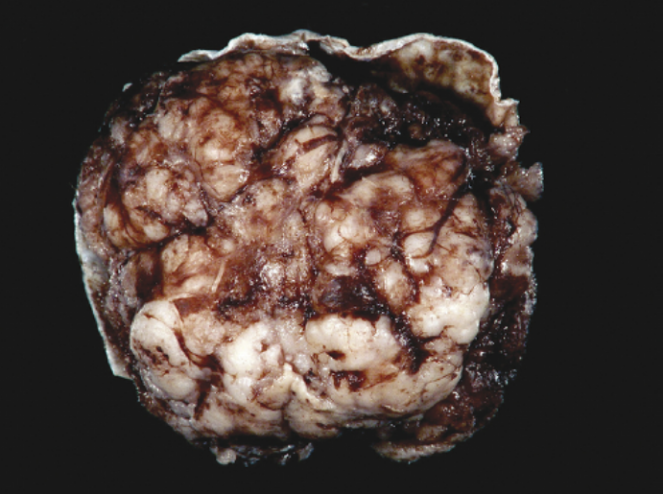
图7.05脑膜瘤。
该手术切除的脑膜瘤显示典型的隆起表面和硬脑膜附着。
组织病理学
框7.01中描述的15种亚型反映了脑膜瘤广泛的形态学谱。最常遇到的亚型是脑膜上皮型、纤维型和移行型脑膜瘤。大多数亚型具有良性临床病程,对应CNS WHO 1级。
然而,更有侵略性的生长特征可以出现在这些形态模式中的任何一个;换句话说,非典型或间变性脑膜瘤的定义标准(见框7.02)无论潜在的亚型是什么都应适用。值得注意的是,两种亚型-脊索样和透明细胞脑膜瘤-已被报告比平均CNS WHO 1级脑膜瘤具有更高的复发可能性,因此被指定为CNS WHO 2级,独立于其他适用于CNS WHO 2级非典型脑膜瘤的标准;然而,更大规模和前瞻性研究将有助于验证这些拟定的CNS WHO 2级分配,并建议额外的预后生物标志物。此外,从历史上看,横纹肌和乳头状形态符合CNS WHO 3级,而不考虑任何其他恶性指征。尽管乳头状和横纹肌样特征常与其他侵袭性特征合并出现,但最近的研究表明,CNS WHO分级应采用CNS WHO 2级非典型或CNS WHO 3级间变性脑膜瘤的标准,并非仅基于横纹肌样或乳头状组织学。与脑膜瘤分级相关的问题,以及使用特定生物标志物的建议,在以下每种亚型的描述中进行了讨论。

免疫组织化学和增殖
免疫组织化学可协助确定脑膜瘤诊断,并可排除其他鉴别考虑。脑膜瘤典型表达EMA和波形蛋白。然而,EMA染色可能是微弱的、局灶性的,甚至是不存在的,特别是在纤维性和高级别亚型中,波形蛋白阳性的特异性较低。SSTR2A几乎在所有病例中均有较强的弥漫性表达,但在神经内分泌肿瘤中也可表达。
Ki-67的免疫组织化学可以突出增殖的不均匀分布,指导有丝分裂计数的评估。研究表明,增殖指数 > 4%的病例复发率与CNS WHO 2级(非典型)脑膜瘤相似,指数 > 20%的病例死亡率与CNS WHO 3级(间变性)脑膜瘤相似。一项研究发现,有丝分裂标志物磷酸组蛋白H3染色可以将脑膜瘤分为三个风险组,定义为每1000个肿瘤细胞中标记有丝分裂为0-2、3-4和≥5个;然而,影响染色和解释的实验室间差异限制了这些发现的解释。
——未完待续——




















共0条评论