[导读] 译者:薛德彬
引言:多个临床试验成功证实抗体-药物缀合物(ADC)对HER2低表达癌具有显著的治疗反应。相应的乳腺癌HER2检测和判读指南呼之欲出,让我们先了解一些基本概念和历史变化,特别重视HER2低表达癌的新进展
Evolving concepts in HER2 evaluation in breast cancer: Heterogeneity, HER2-low carcinomas and beyond.
乳腺癌HER2评估概念的演变:异质性、HER2低表达癌及其未来(一)
Marchiò C, Annaratone L, Marques A, Casorzo L, Berrino E, Sapino A.
Semin Cancer Biol. 2021 Jul;72:123-135. doi: 10.1016/j.semcancer.2020.02.016. Epub 2020 Feb 26.
PMID: 32112814
免费全文链接:
https://www.sciencedirect.com/science/article/pii/S1044579X20300493?via%3Dihub#bib0525
摘要
人表皮生长因子受体2(HER2)是众所周知的乳腺癌不利预后因素,也是曲妥珠单抗和其他抗HER2化合物的靶点。90年代HER2阳性乳腺癌的开创性研究打开了临床研究和肿瘤学实践的新纪元,重塑了该疾病的自然史。在诊断病理学中,HER2状态通常通过免疫组织化学(IHC,评估HER2蛋白表达水平)和原位杂交(ISH,评估HER2基因状态)的组合进行评估。为此,国际建议是由该领域专家的一致意见制定的,多年来,根据新的实验和临床数据,这些建议发生了变化。在这篇综述文章中,我们将记录有助于更好地评估临床实践中HER2状态的变化,此外,我们将讨论IHC和ISH以及转录组学分析定义的HER2异质性,批判性地描述HER2不确定结果的复杂性。最后,我们将介绍HER2突变的临床影响,并根据新出现的关于特定抗HER2药物在缺乏HER2扩增所决定的经典癌基因增加的乳腺癌亚组中的疗效的临床数据,定义即将出现的HER2低表达乳腺癌类别。
关键词:HER2;Amplification;Mutation;HER2-low;Heterogeneity
1、简介
人表皮生长因子受体2(HER2)是一种孤儿酪氨酸激酶受体,属于人表皮受体家族。HER2没有配体,但HER2是该家族其他三种受体的首选二聚化伙伴1。受体之间(同源/异源)二聚后,下游酪氨酸激酶信号级联被激活,从而触发细胞增殖、迁移、侵袭和存活1。
HER2扩增导致约15%的乳腺癌中HER2过度表达2。这种机制一方面导致不良预后(由于对细胞增殖、迁移、侵袭和生存的影响,所有癌症的标志),另一方面,它提供了一种独特的可能性,可以使用单克隆抗体曲妥珠单抗进行靶向治疗,曲妥珠单抗的靶向是HER2的细胞外结构域,从而改变正常的酪氨酸激酶信号(图1)。自90年代以来,这种治疗选择从根本上改变了HER2阳性疾病的自然史。除外单克隆抗体曲妥珠单抗(目前在新辅助、辅助和转移情况下与化疗一起使用),多年来还研发了其他抗HER2治疗化合物(图1)。Pertuzumab是一种人源化单克隆抗体,在与曲妥珠单抗不同的结构域上与HER2结合,并防止同源和异源二聚体的形成,作为晚期疾病一线治疗的首选方案,Pertuzumab被常规添加到紫杉烷和曲妥珠单抗方案中3,并且它也在新辅助治疗中使用4。其他抗HER2化合物(酪氨酸激酶抑制剂,如拉帕替尼,或抗体药物结合物,如T-DM1)主要用于转移或临床研究。值得注意的是,尽管过去几年中已在HER2阳性疾病中确定了几个具有预后价值的标志物,但目前抗HER2药物可能有治疗反应的最佳预测因素是HER2过度表达/扩增5。
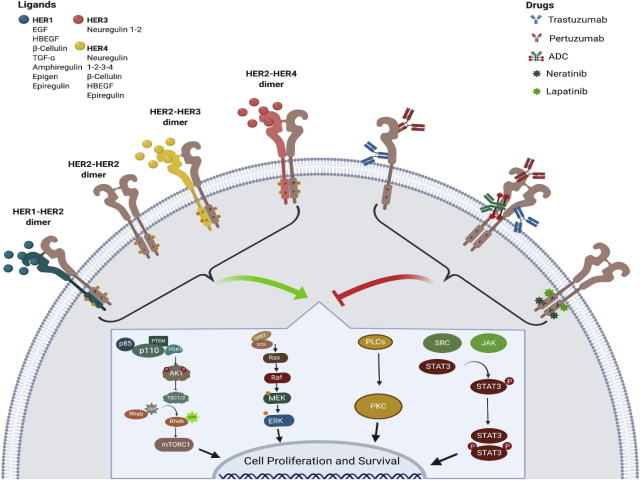
图1 HER2下游通路激活,抗HER2靶向药物。HER2是一种配体-孤儿跨膜酪氨酸激酶受体,属于人类表皮受体(HER)家族。HER2与其他三种受体(HER1或EGFR、HER3和HER4)中的一种同源或异源二聚,触发与癌细胞增殖、侵袭和存活相关的不同信号通路的激活1106。基于HER2激活调节的治疗方法包括蛋白质的不同靶点。单克隆抗体结合HER2的细胞外结构域,对曲妥珠单抗或pertuzumab具有选择性抗原偏好,导致信号级联减少107。抗体-药物偶联物被设计为在肿瘤细胞内化后释放药物,以减少全身副作用。小分子酪氨酸激酶抑制剂(TKI),如拉帕替尼和奈拉替尼,通过对激酶结构域ATP结合位点的特异性,分别以可逆或不可逆的方式抑制HER2受体的催化活性108。ADC:抗体药物结合物。
在诊断病理学中,HER2状态通过免疫组织化学(IHC,评估HER2蛋白表达水平)和原位杂交(ISH,评估HER2基因状态)的组合进行常规评估,这是仅有的两种获得公认临床验证的技术2,5,6。为此,根据该领域专家的共识制定了国际建议。根据新的实验和临床数据,这些建议多年来有所改变。在这篇综述中,我们将记录有助于更好地评估临床实践中HER2状态的变化;此外,我们将讨论不同的场景,包括IHC和ISH以及转录组学分析定义的HER2异质性、HER2不确定结果的复杂性、HER2突变和即将出现的HER2低表达乳腺癌类别。
2、ASCO/CAP指南对乳腺癌HER2的评估
在诊断实践中,每个新诊断的乳腺癌以及任何复发或转移的乳腺癌都要评估HER2状态,根据该领域的国际专家组的建议进行HER2状态的评估。自2007年以来,美国临床肿瘤学会/美国病理学家学会(ASCO/CAP)起草了HER2检测建议7,并仔细讨论了使用IHC和荧光ISH(FISH)进行HER2检测的性能和解释的最佳分析前和分析要求。分析前阶段对IHC和ISH的正确性能有巨大影响,适当控制冷缺血时间对于确保福尔马林固定石蜡包埋(FFPE)组织中抗原、DNA和RNA的保存至关重要2,8-10。
曲妥珠单抗的初始临床试验使用IHC评分3+,或评分2+以及阳性FISH试验(定义为>50%的肿瘤细胞中HER2/CEP17比值≥2),作为纳入标准。在这些试验中,IHC评分3+定义为在>10%的肿瘤细胞中出现强烈的完整的细胞膜染色,2+定义为在>10%的肿瘤细胞中出现弱到中度的完整的细胞膜染色11。在2007年ASCO/CAP指南中,IHC检测时肿瘤细胞的阳性阈值提高到30%以上,FISH检测时HER2/CEP17比值也提高到≥2.2,以减少假阳性结果的数量,减少无效抗HER2治疗的使用7。
2009年,ASCO/CAP对2007版FISH检测指南中HER2异质性进行了补充。它将HER2基因异质性定义为:使用双探针时,≥5%至<50%的浸润性肿瘤细胞的比值≥2.2,或使用单探针时,HER2信号≥6/细胞12。建议在扫描整个玻片以寻找异质性后,选择并评估浸润性肿瘤的2-4个代表性区域;FISH检测到成簇(>20个细胞)HER2扩增时,应当按照HER2/CEP17比值和/或HER2信号/细胞进行单独评估和报告12。
2013版ASCO/CAP指南将阳性阈值恢复为当初的IHC检测中肿瘤细胞>10%,FISH检测中HER2/CEP17比值≥2,以避免假阴性结果13。这些建议引起了人们对假阴性结果的关注,假阴性结果可能会乳腺癌患者失去潜在挽救生命的治疗机会(抗HER2治疗)13。这一立场是基于这种治疗可能导致的副作用频率相对较低13。特别是,这些指南引入了ISH流程图的概念,在对ISH结果进行评分时,首先考虑HER2/CEP17比值,然后分析HER2/CEP17比值<2时的HER2平均拷贝数,这代表一种两步评估方法。在17号染色体着丝粒区(CEP17)拷贝数异常的情况下,这种评估方法有助于避免HER2扩增的错误分类。事实上,我们14和其他人15-17已经证明,具有这种FISH模式的乳腺癌更频繁地存在真正的HER2扩增和17号染色体着丝粒区的获得/扩增,而不是17号染色体(Chr17)多倍体。
最后,2013年ASCO/CAP建议通过采用IHC评估中使用的大于10%的相同阈值,进一步解决了HER2异质性问题,从而将HER2异质性定义为存在具有不同HER2拷贝数和/或HER2/CEP17比值的单独细胞群,至少占整个肿瘤细胞群的10%13。指南建议,在这些情况下,至少应在其中20个细胞中进行单独计数13。
2018年,ASCO/CAP专家组成员提供了这些指南的更新,重点是五个具体的临床问题(表1)6。在这方面,2018年ASCO/CAP指南最好被视为2013年版的整合,而不是一个新版本。未修改截断值,亦未修改定义,而是对文献数据进行了回顾,以评估临界病例的阳性或阴性结果的证据水平。

作为要回答的第一个问题,专家组成员的重点是需要反馈性ISH测试的2分以上乳腺癌的正确定义:需要在超过10%的肿瘤细胞群中呈现弱到中度的完全膜染色,才能将乳腺癌分类为2+。然而,众所周知,可能遇见HER2表达的少见模式,例如,具有强而不完全的膜染色(典型的微乳头状癌),或强而完全的染色但仅占整个肿瘤群不到10%的细胞亚群中。在所有这些情况下,必须执行ISH。在后一种情况下,这表明肿瘤内异质性很高,合理的常见做法包括测试额外的肿瘤蜡块,以评估HER2过度表达/扩增的真实程度。由于HER2扩增克隆可能占主导地位,因此导致加用抗HER2治疗,这些高度异质性的癌最可能从复发和/或转移进展的再次检测时获益。
第二个临床问题与2013版提出的强制性建议有关,即当粗针穿刺活检标本在初始评估HER2结果为阴性时,应在手术标本上重复进行HER2测试。2018更新版修正了这一说法,建议每当遇到以下情况之一时,可以重复HER2检测:i)粗针活检标本中的浸润性肿瘤数量较少;ii)切除标本含有高级别癌,其形态与粗针区不同;iii)经ISH和IHC检测后,HER2的粗针活检结果不明确;iv)对粗针活检标本的处理存在疑问(缺血时间长、固定剂使用时间短、固定剂不同),或者病理学家根据检测错误认为阴性检测结果是可疑的6。
其余三个临床问题与ISH结果有关,建议参考2016年Press及其同事提出的5组分类19。第1组(HER2/CEP17比值≥2,HER2拷贝数>4)和第5组(HER2/CEP17比值<2,HER2拷贝数<4)代表了HER2评估谱的两个极端(分别存在和缺乏HER2扩增),作者指出,这将占所有双探针ISH测试结果的95%。剩下的5%将被归类为第2-4组6,其特点是非单一解释的挑战性场景,多年来一直存在争议,2018年ASCO/CAP更新版建议在综合重新解释ISH和IHC分析的基础上进行额外的研究,以达到最准确的HER2状态结果(阳性与阴性)(表1)。
特别是,第2组确定了ISH检测结果显示HER2/CEP17比值≥2但平均HER2拷贝数<4的肿瘤,这一模式通常反映了17号染色体单体的存在。在对曲妥珠单抗初始临床试验的回顾性分析中,虽然该组样本量较小,无法从统计学上排除治疗可能带来的获益,但大多数患者似乎没有改善抗HER2治疗的结果6。因此,如果在额外检查期间确认ISH模式,建议将这些病例视为阴性,除非IHC显示肿瘤细胞评分为3+6。
在第3组中,我们包括携带平均HER2拷贝数≥6和因CEP17拷贝数增加而导致HER2/CEP17比值<2的病例,由于采用ASCO/CAP 2013算法,结果记为阳性。这些病例非常罕见(0.4–3%),未包括在曲妥珠单抗的初始临床试验中,因此关于含曲妥珠单抗化疗的获益的临床证据有限。然而,根据多个独立小组对这些病例中发生真正HER2扩增的证明14-17,尤其是当HER2拷贝数较高时,2018年更新版支持对这些肿瘤的HER2阳性定义,除非缺乏HER2过度表达(即标本显示IHC评分为1+或0)6。
最后,第4组乳腺癌显示可疑的HER2基因状态(HER2/CEP17比值<2.0,平均HER2拷贝数≥4且<6),如果IHC也显示HER2表达评分为2+,则定义为HER2双重不确定。实验室内此类病例的数量因ISH检测所涉及的患者群体而异,但似乎约占病例的5%(范围:1%-16%)6。根据2013版建议,携带这种ISH模式的乳腺癌被标记为“可疑”,抗HER2药物的使用由临床医生选择13。毫无疑问,第4组病例对肿瘤学家和患者构成了挑战,因为他们对是否推荐HER2靶向治疗存在矛盾心理。还应注意的是,由于没有明确的阳性或阴性检测结果,导致对同一组织样本进行多次检测,并使用替代的Chr17探针检测来解决HER2状态。重要的是要强调乳腺癌中的Chr17是高度重现性改变的概念14,20,21,因此,在这些情况下,使用其他Chr17探针映射到与CEP17不同的区域可能会产生误导,而不是提供支持:例如,通过使用映射到短Chr17臂的探针,该臂恰好含有大量染色体丢失,HER2/Chr17探针比值可能会增加,甚至会导致仅基于人工计算的阳性结果。此外,这些Chr17替代探针未经分析或临床验证,即它们未用于显示抗HER2治疗疗效的临床试验6。2018年ASCO/CAP更新版的专家组也强烈建议不要将其作为常规测试策略,并建议如果没的进行重复HIS检测并由另一名观察人员重新计数,则依靠IHC评分的重新评估6。如果在额外ISH检查后证实了双重不确定的结果,则该癌优先标记为阴性,因为在没有蛋白过度表达(IHC评分3+)的情况下,患者是否可能受益于HER2靶向治疗尚不确定6。应该注意的是,尽管其潜在获益的影响缺乏了解,但这项建议设想对于每个细胞的平均HER2信号≥4.0且<6.0和HER2/CEP17比值<2.0的患者是可能获益的。NSABP B-47试验最近证明,HER2阴性癌(IHC评分1+/2+,ISH阴性)不受益于加用曲妥珠单抗22。遗憾的是,这项研究没有包括HER2状态不确定的癌,因此缺少关于这些癌治疗反应的数据。
毫不奇怪,到目前为止关于2018版指南影响的研究表明,新指南的应用导致HER2测试的阴性率增加。这一观察结果源于对第2组和第4组病例的重新分类,现在建议将其评分为阴性23,24。
3、HER2阳性乳腺癌的肿瘤内和肿瘤间异质性
在包括乳腺癌在内的各种类型的人类癌症中,肿瘤内遗传异质性已得到充分证明25。在诊断实践中常规评估HER2的病理学家早已熟知HER2过度表达和扩增可能呈现异质模式(图2)。已经描述了具有异质性HER2状态的三种不同类型的细胞分布26:“簇集”型,特征是不同部位存在两种不同的肿瘤细胞克隆,一种携带HER2扩增,另一种具有正常HER2状态;“马赛克”型,显示不同HER2状态细胞的弥漫性混合;“分散型”,在HER2阴性肿瘤细胞群中有分离的HER2扩增细胞。

图2 HER2表达的肿瘤内异质性。通过免疫组织化学评估乳腺癌中HER2蛋白表达异质性模式的代表性显微照片。A 一个样本显示了两个不连续的肿瘤克隆,其中一个显示HER2表达(评分3+),另一个缺乏HER2过度表达,并夹杂一些孤立性HER2阳性细胞(插图)。B 具有不同程度HER2表达的乳腺癌,某些区域得分为2+(虚线),其他区域得分为1+(点线)。C 样本中聚集的HER2评分2+细胞(箭头)被HER2评分1+细胞包围。D HER2评分1+肿瘤细胞群中散在的HER2评分2+细胞(箭头)。图像来自常规分析用于HER2评估的样品,并签署研究知情同意书。
几项研究表明,在乳腺癌中,HER2基因异质性的存在频率变化很大(1-34%)27-36,在ISH和/或IHC对HER2状态不确定的病例中更为常见27,30,33,34,37。例如,Allison等人27和Chang等人29发现,90%以上的FISH HER2不确定病例呈现HER2异质性;Bukley等人观察到,HER2边界线病例以及HER2/CEP17比值最高的HER2阴性病例的异质性水平最高18。一些人认为HER2异质性是FISH和IHC导致乳腺癌的可疑HER2结果的重要原因18,36,37。在这方面,我们的研究小组已经证明,每当评估HER2扩增细胞和非扩增细胞弥漫混合的乳腺癌中的HER2状态时,都会导致HER2计数不明确38。这些病例的典型特征是HER2扩增水平较低38,其他病例也观察到了这一点28,33,36,39。
一些研究还将17号染色体多倍体性频率的增加与HER2异质性联系起来37,39,40。如前所述,17号染色体多体性在乳腺癌中是一种罕见的事件,其特征是17号染色体着丝粒(CEP17)14-17更频繁地增加或扩增。因此,在这种情况下应使用术语CEP17异常拷贝数(尤其是在间期核中通过FISH评估时)。然而,这种在HER2异质癌中独立观察到的CEP17拷贝数增加的现象可能支持以下理论,即HER2异质性至少部分是由染色体不稳定性引起的40。
就对患者预后的影响而言,Shafi等人37发现,具有遗传异质性的HER2-FISH非扩增肿瘤与体积较大较大、组织学分级较高和淋巴结转移频率相关,这是乳腺癌重要的不利预后因素。几项研究表明,HER2异质性的存在与患者的无病生存期和总生存期较短有关,这与患者的预后较差有关32,33,40。在分析对治疗的反应时,HER2异质性患者似乎对抗HER2靶向治疗反应较低30,41-43,这也可以通过含曲妥珠单抗的化疗新辅助治疗后病理完全反应(pCR)的较低来证明35,38。这些结果最近在2019年ASCO会议上由Metzeger Filho及其同事提出的一项优秀的研究中得到了证实,他们设计了一项II期研究,其中对II期和III期HER2阳性乳腺癌对新辅助性T-DM1和pertuzumab的反应进行了评估。诊断性粗针穿刺活检样本中的HER2异质性定义为:i)FISH检测,>5%且<50%的肿瘤细胞呈HER2阳性12;ii)肿瘤有一个区域的检测结果为阴性。10%的病例发现HER2异质性(n=16/157)。与没有HER2异质性证据的HER2阳性癌获得55%的pCR相比,在任何异质性病例中均未实现pCR。当通过雌激素受体(ER)状态进行调整时,HER2异质性与pCR之间的关联仍然显著。这些数据表明,HER2异质性乳腺癌可能是HER2阳性肿瘤的一个独特亚类,可以考虑采用不同的治疗方法44。
一项基于基因拷贝数分析和大规模平行测序的研究中,分别检测12例HER2异质性乳腺癌HER2阴性和HER2阳性成分,确定了每个病例中仅限于HER2阴性细胞的潜在驱动基因改变。体外模型显示,BRF2和DSN1过度表达/扩增以及HER2 I767M突变,可以弥补HER2异质性乳腺癌HER2阴性成分中HER2扩增不足的缺陷45。
另一个需要考虑的重要方面是HER2阳性疾病的肿瘤间异质性。首先,高达45%的病例也可能表达不同水平的激素受体;第二,分子亚型的组成各不相同;最后,在肿瘤中可以观察到不同的基因改变。
虽然激素受体状态似乎不能决定HER2扩增乳腺癌的总体遗传特征,但特定的遗传学异常可能是HER2阳性乳腺癌亚组的特征46-48。激素受体状态也至少部分影响临床定义(即IHC/FISH)HER2阳性癌固有分子亚型的分布。绝大多数为HER2丰富型癌,但管腔型癌(管腔B比管腔A更普遍)和基底样癌的数量不容忽视46,49,50。
值得注意的是,通过转录组学分析定义为“HER2丰富”的HER2阳性乳腺癌,对抗HER2治疗有很高的反应率,因此确定了一类对抗HER2化合物有超级反应的乳腺癌50,51。Prat及其同事52最近在使用双HER2阻断不用化疗的五项新辅助临床试验(SOLTI-PAMELA、TBCRC023、TBCRC006、PER-ELISA、EGF104090)中,通过PAM50分析了HER2阳性疾病中HER2 mRNA水平和HER2丰富的固有亚型。与其他类型相比,PAM50定义的HER2丰富的固有亚型与高HER2 mRNA水平和高pCR率显著相关52。这些数据表明,这种生物标记物可以帮助约40%的HER2阳性乳腺癌患者降低化疗水平52。
事实上,HER2扩增患者的不同内在亚型之间存在着广泛的患者间差异。在一组通过全基因组测序分析的66例HER2扩增乳腺癌中,仅在以PAM50衍生的HER2丰富亚型为特征的肿瘤中检测到TP53突变,而PI3KCA基因没有任何改变。相反,归类为管腔型的乳腺癌显示PIK3CA突变频率较高,且无TP53改变46。有趣的是,与PIK3CA野生型肿瘤相比,在接受新辅助蒽环类紫杉烷化疗加抗HER2治疗的HER2阳性肿瘤队列中,PIK3CA突变癌(占整个队列的21.4%)不太可能实现pCR。对于激素受体阳性癌,PIK3CA野生型和PIK3CA突变肿瘤之间的pCR率差异更为显著53。
Zhao及其同事报道,与HER2阳性/ER阴性乳腺癌相比,一系列HER2阳性/ER阳性乳腺癌显示预后较好而对曲妥珠单抗的获益减少,TP53突变率降低,HER2在mRNA水平和蛋白质水平的表达程度较低54。
未完待续
















共0条评论