[导读] 译者:薛德彬
前文阅读:
乳腺癌HER2评估概念的演变(一)
4、基于RNA的方法检测HER2状态
众所周知,HER2基因状态与HER2 mRNA水平之间存在高度相关性,这已被多项研究证实55-57。这使得RNA评估可以作为HER2评估的一种可能选择。目的是了解基于RNA的检测是否能够补充IHC和DNA FISH分析,从而完全解决HER2状态的问题。HER2 mRNA分析已经应用了多种技术,包括定量程序和原位检测方法,但它们在临床实践中并未得到广泛应用,尽管通过RNA评估确定生物标记物变得更加可行。
通过实时定量PCR(qPCR)进行HER2 mRNA检测的可能性已得到广泛评估57-59。已经研究了在显微切割的乳腺癌中使用qPCR在单反应中评估HER2 DNA扩增和mRNA表达的机会,尽管FFPE组织样本中不可避免地发生核酸降解,但在94%的样本中成功检测到HER2 mRNA57。
鉴于qPCR是定量和客观的,而IHC是半定量和观察者依赖性的,qPCR方法被提议作为IHC的替代方法,以减少免疫组织化学的差异性。Denkert及其同事60发现,随着ER阳性肿瘤中表达水平的逐渐增加,HER2 mRNA的表达更高,并且可以检测到,而在ER阴性病例中发现了不同组的HER2阳性和HER2阴性肿瘤60。ER阳性病例中HER2 mRNA表达的连续性引起了对HER2评估临界水平的选择的质疑,强调了需要在其他队列中进一步评估HER2 mRNA表达。Dabbs及其同事61评估了由FDA批准的IHC和FISH分析得出的实验室HER2结果与使用Oncotype DX试验单独报道的qPCR得出的HER2 mRNA评估结果之间的一致性。他们的结果表明,Oncotype DX qPCR检测的HER2假阴性率大于50%61。作者特别对那些使用FDA批准的程序导致明确HER2阳性患者的qPCR结果不确定或阴性的患者提出了警告。这就是为什么正如ASCO/CAP指南所述,基于mRNA的技术未被公认为诊断实践中评估HER2状态的替代方法。
有人提出了许多原因来解释不一致的结果。HER2表达/扩增的异质性可能是这方面的关键,但HER2水平低扩增的病例可能至少部分导致这些不一致:事实上,ISH分析中使用了阈值,ISH分类为HER2阳性的未选择病例可能具有广泛的HER2扩增。
小滴数字PCR(ddPCR)是另一种mRNA评估方法,其基础是将PCR反应混合物分成数千个小滴状物,使每个小滴状物包含1或0个靶RNA分子。它能够高精度量化mRNA表达。自这项技术问世以来,已经提出了一些旨在评估HER2在乳腺癌中表达的研究。Meehan及其同事证明,ddPCR可以应用于FFPE组织中测量HER2 mRNA62。当应用490 mRNA HER2拷贝数/μl的截断值时,发现在区分HER2阳性和HER2阴性病例方面完全一致(100%)。根据2013年ASCO/CAP指南建议,他们在分析中还包括6例HER2可疑病例,这些病例经ddPCR一致归类为阴性62。在另一项研究中,ddPCR被应用于乳腺癌和胃癌样本中HER2 mRNA的测定,最终目的是寻找ddPCR在处理可疑病例和肿瘤内异质性这两个临床挑战中的可能作用63。ddPCR分析将IHC和FISH双重可疑病例定义为HER2阴性患者63。作者承认,ddPCR的弱点在于,临床样本的高度肿瘤内异质性可能会产生假阴性结果63。空间信息的丢失确实是基于mRNA的体外分析的主要缺点之一64。
为了避免与标准分子程序相关的缺点,已经提出了原位mRNA检测方法(图3)。Wang等人开发了一种新的FFPE组织原位RNA分析平台,即所谓的“RNAscope”65,据IHC和FISH报道,在肿瘤内异质性或可疑/双重可疑结果的病例中,该平台优于qPCR65。对7例IHC染色模式不均一但FISH结果明确(5例扩增,2例未扩增)的病例进行RNAscope HER2分析,与FISH相比,RNAscope对其进行分类的准确性为100%。相比之下,qPCR与FISH的一致性仅为42.8%。在不确定的病例中,RNAscope能够将FISH不确定的病例分为HER2阳性和阴性,当IHC结果明确时,这与IHC一致。FISH/IHC双重不确定的病例在mRNA水平上与仅FISH不确定的病例没有差异,RNAscope将26例(27%)中的7例分类为阳性66。

图3 HER2的免疫组织化学、DNA-FISH和RNA-FISH。评估两种人类乳腺癌细胞系HER2状态。BT-474细胞为HER2阳性,呈现3+蛋白表达(A)、DNA FISH检测到HER2扩增(B;红色为HER2,绿色为CEP17)、HuluFISH探针评估的高水平HER2 mRNA(C)(PixelBiotech GmbH,由MetaSystems s.r.l.提供)。MCF7细胞在蛋白质水平(D)为HER2阴性,缺乏HER2扩增(E;红色为HER2,绿色为CEP17),当通过mRNA FISH进行评估时,只能看到极少红色信号(F)。
我们的团队参与了单分子RNA FISH技术的验证,该技术用于检测FFPE组织切片中的RNA(FFPE smFISH),用于量化HER2在一系列具有不同HER2状态的乳腺癌中的表达和肿瘤内空间异质性67。在我们的系列研究中,我们能够观察到一例IHC 2+/DNA FISH阴性病例的HER2表达水平与IHC 2+/DNA FISH阳性和IHC 3+组中的肿瘤相似。相反,来自IHC 2+/DNA-FISH阳性组患者的一些肿瘤,按照2013年ASCO/CAP指南接受了靶向治疗,显示HER2表达水平接近IHC 2+/DNA-FISH阴性组的表达水平67。这些数据提出了这样一个问题:该评估是否有助于确定患者对治疗更可能或更少的反应,尤其是在目前被归类为HER2阴性的罕见病例中,其中HER2 mRNA水平与评分2+/HER2扩增和评分3+的病例相似。
通过在肿瘤多个不同的空间区域进行定量测量,我们能够测量肿瘤内转录异质性的各个方面:我们观察到,属于同一分子亚型的肿瘤具有不同的转录肿瘤内异质性谱,这表明不仅类型和平均表达水平,但是,表达特定生物标记物的细胞的空间分布也可能影响肿瘤的演变和对治疗的反应67。
Schilz及其同事试图将组织中的转录物、蛋白质和信号网络与空间分辨率联系起来:他们提出了一种成像质量流式细胞术的应用,以实现组织中mRNA和蛋白质的多重检测68。在70例不同HER2状态的乳腺癌中,HER2 mRNA和HER2蛋白存在良好的相关性。在26例HER2扩增样本中,有21例HER2 mRNA显著上调,其中16例HER2 mRNA水平比对照组织高出10倍以上。与对照组织相比,在26例HER2扩增的样本中,有19例检测到HER2蛋白的显著表达。在这19个HER2扩增样本中,有3个显示HER2蛋白显著过度表达,但其HER2 mRNA水平低于大多数其他扩增样本。由于该技术的复杂性和FFPE样本的使用,其中一些差异可能与RNA降解有关,然而,有必要确定患者样本中的一些mRNA与蛋白质水平比值差异是否由于可能反映在临床特征中的患者特异性去调节所致68。
5、HER2低表达乳腺癌:该领域的新实体
病理学家一直致力于区分HER2阳性和HER2阴性乳腺癌。2018年ASCO/CAP更新版加强了这种二分法诊断工作,坚实的临床数据表明,只有HER2癌基因增加导致的肿瘤才能从曲妥珠单抗的化疗中获益22。因此,医学肿瘤学家在考虑HER2时采用了二元治疗决策,其基础是假设只有HER2过度表达和扩增定义的HER2阳性患者应提供抗HER2药物。
近年来,开发了新的治疗性化合物,尤其是抗体-药物缀合物(ADC),其设计用于靶向并在癌细胞内传递化疗,从而减少对细胞毒性剂的全身暴露(图4)。第一类靶向HER2的ADC由曲妥珠单抗和细胞毒性药物emtansine(T-DM1)组成,药物抗体比为3.5。与卡培他滨联合拉帕替尼或医生选择的治疗方法相比,T-DM1在两个3期试验中显示出了优越的疗效和良好的风险-收益曲线,这两个3期试验涉及HER2阳性的晚期乳腺癌患者,这些患者之前接受过包括曲妥珠单抗和化疗在内的HER2靶向治疗69-71。T-DM1目前被批准用于HER2阳性转移性乳腺癌患者,这些患者之前接受过曲妥珠单抗和紫杉烷治疗72。最近,Katherine研究的结果显示,T-DM1在含曲妥珠单抗的新辅助化疗后残留疾病患者中具有显著优势73。
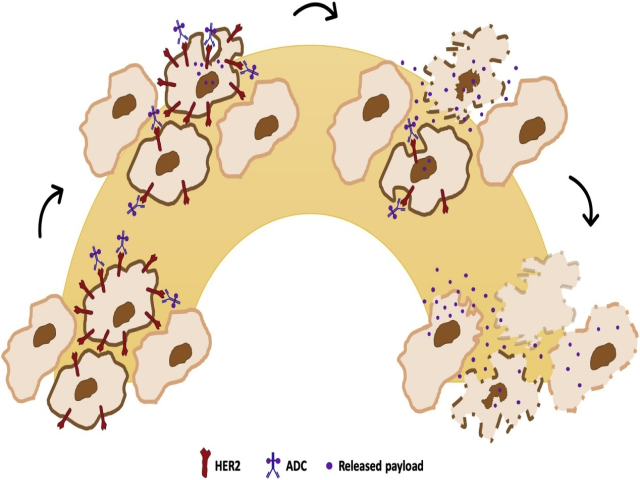
图4 抗体药物结合物(ADC)的作用机制。ADC是共价结合到细胞毒性药物的单克隆抗体,设计用于靶向并在癌细胞内提供化疗,从而减少对细胞毒性药物的全身暴露。ADC与细胞表面抗原结合后,ADC抗原复合物被内化,释放的有效载荷介导抗原表达细胞的杀伤。ADC对周围细胞也具有活性:释放到细胞外空间的有效载荷也可以被相邻的HER2阴性细胞吸收,导致其死亡,即使没有表达特定靶点(旁观者杀伤或旁观者效应)。
已经引入了其他ADC,如曲妥珠单抗-杜卡马嗪(SYD-985)和曲妥珠单抗-德鲁昔康(DS-8201),它们不仅对HER2阳性的乳腺癌患者、而且对所谓的“HER2低表达”乳腺癌患者都表现出令人鼓舞的反应率74-77。
(此处略去三段药物相关研究)
综上所述,这些数据可能会对乳腺癌中HER2状态定义的范式转变的必要性提出质疑,这在未来可能基于一个三级分类体系,其特征是:i)HER2阳性,ii)HER2阴性,以及iii)HER2低表达乳腺癌(图5)。后者代表了一种肿瘤可能受益于靶向治疗的例子,因为即使在肿瘤细胞没有增加HER2癌基因的情况下,只要存在靶点(允许药物附着和发挥作用)就可能治疗获益(图5)。
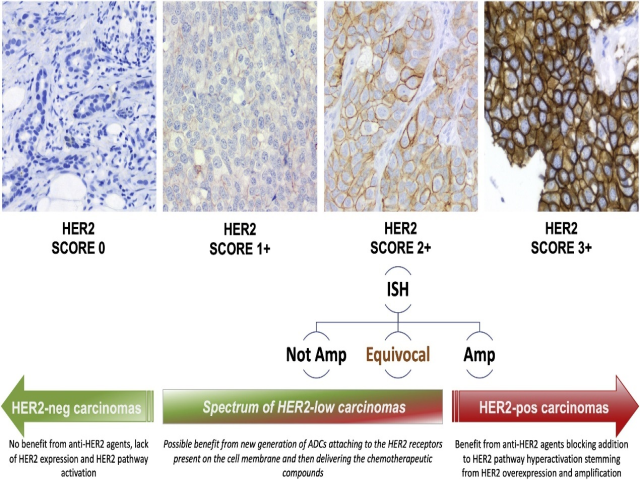
图5 乳腺癌HER2状态定义的范式转变。通过引入三级分类体系,可以很快更新目前HER2评分的二级分类法(阳性与阴性),这里举例说明,其特点是:i)HER2阳性(红色箭头,包括评分3+和评分2+且HER2扩增),ii)HER2阴性(评分0),和iii)HER2低表达乳腺癌(评分1+和评分2+且无HER2扩增)。HER2低表达乳腺癌类别构成了HER2表达程度不同的癌形成的一个谱系:目前,如图所示,它们定义为HER2表达评分1+或2+且无HER2扩增的癌,但它们可能携带HER2获得(以前的HER2不确定类别)。这种分类的相关性是基于一些抗HER2药物对某些乳腺癌患者亚群也有疗效,这些患者没有HER2成瘾(原文HER2-addicted),但显示出一定程度的HER2表达(HER2低表达)74,75。
有两个因素可能与这些药物的作用机制有关,并可能有助于确定可能的反应性癌:一方面,肿瘤细胞存在的很少数量的HER2受体,为药物发挥作用提供了锚定;另一方面,药物可以施加旁观者效应的程度也可以将其活性传播到相邻的细胞,甚至可能是HER2阴性的细胞(图4)。
在一项使用HER2靶向脂质体阿霉素作为靶向纳米颗粒模型的研究中,定量研究了HER2表达水平对阿霉素向细胞核传递的影响,观察到随着HER2表达的增加,阿霉素的核传递量在数量上增加。在大约20万个HER2受体/细胞上观察到阈值效应79,这也可能构成HER2表达的阈值,将HER2靶向药物结合物的毒性作用与治疗作用分离。
研究表明,评分为1+和2+的乳腺癌细胞膜上存在10万-50万个HER2受体分子,而评分为3+的乳腺癌细胞膜上存在200多万个HER2受体分子80。虽然没有HER2低表达乳腺癌的正式定义,但目前,将HER2表达评分为1+或2+且无HER2扩增的患者确定为HER2低表达乳腺癌似乎是合理的(图5)。根据这一定义,高达55%的乳腺癌被归类为HER2低表达。值得注意的是,这种亚型尚无批准的靶向治疗,这再次强调了对HER2低表达乳腺癌有效的影响因子可能具有的作用。目前,ER阳性乳腺癌患者接受内分泌治疗+/-化疗的联合治疗,而ER阴性(目前定义为“三阴性”)患者接受化疗。
HER2低表达乳腺癌的类别显然构成了一个谱系,包括具有不同程度HER2表达的癌,其中最高端评分2+的癌。独立的研究小组已经证明,与HER2阴性乳腺癌相比,这些癌的预后较差81-83。当病例被分为不同的免疫表型亚型(管腔样和三阴性)81时,这一点是正确的。尽管HER2低表达癌可以是管腔和非管腔两种亚型,但它们通常为ER阳性81,84-86,通过基因表达分析,它们优先属于管腔B分子亚型38。与ER阳性/HER2阴性疾病相比,它们往往具有更高的组织学分级和更高的增殖率81,84-86。在此背景下讨论的一个相关点与异质性有关,因为据报道这些癌是HER2异质性发生率最高的癌,常见的特征是HER2阳性和HER2阴性肿瘤细胞的弥漫混合模式2。我们最近的数据显示,评分为2+的乳腺癌患者的治疗反应率高于评分为1+的乳腺癌患者75,然而,治疗反应程度是否会因异质性的存在和类型而有所不同尚待阐明。然而,人们可以推测,由于这些药物显示出强大的旁观者效应,镶嵌型异质性在这种情况下可能不是一个相关问题(图4)。
来自正在进行的试验的数据可以提供更多关于治疗反应与HER2表达模式之间的相关性以及可能的其他反应预测因子的信息。有人可能会想,除了细胞膜上存在一定程度的HER2受体表达(这是ADC发挥作用的关键)之外,mRNA水平和HER2途径激活的程度也可能在这种情况下产生影响。这可以通过评估HER2蛋白和mRNA水平之间的相关性或通过研究整个病变中HER2丰富亚型的分配来研究。例如,通过在转录组水平上研究HER2双重不确定性癌,虽然我们观察到HER2 mRNA水平与评分0和评分1+的癌更相似,但这些癌的一小部分可归类为HER2丰富型癌38。
最后,就微环境中肿瘤浸润淋巴细胞(TIL)的丰富程度而言,HER2低表达乳腺癌可能是异质性的,这可能与抗体依赖性细胞毒性有关。
6、HER2突变
一直认为HER2下游通路的激活是完全由基因扩增驱动的,然而基于大规模平行测序(下一代测序,NGS)的研究已经将乳腺癌可能存在HER2激活突变推向了前沿。HER2体细胞突变的发生率低于HER2扩增,因为它们发生在约2.7%的乳腺癌患者87,并且更常见于HER2阴性或HER2低表达乳腺癌2,88。在HER2改变的乳腺癌中,只有不到1%的标本中发现了基因扩增和突变的同时发生89-91。TCGA数据集中报道的三个未经选择的乳腺癌独立队列的靶向测序HER2突变率介于2.8%和4.6%之间,令人惊讶的是,HER2基因与不同伙伴基因之间的融合率为0.2%-1.4%92-95。
迄今为止描述的绝大多数HER2突变影响编码酪氨酸激酶结构域的外显子19-20(图6),而其余的突变与胞外结构域有关(外显子8为主,图6)88,89。一项系列研究包括5605例晚期/转移性乳腺癌患者,90%的HER2突变发生在激酶结构域,其余10%发生在胞外结构域89。本研究中最常见的突变是L755S、V777L和D769H/Y,它们是蛋白质激酶结构域的错义突变89。错义突变(S310F和S310Y)是细胞外结构域中最常见的改变89,影响对受体二聚化至关重要的furin样富含半胱氨酸结构域96。在这项研究中,PIK3CA是携带HER2突变的肿瘤中最常见(42%)的具有统计学意义的共突变基因。他们还发现37%的肿瘤伴有HER2突变的CDH1突变89,这并不奇怪,因为据报道相关HER2体细胞突变与临床病理特征主要是小叶组织学类型89,90,97,一些作者报道了与实性高级别浸润性小叶癌相关98。
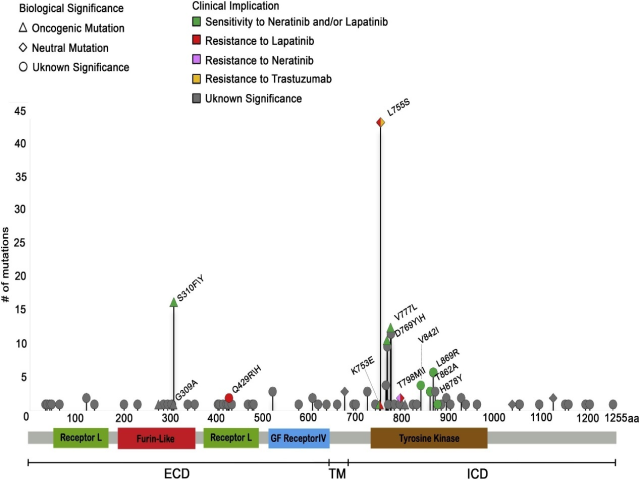
图6 HER2体细胞突变的结构域分布、患病率和意义。棒状图表示HER2基因最常见突变中涉及的绝对频率和氨基酸残基。棒状图强调了罕见热点变体的存在,属于外显子19-20,包含酪氨酸激酶结构域88,89。每个突变的生物学意义由不同的形状表示:具有致癌增强效应的突变用三角形表示,而正方形和圆形表示具有中性或未知意义的变异88,95104。一些报道的突变在抗HER2治疗方面表现出不同的行为:特别是,绿色变化描述了对酪氨酸激酶抑制剂奈拉替尼和拉帕替尼具有敏感性突变88。红色、粉红色和橙色填充的形状分别总结了与拉帕替尼、奈拉替尼和曲妥珠单抗耐药性相关的不同突变88,102,104,105。大多数突变的意义未知(灰色)。ECD:胞外结构域,TM跨膜结构域,IND:胞内结构域。
Wang等人91研究了1348名乳腺癌患者的队列,并证明与野生型肿瘤患者相比,HER2突变患者的无复发生存率明显更差,考虑到整个队列以及仅分析HER2非扩增肿瘤患者。
Bose及其同事利用转化的细胞系来测试最常见的HER2突变的致癌能力。13个具有功能特征的HER2突变中有7个是激活突变(G309A、D769H、D769Y、V777L、P780 in、V842I和R896C),因为发现它们比野生型对应物具有更高的酪氨酸激酶活性和/或二聚体形成能力。L755S HER2突变不促进细胞培养中的致癌转化,但对拉帕替尼表现出耐药性。一个突变(755-759缺失)增加HER2异二聚体伙伴、EGFR和HER3的磷酸化。当测试对各种HER2靶向治疗的敏感性时,不可逆HER2/EGFR酪氨酸激酶抑制剂奈拉替尼能够抑制携带所有突变的细胞的增殖。
乳腺癌患者HER2突变检测的相关性实际上在于确定哪些患者可能使用特异性酪氨酸激酶抑制剂(TKI)治疗,如奈拉替尼。Hyman及其同事99报道了一项大型篮式试验的数据,该试验使用奈拉替尼观察乳腺癌患者的活动程度,第8周的客观缓解率为32%。在涉及细胞外和激酶结构域的错义突变以及激酶结构域的插入的患者中观察到反应99。
HER2突变也可能是抗HER2治疗性化合物耐药性的一种机制(图6)。Xu等人100表明,HER2 L755S突变的获得是对HER2靶向治疗产生耐药性的一种获得性机制,并且双重HER1/2不可逆激酶抑制剂可以克服耐药性,正如在携带这种突变的乳腺癌细胞系的体外模型中所观察到的100。此外,在三种不同的乳腺癌细胞模型中,HER2 K753E突变对可逆但不可逆的HER2酪氨酸激酶抑制剂产生耐药性101。最近,Kong及其同事证明,与野生型MCF7细胞相比,在MCF7乳腺癌细胞中建立的三个HER2突变(Q429R、Q429H和T798M)通过PI3K-AKT通路的失调,强烈降低了曲妥珠单抗的作用102。类似地,在659和660残基中发生的HER2跨膜结构域突变与其他恶性肿瘤(如肺腺癌)对曲妥珠单抗的耐药性相关,从而保持了对阿法替尼的敏感性103。此外,Hanker及其同事104在一系列转移性乳腺癌患者中发现了一种新的HER2突变(T798I),该突变发生在激酶ATP结合口袋突变内的“守门人”残基中,并在体内诱导对尼拉替尼的耐药性。电子分析预测,798位的异亮氨酸取代能够通过减小其结合位点的大小而对奈拉替尼产生耐药性。携带HER2 T798I突变的细胞缺乏转化能力。这表明HER2 T798I不是驱动突变,但很可能是由于治疗压力而获得的。作者还证明,体外阿法替尼能够克服HER2 T798I介导的耐药性104。最后,Nayar及其同事105描述了HER2突变在非HER2丰富型乳腺癌治疗过程中的不可预测作用,他们分析了八名患者转移部位的一系列活检,这些患者接受了氟维司坦或芳香化酶抑制剂并产生了耐药性。每个患者都表现出一种HER2转移个人突变,而在原发性乳腺癌中未检测到这种突变,这表明在HER2改变的发展基础上存在着治疗进化压力105。对乳腺癌细胞的体外分析证实,酪氨酸激酶和跨膜结构域的突变赋予了对激素治疗和芳香化酶抑制的耐药性105。
7、结论
HER2的评估是乳腺癌患者治疗决策的关键,目前通过结合免疫组织化学和DNA原位杂交分析来实现。然而,很明显,HER2阳性癌可能具有高度异质性,这可能会妨碍正确识别抗HER2药物真正有治疗反应的患者。转录组分析可能有助于识别对抗HER2药物高度敏感的“HER2丰富”癌,无论是否添加化疗,从而为降低HER2阳性乳腺癌患者亚组的化疗水平提供了可能性。
此外,最近的临床研究表明,尽管HER2突变很罕见,但由于HER2突变的肿瘤可能对特定的酪氨酸激酶抑制剂有反应,因此HER2突变正在成为重要的分子改变,例如在转移患者识别了HER2突变。
最后,HER2阳性与HER2阴性疾病的二级分类法定义目前正在经历一波变化,包括确定“HER2低表达”类别,以有效抗体-药物结合物形式的新治疗化合物可能对其有效。
全文完

















共0条评论