[导读] 作者:王学利
导读:
笔者曾在外检工作中遇见1例弥漫表达CD56的肠道弥漫性大B细胞性淋巴瘤,现结合国内外有关文献探讨其临床病理学特征,望能提高对其初步的认识。
一、材料与方法
1.1 临床资料 患者男性,36岁,腹痛腹胀伴排便排气困难2月余。既往10年前有肾移植手术史。术中见小肠占位,送检切除的肠管送至病理科。
1.2 方法 标本经常规制备,免疫组化染色采用EnVision两步法。所选用的一抗包括CD20、Bc1-6、PAX-5、CD56、CD79a、CD21、MUM-1、Bcl-2、CD10、CD23、CD3、CD4、CDX-2、CK20、CK7、Cytokeratin、CD5、Cyclin D1、CD30、granzymeB、CgA、Syn、Ki-67等,均购自福州迈新生物技术开发有限公司。EBER检测试剂盒购自北京中杉金桥生物技术有限公司。
二、结果
2.1 巨检 送检肠管1段,浆膜下可见一灰白色肿物,大小4.5×4×3.5cm,突出肠黏膜面,切面灰白色,质中,界尚清(图1)。
2.2 镜检 肠黏膜下可见淋巴样细胞弥漫性片状浸润,肿瘤细胞体积较大,2倍于小淋巴细胞,胞质稍多,嗜碱性或淡染,胞核轮廓不规则,空泡状,部分有皱褶,易见核分裂象(图2,3)。
2.3 免疫组化及分子病理 免疫组化示:肿瘤细胞CD20(图4),Bc1-6,PAX-5,CD56(图5),CD79a及CD21呈(+);肿瘤细胞MUM-1,Bcl-2,CD10,CD117,CD23,CD3,CD34,CD4,CDX-2,CK20,CK7,Cytokeratin,CD5,CD8,Cyclin D1,CD30,TIA-1,granzymeB,CgA及Syn呈(-);肿瘤细胞增殖指数 Ki-67>75%(图7);分子病理结果示:EBER病毒鉴定检测(-)(图6)。
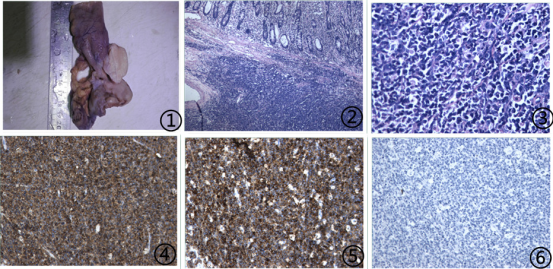
图1 大体肿瘤位于肠浆膜下,切面灰白色,质中 图2 低倍下小肠黏膜下可见淋巴样细胞弥漫性片状浸润性分布 图3高倍下肿瘤细胞体积较大,胞质稍多,嗜碱性或淡染,细胞核轮廓不规则,空泡状,易见核分裂象 图4肿瘤细胞CD20弥漫强阳性,EnVision法;图5肿瘤细胞CD56弥漫强阳性,EnVision法 图6肿瘤细胞EBER分子检测阴性
2.4最终诊断结果 小肠非霍奇金弥漫大B细胞淋巴瘤,生发中心来源。后经北大医学部病理室会诊,同意该诊断。术后恢复可,安排转专科院接受进一步治疗,具体治疗方案不详。随访6个月,效果尚可,后失访。
三、 讨论
3.1 流行病学 肾移植术后恶性肿瘤的发病率呈明显上升趋势,目前多认为肾移植术后大量免疫抑制剂导致机体免疫机制失调,导致肿瘤细胞逃脱免疫监视及攻击;免疫抑制剂本身致癌机制;机体潜伏病毒再次被激活,或因抗病毒免疫作用减少导致的获得性病毒感染;其他遗传和环境等因素。欧美国家和我国文献报道肾移植术后恶性肿瘤的发生率和肿瘤类型不尽相同。欧美国家报道普遍偏高,常见肿瘤类型是皮肤癌,其次是移植后淋巴组织增生性疾病 (PTLD)。东亚国家肿瘤发病率偏低,国内与日韩两国报道相似。
PTLD是发生于实体器官及骨髓移植后受者因长期使用免疫抑制剂抗排斥反应而发生的一组自反应性浆细胞增生症到恶性淋巴瘤的疾病,发病率随移植脏器类型的不同而不同,发病高峰在移植后10年。大部分PTLD与EBV感染有关,其他病毒如丙型肝炎病毒、CMV等也可以引起PTLD。WHO (2008)血液系统肿瘤分类将PTLD分为4种基本类型:①早期病变:即浆细胞增生和传染型单核细胞增生样PTLD。②多形性 PTLD:儿童最常见的类型。③单形性PTLD:包括单形性B细胞PTLD和单形性T/NK细胞PTLD,最常见是DLBCL。④经典霍奇金淋巴瘤型 PTLD:最为少见的一类。WHO(2016)更新病理学分类,将早期病变划分为浆细胞增生性PTLD、传染性单核细胞增多症样PTLD和旺炽性滤泡增生性 PTLD,而其他分类保持不变,但这一新分类现临床应用较少,目前多数临床研究仍沿用2008版分类。
3.2 发病机制 在造血干细胞分化成熟过程伴随着分化抗原有序稳定的分化表达,而淋巴造血肿瘤细胞常常出现抗原丢失与异常表达。抗原异常表达在DLBCL中并不少见,例如异常表达CD5的CD5+DLBCL具有侵袭性生物学行为,临床预后不良,WHO(2008)分类曾明确将其归为一类特殊亚型。此外也有研究CD30、CD138等的文献报道。CD56可表达于神经细胞和神经内分泌细胞、自然杀伤(NK)细胞及部分T细胞和单核细胞,此外神经内分泌肿瘤及部分淋巴造血肿瘤可出现表达CD56。而DLBCL异常表达CD56罕见,其临床意义不明。文献报道多来自于东亚地区,故具有种族或地域差异存在争议。
文献报道的CD56+ DLBCL中常伴有Bcl-6高表达,多为GCB型。CD56在DLBCL中异常表达的机制可能有:①某些细胞遗传学改变相关因素:编码CD56的基因定位于11q23,Sekita等曾发现该肿瘤伴有第11号染色体增加,提示细胞遗传学改变可能引起CD56在肿瘤细胞中表达;②表达CD56的前体B细胞克隆性增殖:虽然CD56在正常成熟B细胞及浆细胞中不表达,但是在前体B细胞NALM-16细胞系中可表达CD56。已有实验证明某些前体B细胞可表达CD56,这部分细胞在分化成熟的过程中可能出现克隆性增生致DLBCL异常表达CD56。
在多发性骨髓瘤异常表达CD56提示预后较好。DLBCL异常表达CD56是否具有预后意义尚不清楚,文献所报道随访资料都对初始化疗敏感,表达bcl-6者对化疗敏感,且临床预后较好,而CD56+DLBCL常伴bcl-6表达,可部分解释患者对化疗敏感。CD56+DLBCL常累及结外部位如胃肠道和Waldeyer环等。
四、小结
综上所述CD56+DLBC日常工作中少见,可能是一类具有较高增殖活性的侵袭性B细胞淋巴瘤,CD56并非是一个常规应用的免疫标记,因此CD56在B细胞淋巴瘤中的临床生物学意义尚不清楚,是否代表较强的侵袭性或与耐药基因的过表达有关还需要更多病例积累。
参考文献:
[1]王健超, 张文燕, 丁文双,等. 异常表达CD56的弥漫性大B细胞淋巴瘤临床病理观察[J]. 中华病理学杂志, 2016,45(002):78-82.
[2]Gomyo H , Kajimoto K , Miyata Y , et al. CD56-positive diffuse large B-cell lymphoma: possible association with extranodal involvement and bcl-6 expression.[J]. Hematology, 2010, 15(3):157-161.
[3]黄文斌, 赵建华, 王劲松,等. CD56(+)的弥漫性大B细胞性淋巴瘤临床病理观察[J]. 诊断病理学杂志, 2008, 15(2):121-123.
[4]陈波, 孙文勇, 罗娟,等. CD56阳性弥漫性大B细胞淋巴瘤一例[J]. 中华病理学杂志, 2010, 39(5):343-344.
[5]李青, 张云岗, 路军,等. 原发CD5阳性弥漫大B细胞淋巴瘤9例临床病理分析[J]. 临床与实验病理学杂志, 2019, 035(004):388-392.
[6]赵亦菲,钱申贤. CD30在弥漫大B细胞淋巴瘤中的表达及其临床意义[J]. 中国实验血液学杂志(3期):717-721.
[7]郭新建, 冶俊玲, 苟笑丹,等. CD138表达水平对不同免疫表型弥漫大B细胞淋巴瘤患者预后临床价值分析[J]. 临床军医杂志, 2020, v.48(01):78-80.
[8]Swer D Low S H, Campo E, Pileri S A , et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms - ScienceDirect. Blood, 2016.














共0条评论