[导读] 译者:慧海拾穗
【鉴别诊断】
伯基特淋巴瘤(BL)的鉴别诊断包括:弥漫性大B细胞淋巴瘤(DLBCL)、高级别B细胞淋巴瘤(HGBL)伴有MYC和BCL2(和/或BCL6)基因重排(HGBL-R,双重或三重打击淋巴瘤)、高级别B细胞淋巴瘤,非特指型(HGBL, NOS)、浆母细胞性淋巴瘤(PBL)、旺炽性滤泡增生(Florid follicular hyperplasia)、套细胞淋巴瘤(MCL)母细胞变异型、B细胞急性淋巴细胞白血病/淋巴瘤(B-ALL/LBL)、T细胞急性淋巴细胞白血病/淋巴瘤(T-ALL/LBL)、急性髓系白血病(AML)和髓外髓系肿瘤(extramedullary myeloid tumor,EMT)、伴11q异常的Burkitt样淋巴瘤(BLL-11q)、非造血系统肿瘤(小蓝细胞肿瘤)。
(1)弥漫性大B细胞淋巴瘤(DLBCL):BL的鉴别诊断包括DLBCL,它可能在形态学或免疫表型上与BL相似。DLBCL通常呈多形性浸润,无明显星空现象,由中心母细胞、免疫母细胞或细胞学特征介于中心母细胞或免疫母细胞的细胞组成。此外,大多数DLBCL不表现CD10和CD43共表达,BCL2不表达。然而,根据WHO给出的DLBCL定义,DLBCL是一种中等或较大的B淋巴样细胞肿瘤,其细胞核与正常巨噬细胞相同或大于其细胞核,或大于正常淋巴细胞的两倍以上,呈弥漫生长模式。部分DLBCL的瘤细胞可能中等大小并表现出与BL相似的表型(CD10+、CD43+、BCL2 -和BCL6+)。一般来说,DLBCL肿瘤细胞黏附性没有BL强,不表现为BL的铺砖样改变,Ki-67增殖指数<90%,而BL的Ki-67增殖指数近100%,且部分病例EBER阳性(非特指型EBV阳性DLBCL形态学不像BL)。
(2)旺炽性滤泡增生:粗针穿刺活检标本的鉴别诊断包括滤泡增生的反应性过程。在一个小的穿刺活检标本中,一个大的增生性滤泡在细胞学和免疫表型上可能类似于BL(CD10+和BCL2-)。反应性生发中心与BL不同,表现为暗区和亮区极化。前者由中心母细胞组成,后者以中心细胞和滤泡树突状细胞为主。用Ki-67或PD1染色可以更好地观察到极化。在诊断困难的病例中,建议进行较大的(切除)活检。
(3)高级别B细胞淋巴瘤,非特指型(HGBL, NOS):HGBL,NOS是一种罕见的B细胞淋巴瘤变体,不符合BL、HGBL-R、DLBCL或B-ALL/LBL的诊断标准。形态学上类似DLBCL、BL或B-ALL/LBL。儿童病例几乎不存在HGBL,NOS。诊断HGBL,NOS时应仔细观察形态学、做足免疫组化和基因检测,排除DLBCL、BL、HGBL-R或B-ALL/LBL。图1显示了一个非常罕见的合并BL和HGBL,NOS成分的复合高级别B细胞淋巴瘤(来自37岁男性的肾上腺肿物)。
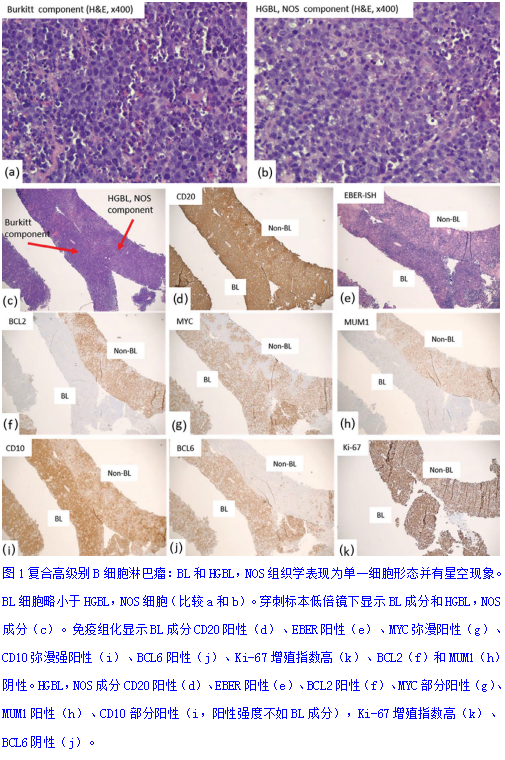
(4)高级别B细胞淋巴瘤(HGBL)伴有MYC和BCL2(和/或BCL6)基因重排(HGBL-R):HGBL-R可能在形态学和免疫表型上可与BL相似,但与BL不同的是,除了MYC基因重排外,BCL2或BCL6(双重打击淋巴瘤)或BCL2和BCL6基因同时重排(三重打击淋巴瘤)。BL只显示MYC基因重排。其临床病理学特征见华夏病理学网:(从一个会诊病例看《高级B细胞淋巴瘤》的过去、现在和将来)(可直接点击进入)
(5)浆母细胞性淋巴瘤(PBL):BL与PBL的重叠特征包括结外部位、HIV感染史、组织学呈星空现象、免疫表型显示CD38、MUM1、MYC与EBV共表达,两者的Ki-67指数都很高(BL接近100%,PBL通常>90%)。与PBL的免疫母细胞或浆母细胞变异型相比,BL由较小的淋巴样细胞组成。PBLs通常是CD45阴性(少数病例可能是CD45弱阳性),不表达B细胞标记物(CD19、CD20、PAX5),表达浆细胞标记物(MUM1、CD38、CD138)和CD56,而BL表达CD45、CD19、CD20、CD79a、PAX5、CD10和BCL6。浆母细胞性淋巴瘤的详细临床病理特征见华夏病理学网(伴浆母细胞分化的淋巴瘤的临床病理学特征(1))(可直接点击进入)
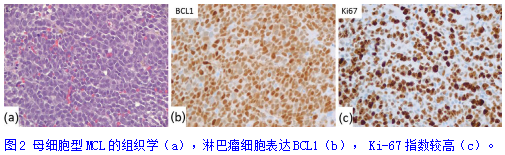
(6)套细胞淋巴瘤:一小部分MCL可能是CD10+和/或表现出与BL相似的细胞形态学特征(母细胞型MCL,图2)。MCL与BL的不同之处在于CD5阳性表达(在大多数病例中),Ki-67增殖指数较BL低,BCL1阳性(cyclin D1),CCND1基因重排阳性,MYC重排阴性。
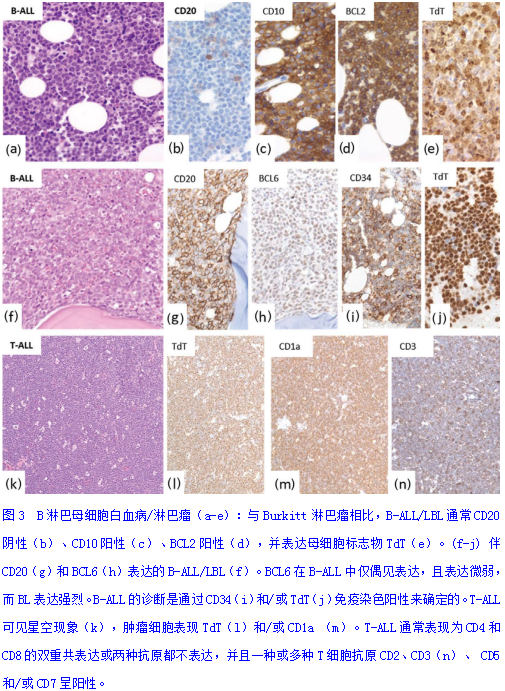
(7)B细胞或T细胞急性淋巴细胞白血病/淋巴瘤(B/T-ALL/LBL):在低倍镜下LBL的肿瘤细胞形态均匀一致,小到中等大小弥漫分布,也可有星空现象(图3),免疫组化Ki-67增殖指数高和c-myc蛋白的高表达(>80%)与BL相似。但LBL的瘤细胞染色质细腻、粉尘样均匀分布,核仁不明显或有小核仁。B-ALL/LBL可通过母细胞标志物(如CD34或TdT)和CD99的阳性表达、BCL6阴性表达(在大多数病例)和表面免疫球蛋白的表达缺失(通过流式细胞术分析)来区分。T-ALL/LBL的特征是B细胞标记阴性,存在一种或多种T细胞抗原(特别是CD3),表达TdT、CD1a和/或CD34。
(8)急性髓系白血病和髓外髓系肿瘤:髓外髓系肿瘤(extramedullary myeloid tumor,EMT)可能发生在淋巴结和结外部位,其细胞形态学和组织学特征可能类似于BL。免疫表型研究,包括髓系(MPO、CD13和CD33),母细胞(CD34和CD117)和/或单核细胞(CD68、溶菌酶/muramidase)标记物的表达有助于鉴别诊断。EMT不表达CD10、BCL6和B细胞抗原。
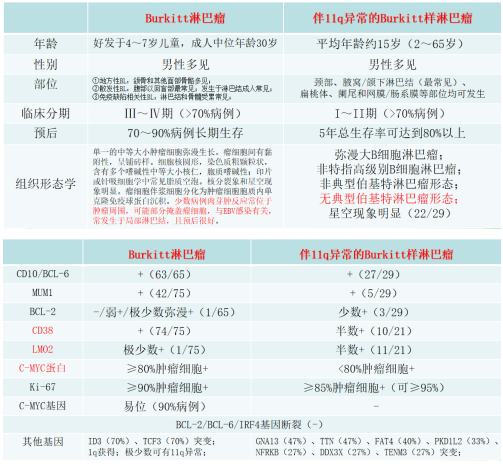
(9)伴11q异常的Burkitt样淋巴瘤(BLL-11q):当BL无c-myc基因重排时,需要和BLL-11q进行鉴别。低倍镜下BLL-11q也可见明显星空现象,细胞形态学可类似于弥漫大B细胞淋巴瘤、非特指高级别B细胞淋巴瘤、非典型伯基特淋巴瘤的形态,但无典型伯基特淋巴瘤形态。值得注意的是,有文献报道,伴有11q异常不仅仅发生于c-myc基因重排阴性BL,在c-myc基因重排阳性BL和非特指高级别B细胞淋巴瘤中也存在11q异常。BLL-11q和BL的鉴别要点如下:
(10)非造血系统肿瘤:在穿刺、受挤压或固定不良的标本中,BL还需要与非造血系统小蓝细胞肿瘤鉴别,包括神经母细胞瘤(神经内分泌标记+)、小细胞癌(角蛋白+,TTF1+等)、尤文肉瘤(CD99+,CD20-)和横纹肌肉瘤(表达肌源性标记物desmin、MyoD1/和Myogenin),可通过形态学和免疫表型来鉴别。
-----END-----
往期回顾
伯基特淋巴瘤的病理诊断和鉴别诊断(一)
【参考文献】
[1]Atlas of Differential Diagnosis in Neoplastic Hematopathology[M].Fourth Edition,2022.
[2] World Health Organization classification of tumor haematopoietic and lymphoid tissue[M].2017.
[3] Hematopathology[M].2017.
[4] 伴11q异常的Burkitt样淋巴瘤临床病理学及分子遗传学特征[J].中华病理学杂志,2021.
[5] 具有11号染色体长臂异常的Burkitt样淋巴瘤的临床病理及分子遗传学特征[J].中华病理学杂志,2021.
[6] 伴有11q异常Burkitt样淋巴瘤19例临床病理分析[J].诊断病理学杂志,2021.
[7] 伴第11号染色体长臂异常的Burkitt样淋巴瘤二例报告并文献复习[J].中华血液学杂志,2021.
[8] A Diagnostic Approach to the Identification of Burkitt-like Lymphoma With 11q Aberration[J].Am J Surg Pathol,2021.
[9] The mutational landscape of Burkitt-like lymphoma with 11q aberration is distinct from that of Burkitt lymphoma[J].Blood,2019.
[10] Burkitt-like lymphoma with 11q aberration_ a germinal center-derived lymphoma genetically unrelated to Burkitt lymphoma[J].Haematologica,2019.
[11] The 11q-Gain/Loss Aberration Occurs Recurrently in MYC-Negative Burkitt-like Lymphoma With 11q Aberration, as Well as MYC-Positive Burkitt Lymphoma and MYC-Positive High-Grade B-Cell Lymphoma, NOS[J].Am J Clin Pathol,2018.

















共0条评论