[导读] 作者:慧海拾穗
【摘要】琥珀酸脱氢酶缺陷型肾细胞癌(SDH-RCC)是2016年世界卫生组织肾细胞癌分类中的一个独特亚型。它与SDH基因胚系突变有关,最常见于青年期。肿瘤呈实性巢状或小管状排列,常伴囊性变。肿瘤由立方到卵圆形细胞组成,核圆形,染色质分散,核仁不明显。胞质呈嗜酸性或絮状,但不是真正的嗜酸性细胞。最典型的组织学特征是胞质空泡或包涵体的存在。免疫组化SDHB表达缺失提示SDH突变,但需基因检测确诊。低级别肿瘤预后良好,高级别核、肉瘤样改变或凝固性坏死者预后较差,本病需要长期随访。本文对SDH-RCC的临床特点、组织形态学、免疫表型、分子遗传学、鉴别诊断做一综述。
【前言】琥珀酸脱氢酶缺陷型肾细胞癌(SDH-RCC)是世界卫生组织2016年肾细胞癌分类中一种独特亚型[1]。它非常罕见(占所有肾癌的0.05%~0.2%),最常见于青年期患者[2]。2004年,Vanharanta等人首次描述了3例肾癌患者的发病年龄较年轻(24,26和28岁),他们的家族患有遗传性副神经节瘤/嗜铬细胞瘤并伴有SDHB胚系突变[3]。他们提出,SDHB胚系突变可导致早发性肾癌。从那以后,关于SDH基因突变患者的肾脏肿瘤陆续报道[4-13]。这些肾脏肿瘤被诊断为透明细胞性肾细胞癌、2型乳头状肾细胞癌、嫌色性肾细胞癌、嗜酸细胞瘤或未分类的肾细胞癌。这些早期的报道很少描述肿瘤的形态学和免疫染色结果,因此不确定它们是否SDH-RCC。2011年,Gill等解释了这种肾肿瘤具有独特的组织形态学[14]。2013年,由于发表的病例很少,它作为暂定实体被纳入国际泌尿外科病理学会温哥华分类[15]。2014年和2015年,Gill等[2]和Williamson等[16]分别发表了27例和10例患者的两项大型研究。2016年,SDH-RCC被世界卫生组织认可为RCC的一种形态独特亚型。
【临床特征】SDH-RCC几乎总是发生在SDH胚系突变的患者中,最常见的是SDHB,不常见的SDHC,很少发生SDHA或SDHD[2,16,17]。编码SDH亚单位的胚系基因突变容易发生副神经节瘤/嗜铬细胞瘤、2型胃肠道间质瘤,很少发生RCC和垂体腺瘤[18-20]。副神经节瘤/嗜铬细胞瘤长期以来被称为“10%肿瘤”。然而,据估计,高达30%的副神经节瘤/嗜铬细胞瘤是遗传性的。大约一半的家族性病例是由SDH基因突变引起的。大约40%的副神经节瘤和3%的嗜铬细胞瘤是SDH缺乏的[18]。SDH缺陷型胃肠道间质瘤占散发性胃肠间质瘤的5%~7.5% [19]。它们具有明显的临床和形态学特征。他们常发生于儿童和青年期,表现为胃多灶性病变,上皮样形态,缺乏KIT和PDGFRA突变;而且经常转移到淋巴结但倾向于惰性的生物学行为。预后不能通过肿瘤大小或核分裂象来预测。它们对伊马替尼无反应,但对第二代酪氨酸激酶抑制剂可能有更好的反应[19]。SDH缺陷型垂体腺瘤仅占未选择性垂体腺瘤的0.3%。发病年龄小,多为大腺瘤,常分泌催乳素,男性略多见[20]。迄今为止,至少有70例明确的SDH-RCC(由典型的形态学、免疫染色结果和分子研究确定)已经发表。4例经病理证实具有对侧SDH-RCC,1例肾脏上下极均有肿块。男性稍微多见(男女比例为1.75:1)。首次发病的平均年龄为36~40岁(14~76岁)。患者可因体检而偶然发现,无尿频、尿急、尿痛及肉眼血尿,无腰腹部疼痛及寒战发热等症状。体格检查未见异常[26,28,29]。具有典型低级别核的SDH-RCC转移的风险较低(12%),通常仅通过完全切除即可治愈。然而,高级别细胞核、肉瘤样改变或凝固性坏死的肿瘤转移风险高(70%),需要积极的根治性治疗[2]。由于某些SDH-RCC可能是一种系统性疾病,因此也建议对其他综合症候表现(副神经节瘤/嗜铬细胞瘤、胃肠道间质瘤、垂体腺瘤)的患者进行定期随访。
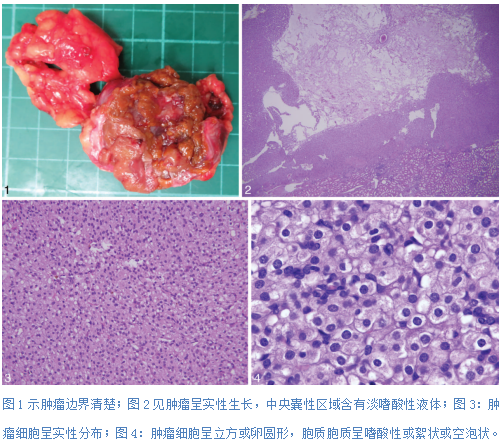
【大体病理学】大体可见肿瘤边界清楚,被褐色或红棕色假包膜包围,切面有时可见出血。多数肿瘤为实性,有时可见囊性变(图1)。
【组织病理学】显微镜下,肿瘤边界清楚或呈分叶。肿瘤呈实性巢状或小管状排列,常伴有囊性变,囊性区域通常含有淡嗜酸性液体(图2)。也可呈巢团状、梁索状结构分布于疏松水肿的间质或瘢痕周围,类似于嗜酸细胞腺瘤。良性肾小管或肾小球常被包围在肿瘤周围。瘤内常见肥大细胞(图3)。少数肿瘤可见明显的黏液样或玻璃样基质。肿瘤由立方到卵圆形细胞组成,核圆形,具有神经内分泌样的细腻染色质,核仁不明显(ISUP核级一般为1级或2级)。胞质呈嗜酸性或絮状,但不是真正的嗜酸性细胞,部分肿瘤细胞也可胞质透亮。最典型的组织学特征是胞质空泡或包涵体的存在,即为电镜下见到的胞质液泡或包涵体,它们代表增大的线粒体(图4)[21]。一些肿瘤表现出明显的核仁、肉瘤样改变或凝固性坏死特征。在这类肿瘤中,在整个切片中寻找典型的低级别形态或胞质内包涵体有助于诊断[2,14,16,27,29]。
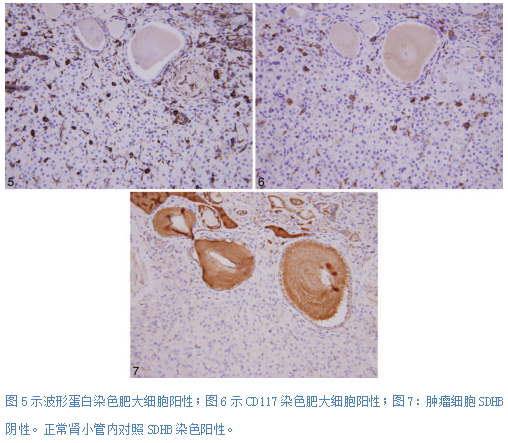
【免疫表型】免疫组化上,肿瘤通常表达PAX8和EMA(可能是局灶阳性)[2]。许多病例(68%)显示所有细胞角蛋白(CK)呈阴性表达[2]。CD10的表达从阴性到弥漫阳性不等[16]。vimentin、CD117、RCC抗原、碳酸酐酶IX(CAIX)、嗜铬粒蛋白(CgA)、syn、cathepsin K、TFE3和HMB45染色通常呈阴性,但肿瘤中的肥大细胞波形蛋白(图5)和CD117(图6)阳性[2,16]。所有病例SDHB免疫染色均为阴性(图7),只有与SDHA胚系突变相关的肿瘤SDHA免疫染色为阴性。
【分子遗传学及发病机制】SDH也被称为线粒体复合体2,由几个亚基(SDHA、SDHB、SDHC、SDHD和SDHAF2)组成[18]。它是连接三羧酸循环和电子传递链的关键呼吸酶,其作用是催化琥珀酸向富马酸的能量依赖性转化。除了其代谢作用,SDH是公认的肿瘤抑制基因参与肿瘤形成。当线粒体复合体2的任何组成部分经历双重失活(几乎1个胚系和1个体细胞突变)时,整个复合体变得不稳定,并导致SDHB亚基降解。SDH缺陷型肿瘤的发生机制尚不完全清楚,但似乎与转录因子缺氧诱导因子(hypoxia-inducible factor,HIF)介导的假性缺氧反应有关。HIF是一种序列特异性的DNA结合转录因子,促进细胞在缺氧条件下的适应和生存。它是由1α和1β亚基组成的异源二聚体。线粒体复合体缺失,以及VHL突变,导致HIF的稳定。SDH的失活导致琥珀酸的积累,并导致HIF-a的稳定和活化。然后HIF-α迁移到细胞核并与HIF-β结合形成一个活跃的转录因子,诱导参与血管生成(如VEGF)、能量代谢、生存和生长的几个基因的转录[18,22]。
Calió等最近报道了4例TFE3染色阳性和SDHB染色阴性的RCCs[23]。肿瘤表现出Xp11易位性RCCs和sdh缺失性RCCs的多种形态。分子研究显示,所有肿瘤均存在TFE3基因重排,3例肿瘤存在SDHB突变(1例胚系突变)。作者推测,在这类肿瘤中,SDH突变是肿瘤发生的驱动因素,TFE3随后发生易位。然而,Chou等人报道在30个SDH缺陷型RCCs中没有TFE3基因重排[24]。他们指出,Calió等研究中TFE3分裂信号模式的百分比相当低(平均16%;范围为12%~19%),并建议荧光原位杂交临界结果应谨慎解释。可能需要进一步的研究来解决这个问题。
【鉴别诊断】鉴别诊断包括(1)嗜酸细胞瘤:该肿瘤主要由嗜酸性细胞组成,细胞呈圆形,核级很低,没有典型的细胞质内空泡及包涵体,也很少见嗜酸性絮状物;免疫组化CD117及SDHB染色阳性有助于鉴别诊断,CD117是原癌基因的蛋白产物,在远端肾小管起源的肾肿瘤如嗜酸细胞腺瘤和嫌色细胞癌阳性表达;明显的肿瘤内肥大细胞也是SDH缺陷型RCC的诊断线索。(2)嫌色性肾细胞癌:肿瘤通常由淡染及嗜酸性细胞组成,细胞边界清楚,具有核周空晕,细胞核不规则,有时可见双核。免疫组化有助于两者的鉴别,嫌色细胞癌的肿瘤细胞通常弥漫表达CK7、CD117及肾特异性cadherin,而HNFIB呈阴性。(3)透明细胞肾细胞癌:常由透明细胞组成,组织结构多样。肿瘤细胞胞质有时明显嗜酸,并呈巢状生长,这与SDH-RCC组织学表现非常相似,CAIX及vimentin通常呈弥漫阳性,而SDHB染色阴性或弱阳性表达可以鉴别。(4)嗜酸性实性和囊性肾细胞癌:肿瘤由多少不等的实性区与大小不等的囊腔混合而成;囊腔衬覆具有嗜酸性胞质的鞋钉样细胞,实性区肿瘤成片状/腺泡状或巢状分布,瘤细胞胞质丰富,局灶核仁明显,可有多核细胞,间质可见淋巴单核细胞和泡沫细胞散在或灶状分布,部分病例可见散在钙化或砂砾体;肿瘤细胞弥漫表达PAX-8,CK20和CD10弥漫或局灶阳性,CK7局灶阳性,CD117偶见局灶阳性。(5)XP11.2易位相关的肾细胞癌:瘤细胞主要由透明细胞构成的乳头样结构,也可由絮状嗜酸性胞质构成的腺管结构(多见于NONO-TFE3易位肾细胞癌)。XP11.2易位相关的肾细胞癌表达TFE3和SDHB[25]。
【参考文献】
[1] Gill AJ, Amin MB, Smith SC, Trpkov K. Succinate dehydrogenase-deficient renal cell carcinoma. In: Holger M, Humphrey PA, Ulbright TM, Reuter VE, eds. WHO Classification of Tumors of the Urinary System and Male Genital Organs. 4th ed. Lyon, France: International Agency for Research on Cancer; 2016:35-36.
[2]Gill AJ, Hes O, Papathomas T, et al. Succinate dehydrogenase(SDH)-deficient renal carcinoma: a morphologically distinct entity: a clinicopathologic series of 36 tumors from 27 patients. Am J Surg Pathol,2014;38(12):1588-1602.
[3]Vanharanta S, Buchta M, McWhinney SR, et al. Early-onset renal cell carcinoma as a novel extraparaganglial component of SDHB-associated heritable paraganglioma. Am J Hum Genet. 2004;74(1):153-159.
[4]Ricketts CJ, Shuch B, Vocke CD, et al. Succinate dehydrogenase kidney
cancer: an aggressive example of the Warburg effect in cancer. J Urol. 2012, 188(6): 2063-2071.
[5]Solis DC, Burnichon N, Timmers HJ, et al. Penetrance and clinical consequences of a gross SDHB deletion in a large family. Clin Genet. 2009,75(4):354-363.
[6]Henderson A, Douglas F, Perros P, Morgan C, Maher ER. SDHB-associated renal oncocytoma suggests a broadening of the renal phenotype in hereditary paragangliomatosis. Fam Cancer. 2009,8(3):257-260.
[7]Schimke RN, Collins DL, Stolle CA. Paraganglioma, neuroblastoma, and a SDHB mutation: resolution of a 30-year-old mystery. Am J Med Genet A. 2010,152A(6): 1531 -1535.
[8]Srirangalingam U, Walker L, Khoo B, et al. Clinical manifestations of familial paraganglioma and phaeochromocytomas in succinate dehydrogenase B(SDH-B) gene mutation carriers. Clin Endocrinol (Oxf). 2008,69(4):587-596.
[9]Ricketts C, Woodward ER, Killick P, et al. Germline SDHB mutations and familial renal cell carcinoma. J Natl Cancer Inst. 2008,100(17):1260-1262.
[10]Casc´on A, Landa I, L´opez-Jim´enez E, et al. Molecular characterisation of a common SDHB deletion in paraganglioma patients. J Med Genet. 2008,45(4):233-238.
[11]Ni Y, Zbuk KM, Sadler T, et al. Germline mutations and variants in the succinate dehydrogenase genes in Cowden and Cowden-like syndromes. Am J Hum Genet. 2008,83(2):261-268.
[12]Jasperson KW, Kohlmann W, Gammon A, et al. Role of rapid sequence whole-body MRI screening in SDH-associated hereditary paraganglioma
families. Fam Cancer. 2014;13(2):257–265.
[13]Malinoc A, Sullivan M, Wiech T, et al. Biallelic inactivation of the SDHC gene in renal carcinoma associated with paraganglioma syndrome type 3. Endocr Relat Cancer. 2012,19(3):283-290.
[14]Gill AJ, Pachter NS, Chou A, et al. Renal tumors associated with germline SDHB mutation show distinctive morphology. Am J Surg Pathol.2011,35(10):1578-1585.
[15]Srigley JR, Delahunt B, Eble JN, et al. The International Society of Urological Pathology (ISUP) Vancouver Classification of Renal Neoplasia. Am J Surg Pathol. 2013,37(10):1469-1489.
[16]Williamson SR, Eble JN, Amin MB, et al. Succinate dehydrogenase deficient renal cell carcinoma: detailed characterization of 11 tumors defining a unique subtype of renal cell carcinoma. Mod Pathol. 2015,28(1):80-94.
[17]Yakirevich E, Ali SM, Mega A, et al. A novel SDHA-deficient renal cell carcinoma revealed by comprehensive genomic profiling. Am J Surg Pathol. 2015,39(6):858-863.
[18]Gill AJ. Succinate dehydrogenase (SDH) and mitochondrial driven neoplasia. Pathology. 2012,44(4):285-292.
[19]Gill AJ, Chou A, Vilain R, et al. Immunohistochemistry for SDHB divides
gastrointestinal stromal tumors (GISTs) into 2 distinct types. Am J Surg Pathol.
2010,34(5):636-644.
[20]Gill AJ, Toon CW, Clarkson A, et al. Succinate dehydrogenase deficiency is rare in pituitary adenomas. Am J Surg Pathol. 2014,38(4):560-566.
[21] Housley SL, Lindsay RS, Young B, et al. Renal carcinoma with giant mitochondria associated with germ-line mutation and somatic loss of the succinate dehydrogenase B gene. Histopathology. 2010,56(3):405-408.
[22] Barletta JA, Hornick JL. Succinate dehydrogenase-deficient tumors: diagnostic advances and clinical implications. Adv Anat Pathol. 2012,19(4):193-203.
[23] Cali´o A, Grignon DJ, Stohr BA, Williamson SR, Eble JN, Cheng L. Renal cell
carcinoma with TFE3 translocation and succinate dehydrogenase B mutation. Mod Pathol. 2017,30(3):407-415.
[24] Chou A, Hes O, Turchini J, Trpkov K, Gill AJ. Do significant TFE3 gene
rearrangements occur in succinate dehydrogenase-deficient renal cell carcinoma?
Borderline FISH results should be interpreted with caution. Mod Pathol. 2017,30(10):1507-1508.
[25] 周晓军,余英豪,主编.临床病理诊断与鉴别诊断---泌尿及男性生殖系统疾病[M].人民卫生出版社,2020年.
[26] 赵媛,陈红,金木兰. 琥珀酸脱氢酶缺陷型肾癌1例并文献复习[J]. 临床与实验病理学杂志,2019,35(12):1472-1474.
[27] 王小桐,王璇,章如松,等. 琥珀酸脱氢酶缺陷型肾细胞癌的临床病理学、超微结构及分子特征[J]. 中华病理学杂志,2022,51(1):12-16.
[28] 朱清,李楠,武侠,等. 琥珀酸脱氢酶缺陷型肾癌的临床病理特征[J]. 中国组织化学与细胞化学杂志,2020,29(6):529-533.
[29] 王桃丽,曹云,陈栋良. 琥珀酸脱氢酶缺陷型肾细胞癌的临床病理特征[J]. 临床与病理杂志,2021,41(1):233-239.















共0条评论