浆母细胞淋巴瘤(plasmablastic lymphoma,PBL)是一类呈高度侵袭性B细胞淋巴瘤,1997年Delecluse等[1]首次报道以来,多发生在免疫缺陷患者,且患者的EB病毒检测结果为阳性。临床上最常受累部位是口腔和胃肠道等,而肾脏罕见报道[2,3],而移植肾国内外目前未见相关文献报道。
1 材料与方法
1.1 临床资料 患者,男性,57岁,主诉肾移植术后1年余,发现移植肾占位2月余。患者因尿毒症期于2018年9月15日在解放军总医院第八医学中心行肾移植术,术后恢复良好,规律口服抗排斥药物及定期复查。2月余前因行移植肾超声检查提示移植肾盂分离,进一步行PET-CT检查示移植肾周肿块,考虑肾癌可能性,因血管丰富,经家属同意后,故2019年10月29日在全麻下行移植肾切除术,术后送检标本至病理科。
1. 2 方法 标本经4%中性甲醛固定过夜,常规脱水,石蜡包埋,4μm切片,HE染色,光镜下观察。免疫组化染色采用EnVision两步法。所选用的一抗包括Bc1-6、Bcl-2、EMA、MUM-1、CD30、CD38、TIA-1、CD138、Kappa、CD10、CD20、CD21、CD3、CD43、CD5、PAX-5、CD56、TIA-1、ALK、Lambda和Ki-67等,所用试剂均购自福州迈新生物技术开发有限公司。EBER检测试剂盒购自北京中杉金桥生物技术有限公司,按说明书进行原位杂交。
2 结果
2.1 巨检 送检切除的肾脏组织,大小10×6×6cm,肾实质结构完全消失,切面呈灰白色间灰褐色,质中(图1)。
2.2 镜检 肾单位被破坏,大量异型淋巴样细胞呈弥漫性浸润分布,偶见巨噬细胞浸润而形成的星空现象;肿瘤细胞圆形或椭圆形,呈浆母细胞样,丰富的嗜碱性胞质,胞核偏位,核仁明显,偶见核周空晕,核分裂象易见;间质背景浸润的炎细胞中包含小成熟淋巴细胞等。
2.3 免疫组化及分子病理 肿瘤细胞免疫组化示Bc1-6、Bcl-2、EMA、MUM-1、CD4、CD30、CD38(图4)、TIA-1、CD138、Kappa呈(+);CD10、CD15、CD20(图3)、CD21、CD23、CD3、CD43、CD5、PAX-5、CD56、CD8、TCRβ、TIA-1、ALK、Lambda呈(-);肿瘤细胞增殖指数Ki-67约70%(图5);分子病理示:EBER病毒检测(+)(图6),分枝杆菌DNA分型(-)。
诊断结果:(移植肾)免疫组化表型支持浆母细胞型淋巴瘤。后经北大医学部病理室会诊,同意该诊断。患者转院接受进一步治疗,具体方案不详,效果欠佳,随访4个月后失访。
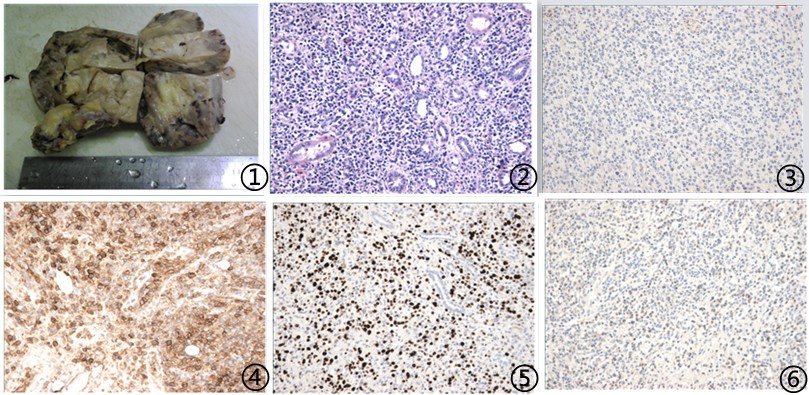
图1 移植肾脏结构破坏,肿块弥漫分布,呈实性 图2 异型性淋巴样细胞弥漫浸润,细胞圆形或椭圆形,呈免疫母细胞或浆细胞样,背景可见残存肾小管 图3 肿瘤细胞CD20(-),EnVision法 图4 肿瘤细胞CD38(++),EnVision 法 图5 肿瘤细胞Ki67约70%,EnVision法 图6 肿瘤细胞EBER原位杂交检测(+)
3 讨论
3.1 流行病学
目前同种异体肾脏移植手术作为终末期肾病的最有效临床治疗手段,极大提高了受者的生存率。随着新型免疫抑制剂的开发应用,手术方式不断更新,肿瘤已取代排斥反应等并发症成为肾移植受者的最主要死因之一。国内外文献报道好发部位及肿瘤类型的数据差异较大。北美以皮肤癌和淋巴瘤多见,而国内泌尿系统肿瘤占大多数[4,5]。移植后淋巴组织增生性疾病(post-transplantlymphopro -liferative disorders,PTLD)目前已成为实体器官移植术后影响受者生存率的严重并发症,发病率随移植脏器类型不同而不同,其临床表现为多样性,缺乏特异性表现,确诊仍依赖于病理形态学。WHO(2016)[6]血液系统肿瘤分类为4种基本类型:①早期病变:包括浆细胞增生、传染型单核细胞增生样PTLD和旺炽性滤泡增生性PTLD。②多形性PTLD。③单形性PTLD:包括单形性B细胞性PTLD和单形性T/NK细胞性PTLD。④经典霍奇金淋巴瘤型PTLD。
PBL是临床上一类罕见且侵袭性高的恶性肿瘤,1997年由Delecluse等人首次报道[1],病理形态学类似于B免疫母细胞或浆母细胞,免疫组化表型恒定表达浆细胞标记物,并将其命名为PBL。WHO(2001)淋巴造血系统肿瘤分类中将其定义为一类罕见的弥漫性大B细胞淋巴瘤的特殊亚型,免疫组化标记物CD20阴性且具有浆母细胞形态和免疫表型特征,WHO(2008)淋巴瘤分类将其归于免疫缺陷相关非霍奇金淋巴瘤,而WHO(2016)[6]将其单独分类为大B细胞淋巴瘤的独立亚型。
虽然PBL多与HIV感染相关,然而最近HIV阴性的PBL患者不断的增多,多与免疫抑制状态相关,如实体器官移植术后长期应用免疫抑制剂、EB病毒感染、自身免疫性疾病、老年免疫衰退等,其中移植后免疫异常为多见。PBL好发于中老年人,中位年龄50岁,男性患者多见。PBL好发部位为口腔、消化道、淋巴结和皮肤等部位,近年来在中枢神经系统、肺、睾丸、乳腺、心脏等部位均有文献报道,肾脏罕见报道[2,3],但目前发生于移植肾PBL未见文献报道,且为HIV阴性患者。
3.2 病理诊断
PBL由高度不典型的中等到大淋巴细胞组成,呈浆母细胞或免疫母细胞样弥漫性分布,肿瘤细胞体积大,呈圆形或卵圆形,胞浆稀少,嗜碱性,胞核偏位,可见明显核仁,单个或多个,偶可见凋亡小体及肿瘤性坏死,核分裂象易见;偶见因巨噬细胞浸润而形成的星空现象;背景浸润的炎细胞中包含小成熟淋巴细胞、中性粒细胞、嗜酸性粒细胞等[7,8]。
PBL免疫组化特征为表达浆细胞标记物CD138、CD38、MUM-1等;B细胞标记物CD20及PAX-5缺失或弱表达,但常可见CD79a表达,CD45常弱表达或缺失;可见CD4、CD10、CD30、CD56的表达;肿瘤细胞增殖指数Ki-67常≥60%;大部分EBER原位杂交检测(+)。PBL最常见的分子遗传学异常是MYC基因重排,约50%患者存在MYC基因重排,且伴侣基因为IGH[8,9]。
PBL的发病机制仍然不清楚,较为公认包括HIV感染、EBV感染和MYC基因重排[10]。
3.3 鉴别诊断 主要和肾脏淋巴瘤鉴别,无论原发性还是转移性。①弥漫大B细胞淋巴瘤[11]:尤其老年性EB病毒阳性亚型,可见不同分化阶段的B淋巴细胞和各种反应性的背景细胞成分,肿瘤细胞通常表达CD20和CD79a等B细胞标记物;浆母细胞型:组织形态学非常相似,但免疫组化表型有助于鉴别诊断,PBL通常表达浆细胞标记物CDl38、CD38、MUM-1等,不表达或弱表达CD20和PAX-5,而浆母细胞型恰好相反。②间变性/浆母细胞性浆细胞瘤[7]:二者均好发老年人,两者在病理形态学和免疫组化表型上有诸多重叠,故二者的鉴别诊断需要综合性分析:如肿瘤有溶骨性改变、骨髓侵犯、肾功能异常、血钙升高、血清免疫球蛋白升高,无免疫缺陷相关因素,则倾向于间变性/浆母细胞性浆细胞瘤,此外间变性浆细胞瘤增殖指数较低,通常Ki-67<50%。③间变性大细胞淋巴瘤(ALCL)[12]:无论ALK阴性还是阳性者,病理形态学均为肿瘤细胞见丰富胞质、胞核多形性的淋巴样细胞,肿瘤细胞表达EMA和CD30等,且表达多种T淋巴细胞标记物,而EBV检查为阴性。
3.4 临床治疗及预后
PBL恶性度高,临床预后极差,目前仍目前无标准化疗方案[10-12],手术后辅助化疗仍是目前主要临床治疗手段。研究认为PBL对化疗敏感度不高,目前多采用CHOP方案,或在此基础上剂量调整的ECHOP方案等,也有高活性抗逆转录病毒联合化疗方案的报道,此外自体造血干细胞移植术表现出一定的可行性[8]。
PBL的自然病程极短,文献报道PBL的不良预后因素包括高龄患者、临床分期晚(Ⅲ或IV期)、伴有淋巴结或骨髓转移、ECOG体能评分>2、MYC基因检测有重排或扩增、Ki-67增殖指数>80%、未能接受化疗或化疗后未能达CR等[3]。
参考文献:
[1] Delecluse H J, Anagnostopoulos I, Dallenbach F, et al. Plasmablastic Lymphomas of the Oral Cavity: A New Entity Associated With the Human Immunodeficiency Virus Infection[J]. Blood, 1997, 89(4):1413-1420.
[2]Loghavi S , Alayed K , Aladily T N , et al. Stage, age, and EBV status impact outcomes of plasmablastic lymphoma patients: a clinicopathologic analysis of 61 patients[J].Journal of Hematology & Oncology, 8,1(2015-06-10), 2015, 8(1):65.
[3]冯娟, 徐莉, 董红娟,等. 浆母细胞淋巴瘤临床病理特征及预后分析[J].中国实验血液学杂志, 2018, 26(05):106-110.
[4]王学利, 陈文, 王凤华. 移植肾术后肉瘤样癌1例[J]. 诊断病理学杂志, 2019, 26(04):69-71.
[5]粟大明, 邓文锋, 刘如敏,等. 肾移植术后新发恶性肿瘤:单中心经验[J]. 器官移植, 2020(4):449-454.
[6] Swer D Low S H , Campo E , Pileri S A, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms - ScienceDirect. Blood, 2016.
[7]范国庆, 刘一雄, 张月华,等. 浆母细胞淋巴瘤的病理、分子生物学及临床特征[J]. 诊断病理学杂志, 2014, 21(2).
[8] Al-Malki M M, Castillo J J, Sloan J M, et al. Hematopoietic Cell Transplantation for Plasmablastic Lymphoma: A Review[J]. Biol Blood Marrow Transplant, 2014, 20(12).
[9]李芬, 丁文双, 左卓,等. 浆母细胞性淋巴瘤11例临床病理分析及文献复习[J]. 中华病理学杂志, 2016.
[10]范舟, 李基炜, 易平勇,等. 5例浆母细胞淋巴瘤临床病例分析和文献回顾[J]. 肿瘤药学, 2018, v.8(01):124-128.
[11] Chang C C , Zhou X , Taylor J J , et al. Genomic profiling of plasmablastic lymphoma using array comparative genomic hybridization (aCGH): revealing significant overlapping genomic lesions with diffuse large B-cell lymphoma[J]. Journal of Hematology & Oncology, 2009, 2(1):47.
[12] Castillo J J , Bi Ba S M , Miranda R N . The biology and treatment of plasmablastic lymphoma[J]. Blood, 2015, 125(15):2323-30.














共0条评论