[导读] 作者:王学利
1、引言
炎性肌纤维母细胞瘤 (inflammatory myofibroblastic tumor,IMT)是一组组织形态学及生物学行为从中间性至明显恶性的肿瘤谱系,其中上皮样炎性肌纤维母细胞肉瘤(epithelioid inflammatory myofibroblastic sarcoma,EIMS)为其恶性亚型,其侵袭性强,临床预后差。笔者回顾一例腹膜后EIMS术中冰冻误诊为印戒细胞癌,现将其临床特征、病理形态学特征及免疫表型,临床治疗及预后,复习国内外相关文献,汇报如下,望能提高对其初步认识。
2、病例汇报
患者,男性,55岁,于2018年12月17日入院,患者11月初不良饮食后出现腹痛、恶心、腹泻,为水样便,约20次/日,自觉发热,监测体温波动在37.5℃,自觉“胃肠炎”口服药物对症治疗,仍有腹痛,以上腹痛为主,并出现腹胀,无乏力、盗汗、咳嗽、咳痰、胸闷、胸痛、便秘、停止排气排便等不适,就诊于附近医院,查超声示腹腔积液,查胸腹腔CT示“左肺上叶及下舌段少许索条影;大网膜及部分及小肠系膜区浑浊、并见絮状及结节状影,边缘模糊,以大网膜明显,腹腔内见大片状液性密度影,结肠及小肠向后推移”;抽腹水送检,腹水化验示“黄色微浑浊,李凡他实验阳性,白细胞80×103/mm。单核细胞92%、氯104.0mmol/L、糖3.7mmol/L、乳酸脱氢酶279.0U/L、腹水蛋白4.69g/L,CA125 820.1U/ml,CA153、CA199、癌胚抗原、甲胎蛋白、神经元特异性烯醇化酶正常,淀粉酶33.4U/L”,反复送检腹水细胞学未见肿瘤细胞,因诊断不明,建议行开腹探查术,患者拒绝,为进一步检诊来院,门诊以“肺部阴影、腹腔积液”入院。患者目前精神尚可,食欲正常,睡眠正常,体重下降约10Kg,大便正常,排尿正常。入院诊断:腹腔积液性质待查。
治疗经过:患者入结核科,腹水原因待查,行腹膜穿刺及相关检查,均未明确诊断,后转至普外科行剖腹探查术,患者因腹腔积液及肠梗阻于2019年1月2日行剖腹探查术,术中见腹腔及腹膜及肠管多发癌结节,无法明确肿瘤来源,遂取部分活检组织后关腹。
术中送检灰白组织1块,大小3.5*2*1cm,切面灰白色,质韧。术中冰冻结果:考虑为印戒细胞癌。术后冰冻切片见梭形细胞背景中见多量黏液湖,其内漂浮上皮样细胞,核呈偏位,胞浆嗜伊红,呈泡沫状;冰冻组织石蜡切片及冰冻剩余组织多取材后见肿瘤具备两种成份,一种为黏液样间质伴上皮样细胞区,可见多量节细胞样肿瘤细胞,另一种为梭形及短梭形上皮样肿瘤细胞呈席纹状排列,部分细胞可见核仁,核分裂象易见,间质内散在炎性细胞,免疫组化结果示肿瘤细胞CD68、Cytokeratin、Desmin、SMA、ALK、CD30、EMA呈阳性表达;肿瘤细胞CDX-2、CK20、CK7、Her-2、EGFR、CD117、CD34、DOG-1、NF、S-100、Myo D1、CD20、CD3、CD5呈阴性;肿瘤细胞增殖指数Ki-67约20%;ALK分子检测阳性。
最终诊断:结合组织形态学和免疫表型符合上皮样炎症性肌纤维母细胞肉瘤。
术后给予对症营养支持,消腹水等治疗,超声置管引流,放置胃肠三腔营养管但梗阻仍存在,无法建立肠内营养,仍需静脉营养支持。术后给予对症靶向药物(克唑替尼,口服4月),后更换为(布加替尼,2月),效果尚可,后患者梗阻及胸腹腔积液逐步恢复,治疗7月余。请肿瘤内科和中医科会诊后,建议继续口服布加替尼治疗,继续随诊中,5个月后失访。
3讨论
3.1 临床特点
IMT是梭形肌纤维母细胞和炎症细胞组成的间叶性肿瘤,具有中间性生物学行为,有局部复发和偶尔转移(几乎不发生远处转移)特点,包括从单纯良性、中间性到明确恶性肌纤维母细胞分化肿瘤。IMT在临床上少见,好发于儿童和青少年,发生部位广泛,首次报道于肺,亦可发生于盆腹腔、腹膜后或软组织内。最初被称为“炎性假瘤”,认为是在发生创伤或机体炎性病变后组织的一种反应性增生性病变。故命名比混乱,如浆细胞肉芽肿、炎性假瘤、纤维黄色肉芽肿、黏液样错构瘤、假肉瘤样肌纤维母细胞增生等,由于存在复发和转移可能,加上间变性淋巴瘤激酶基因重排发现,后被描述为一种独特的肿瘤性病变。 Coffin等曾将其分为3种组织学类型:黏液样/血管型或结节性筋膜炎样型、致密梭形细胞型或纤维组织细胞瘤样型、少细胞纤维型或纤维瘤病样型。不同形态可单独存在或混合存在,并无临床预后意义,但对于识别诊断本病有帮助。当肿瘤细胞表现出恶性特征时,需要考虑炎性肌纤维母细胞肉瘤。
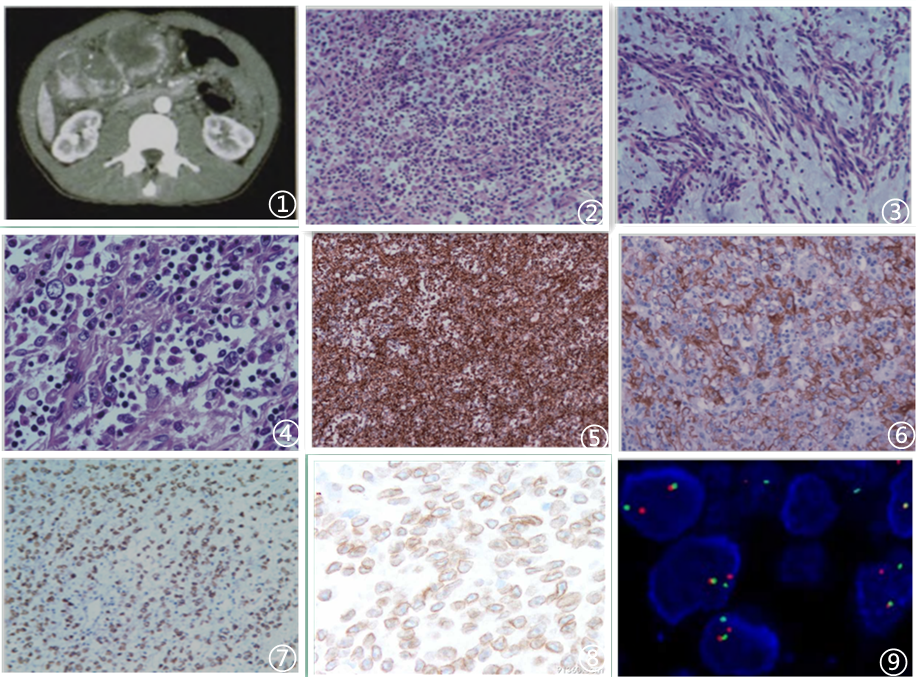
图1 腹部增强CT示腹腔巨大软组织影,内见散在点状钙化影,明显不均匀强化,相邻组织受压;图2肿瘤细胞松散排列,细胞密度低,组织形态多样性,主要由上皮样细胞组成;图3肿瘤背景水肿黏液变明显;图4肿瘤细胞呈上皮样,胞质嗜双色性或淡伊红,核圆形或椭圆形,染色质空泡状,核仁显著突出,间质伴大量嗜酸性粒细胞浸润;图5肿瘤细胞Vimentin弥漫强阳性;图6肿瘤细胞CK阳性;图7肿瘤细胞CD30阳性;图8肿瘤细胞ALK典型核周阳性;图9 FISH检测ALK基因重排阳性;
早在2001年Cook等在包含73例IMT中发现有4例组织学表现为大的多边形细胞,细胞核大,核仁明显,间质常见散在淋巴细胞、嗜酸性粒细胞及少量中性粒细胞、浆细胞浸润,免疫组织化学强表达ALK,基因水平上存在ALK重排现象,以RANBP2-ALK最常见,并且呈现出较经典IMT更强的侵袭性行为。针对这一独特现象,他们首次提出“圆形细胞转化”术语。2011年Marino-Enriquez等也描述了这种特殊形态及生物学行为IMT,从临床特点、免疫组化、分子病理特点、生物学行为进行深入探讨,提出EIMS名称。随后文献提及的上皮样形态IMT时均以EIMS出现,且形态学描述及临床转归均较一致。Yu等报道了5例EIMS,表现出与上述一致的组织学特征,即大的上皮样细胞、双嗜性细胞质、泡状胞核和显著的核仁,核分裂象易见(平均20/10HPF)。
EIMS是近年发现IMT上皮样亚型,一种高度侵袭性好发于腹腔内的高度恶性肉瘤,易迅速局部复发,但几乎不发生远处转移,好发于男性,临床预后较差。临床常表现为腹胀腹痛、肠梗阻及腹水等。EIMS发病部位与IMT相似,最常见于腹腔内,特别是肠系膜和大网膜,但其他部位包括纵隔、上呼吸道、泌尿生殖道、腮腺、甲状腺、口腔、乳腺、肝、肾、胃肠道、皮肤、骨和中枢神经系统等均可发生。EIMS多见于成年人,Marino-Enriquez等报道11例EMIS中,男性10例,女性1例;发病年龄为7个月-63岁(平均年龄31.6岁,中位年龄31岁);肿瘤直径8-26cm,平均15cm。影像学表现腹腔或肠壁实性、结节状软组织肿块影,界清或不清,可侵犯肠壁或邻近器官。
3.2 病理形态学
肿瘤大体为单发或多发的不规则结节状肿块,界清或不清,实性,灰白、灰红或灰黄色,质地软,可伴有黏液感,可伴有坏死。发生于盆腹腔者常侵犯肠壁、腹壁或者邻近器官。EIMS低倍镜下肿瘤富于黏液背景,具有细胞稀疏区域和较密集的区域,无特殊排列方式。高倍镜下可见肿瘤细胞排列紊乱,连成片状,大小不一,组织形态学多样,是常见肿瘤组织形态。主要以上皮样细胞为特征,呈圆形、短梭形、多边形、椭圆形及不规则形等。肿瘤细胞排列较为松散,弥散分布,边界较清,胞质丰富、嗜酸或嗜双色,部分形似 R-S细胞或神经节细胞。另外肿瘤细胞核仁较大,核往往偏位,泡状核、核仁较明显,镜下可见核分裂象和瘤巨细胞,核分裂象多少不等,约1-18个/HPF(平均约4个/HPF);间质中见明显大量炎症细胞浸润,以中性粒细胞为主,伴有少量浆细胞、淋巴细胞及嗜酸性粒细胞;肿瘤细胞有明显水肿和黏液样变性,少数伴胶原化。
免疫表型与经典IMT不尽完全相同,以表达ALK和desmin为主,ALK呈特征性核膜或核周阳性,有时可表现为胞质着色伴核周空晕;肿瘤细胞还可见Vimentin及desmin强阳性,CD30呈弱-中等度阳性,部分病例还可表达 CK(AE1/AE3),少数病例可SMA及Capolnin阳性;也有文献报告肿瘤细胞WT1和D2-40等阳性;通常不表达或少数表达EMA、CD3、CD20、CD117、Dog-1等;肿瘤细胞增殖指数Ki-67约10%-40%。电镜检查胞质内可见肌丝及微管相关蛋白,未见横纹,未见神经内分泌颗粒。
3.3 分子基因学
EMIS常见有特征性的RANBP2-ALK基因融合,(anaplastic lymphoma kinase,ALK)是一种酪氨酸激酶受体,首先在间变性大细胞淋巴瘤中有NPM-ALK融合蛋白异常表达而被识别,由于选择性染色体重排,随后在ALCL中许多与ALK融合的基因相继被发现,目前已发现 ALK 基因融合方式有 15 种。与ALCL相似,在IMT中ALK亦可与多种基因融合形成不同染色体重排,包括TPM3和TPM4、CLTC、RAN-BP2、CARS、ATIC 和SEC31L1等。ALK融合蛋白表达可用免疫组化方法进行检测,ALK与不同蛋白融合决定了其不同的免疫组化染色定位,因而ALK免疫表型具有三种不同的模式:光滑胞膜染色、颗粒状胞质染色及独特的核膜染色。如ALK与胞质蛋白TPM3、TPM4、CARS、ATIC和SEC31L122融合,显示其胞质弥漫阳性;CLTC是胞质有被小泡中的主要成分,负责蛋白质的选择性转运,其与ALK 融合后免疫组化显示胞质颗粒状着色;ALK与RANBP2蛋白融合则显示其核膜阳性,因为RANBP2是定位于核孔大分子蛋白。IMT中ALK融合蛋白的表达与形态及其预后的关系不完全清楚,但有研究表明EMIS中RANBP2-ALK融合蛋白常呈现上皮样/圆形细胞形态及侵袭性生物学行为,即RANBP2-ALK融合蛋白核膜阳性与IMT的上皮样形态相一致, 因而RANBP2-ALK 融合蛋白的检测具有重要的诊断和预后价值,并可做为EMIS诊断和预后的指标。
3.4 鉴别诊断
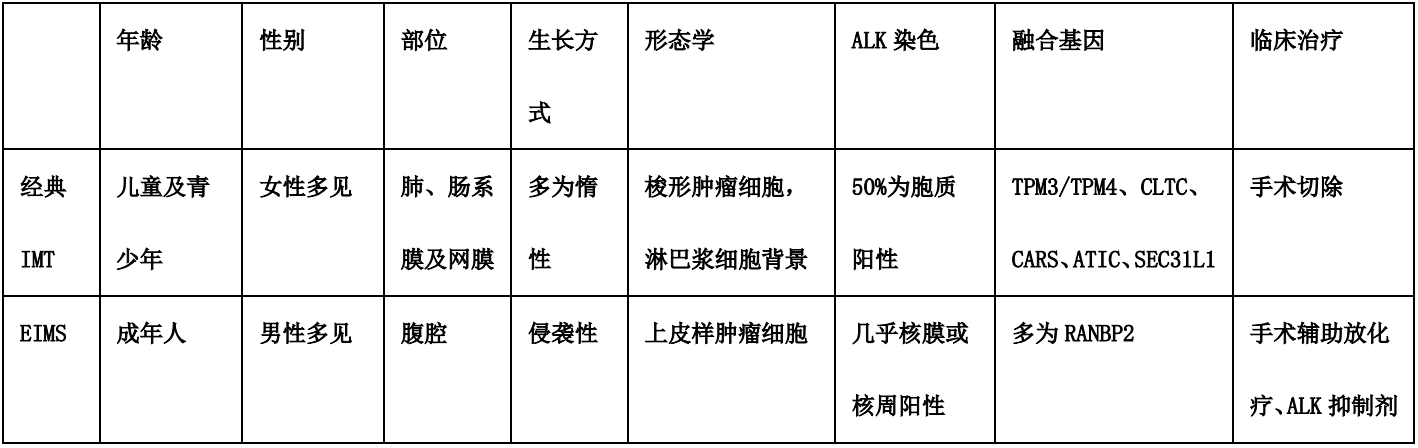
①IMT:与EIMS为同一谱系,表达相同的免疫标记物。儿童和青少年发病为主,而EIMS则好发于成人男性。IMT肿瘤细胞形态典型者以梭形细胞为主,其结构可多样,表现为肉芽组织型,纤维瘤病型和瘢痕型。少部分肿瘤细胞形态呈多边形,不规则形或奇异形,部分细胞呈节细胞或RS细胞样,其内见嗜酸或嗜碱性核内包涵体,核分裂或坏死也可见,间质中见浆细胞、嗜酸性粒细胞和淋巴细胞等慢性炎细胞浸润,其炎性细胞多少不等,通常不见中性粒细胞,IMT中具有侵袭性生物学行为的病例,其肿瘤细胞形态也呈上皮样或圆形。免疫表型:EIMS以表达ALK和Desmin为主,ALK阳性表达在瘤细胞核膜或核周;而IMT免疫组化示Vimentin瘤细胞弥漫阳性,SMA既可弥漫阳性,也可灶性阳,Desmin多数阳性,与EIMS不同,其ALK表达为胞质阳性,还有约1/3病例灶性表达CK。(鉴别诊断见下表)
②ALK阳性间变性大细胞淋巴瘤(anaplastic large cell lymphoma, ALCL):尤其是肉瘤样ALCL很难鉴别,具有相似组织形态,并且ALK、CD30和SMA阳性,镜下由淋巴样细胞组成,肿瘤细胞胞质丰富,胞体较大,核呈多形性,可见马蹄型、肾型或怪异核,多个核可呈花环状排列,类似R-S细胞,大细胞胞核内可有多个嗜碱性核仁,肉瘤样型可出现梭形细胞分化。但ALCL中未见RANBP2-ALK融合及典型ALK核膜表达模式,多表达于胞膜和高尔基氏体区,此外ALCL中缺少desmin强阳性。
③横纹肌肉瘤,尤其腺泡状横纹肌肉瘤(实性亚型)也可ALK阳性,但其通常细胞形态更一致,胞质少,缺少黏液样间质及中性粒细胞浸润, MyoD1核阳性,有助于鉴别诊断。
④去分化脂肪肉瘤:尤其呈炎性恶性纤维组织细胞瘤形式脂肪肉瘤,但在去分化形态中总会混有分化好脂肪肉瘤形态,免疫组化标记MDM2细胞核阳性,未见ALK核膜阳性,广泛取材发现高分化脂肪肉瘤区域,可做出明确诊断。
⑤炎性假瘤样滤泡树突肉瘤(follicular dendritic cell sarcoma,FDCS)。FDCS为生发中心滤泡树突细胞起源的一种罕见低度恶性肿瘤,炎性假瘤样FDCS更为罕见,结外型FDCS主要见于肝、脾、扁桃体、小肠及其系膜等部位,通常与周围组织分界清晰,病理形态与炎性假瘤相似,肿瘤呈特征性的双相型细胞形态,主要由梭形、椭圆形或圆形肿瘤细胞呈环状、层状或单个散在分布,可呈R-S 细胞样,核分裂罕见,背景中弥漫浸润大量炎细胞(主要是浆细胞、淋巴细胞和少量中性粒细胞,有时形成淋巴滤泡),有时可见席纹状和同心圆样排列结构。免疫表型CD21、CD23、CD35阳性,通常不表达Desmin。另外EBER原位杂交阳性,而且是诊断炎性假瘤FDCS必要条件。
⑥胃肠外胃肠道间质瘤 (extragastroin.testinal stromal tumour,EGIST):经典组织形态学表现为梭形或短梭形肿瘤细胞实性生长,但也可具有形态多样性,但通常无大量中性粒细胞浸润,通过免疫组织化学CD117、Dog-1阳性,ALK、CK、Desmin等阴性。
⑦恶性间皮瘤:为具有双向分化少见的恶性肿瘤,好发于胸腹腔,分为弥漫性和局限性,可呈梭形或上皮样,细胞黏附性差,常有细胞间隙存在,胞质较浓缩,核常居中,核仁相对较小;间皮相关免疫表型Calretinin、MC、D2-40等均为阴性,可排除恶行间皮瘤可能。
⑧炎症性恶性纤维组织细胞瘤:该病好发于中老年人群,形态学上由梭形或多形性肿瘤细胞伴大量炎细胞构成,肿瘤细胞具有明显恶性特征,异型显著,核分裂多见,免疫组织化学Vim、α-抗胰蛋白酶、CD68等阳性,不表达上皮标记物,可与相鉴别。
⑨黏液纤维肉瘤:大部分由致密的梭形细胞和多形性细胞组成,核分裂象易见,但在局部区域仍可见低度恶性成分,并见移行。上皮样黏液纤维肉瘤由交替分布的细胞稀疏区和密集区组成,除梭形细胞外,还可见上皮样瘤细胞以及病理性核分裂,但均未见炎细胞浸润,免疫组化标记ALK阴性。
⑩高级别平滑肌肉瘤:通常此肿瘤至少部分区域具有典型组织学特征,暨胞质红染平滑肌束和“雪茄型”核,常表达 SMA、Desmin、h-Caldesmon及calponin 等,而ALK 核膜阴性;遗传学上尚未发现特征性基因改变。
3.5 ALK阳性肿瘤
ALK阳性肿瘤常见经典IMT、EIMS、ALK阳性弥漫性大B细胞淋巴瘤、ALK阳性间变性大细胞淋巴瘤,少数胚胎性横纹肌肉瘤、神经母细胞瘤、恶性外周神经鞘膜瘤及组织细胞肿瘤等。有学者认为鉴于多种肿瘤可涉及ALK基因异位,并表达ALK蛋白,因其相似的遗传学表现可选择相似治疗方案。Mano等基于肿瘤对靶向药物治疗敏感性,认为ALK融合蛋白在肿瘤发生中起关键性作用,进而把这些ALK基因改变在肿瘤发生中起主要作用肿瘤统称为“ALKoma(ALK瘤)”,例如伴EML4-ALK融基因的非小细胞肺癌对克唑替尼具有高度敏感性,同样证实EML4-ALK基因融合在肿瘤发生中的重要作用。
3.6 临床治疗及预后
目前EMIS治疗方法主要是以手术切除为主,配合新辅助化疗和术后放化疗,但与传统IMT相比,多较早出现复发和死亡,临床预后不佳,且腹腔EMIS更易复发和转移。生物学行为高度恶性、进展速度极快,术后早期复发转移及病死率高,预后极差。多数病例发现时或术后早期出现复发、种植或转移,以腹腔种植多见,转移部位见于肝、肺、脑、淋巴结、肾上腺、骨及骨髓等;生存期约1-36个月;目前EIMS数据分析一些EIMS患者靶向治疗取得明显的效果,一些患者检测后发现ALK基因重排,使用ALK抑制剂化疗,效果显著。
ALK是多向生长因子酪氨酸激酶受体蛋白,伴EML4-ALK基因融合非小细胞肺癌对克唑替尼具有高度敏感性。文献报道表明出现RANBP2-ALK融合基因EMIS往往发生于腹腔内且预后较差,同样提示患者可使用ALK抑制剂进行有效治疗。 Butrynski等对2例患者分别使用克唑替尼进行治疗,其中1例 RANBP2-ALK融合蛋白阳性并对阿霉素、异环磷酰胺和伊马替尼耐药,但对克唑替尼持续有效;另1例 RANBP2-ALK融合蛋白阴性对克唑替尼无治疗反应。但Sasaki等报道RANBP2-ALK融合阳性EMIS对克唑替尼出现耐药,认为RANBP2-ALK-F1174L基因与肿瘤耐药性有关,这种二次突变对ALK磷酸化、细胞生长和下游信号传导均有增强作用。总之RANBP2-ALK融合基因在EIMS肿瘤生长过程中起关键作用,克唑替尼的应用将使ALK阳性EIMS患者受益,对出现克唑替尼抵抗仍待进一步探讨。
另外肿瘤免疫疗法研究方兴未艾,尤其是PD-1/PD-L1在多类恶性肿瘤抗肿瘤免疫反应中有显著作用。PD-1/PD-L1通路在肿瘤免疫治疗中起重要作用,采用PD-1抗体或PD-L1抗体阻断该通路体识别,能够诱导并增强T细胞免疫反应,杀伤肿瘤细胞。Du等检测一例腹腔EIMS表现为PD-L1阳性,为该肿瘤免疫治疗提供新的思路。
4、小结
盆腹腔EIMS发病较为罕见,是高度恶性肿瘤,为IMT一种特殊亚型, 临床预后较差。通过病理形态学特点和免疫组化结果有利于诊断,治疗以手术切除和化疗为主,抗 ALK靶向治疗对部分ALK基因重排患者效果显著。 EIMS诊断要点: (1)圆形至上皮样的肿瘤细胞;(2)丰富的黏液样基质和炎细胞浸润;(3)免疫组化标记ALK阳性,呈核膜染色模式;(4)检测出RANBP2-ALK融合基因。
参考文献
[1]赵越,杨斌,蔡德总,王耀光.上皮样炎性肌纤维母细胞肉瘤CT表现二例[J].中华放射学杂志,2017,51(04):312-313.
[2]吴惠,孟宇宏,宁浩勇,路平,洪柳,康筱玲,段敏刚,冉志远.腹腔上皮样炎性肌纤维母细胞肉瘤临床病理观察[J].诊断病理学杂志,2014,21(11):680-684.
[3]Mari?o-Enríquez, Adrián, Wang W L , Roy A , et al. Epithelioid Inflammatory Myofibroblastic Sarcoma[J]. American Journal of Surgical Pathology, 2011, 35(1):135-144.
[4]卢晓玉,夏庆欣,赵冬梅,张建波.盆腹腔上皮样炎性肌纤维母细胞肉瘤的临床病理研究[J].现代肿瘤医学,2021,29(15):2700-2704.
[5]程波,丁姗姗,郭静利,许琳,赵欢,孙锁柱.1例儿童肝罕见组织学形态上皮样炎性肌纤维母细胞肉瘤的临床病理分析[J].临床与病理杂志,2021,41(07):1715-1722.
[6]彭全洲,陈灼怀,王晓玫,左敏,刘汉勇,胡锦涛,成志强.腹腔上皮样炎性肌纤维母细胞肉瘤2例临床病理观察[J].临床与实验病理学杂志,2015,31(05):547-551.DOI:10.13315/j.cnki.cjcep.2015.05.015.
[7]黄勇杰,曾思红.腹腔上皮样炎性肌纤维母细胞肉瘤一例并文献复习[J].实用医技杂志,2020,27(06):785-787. DOI:10.19522/j.cnki. 1671-5098.2020. 06.053.
[8]刘秋雨,张梦阳,李真,徐紫光,阚云珍.上皮样炎性肌纤维母细胞肉瘤的临床病理特点及靶向治疗效果[J].中华普通外科杂志,2016,31(10):874-875.
[9]丁莉,郑杰,饶兰,韩义明,唐荣,杨婉.上皮样炎性肌纤维母细胞肉瘤1例临床病理观察[J].诊断病理学杂志,2021,28(01):24-27.
[10]黄海建,陈小岩,陈刚.上皮样炎性肌纤维母细胞肉瘤三例临床病理分析[J].中华病理学杂志,2016,45(07):474-475.
[11]张帆,焦南林,张伟,曹明,赵国海.肠系膜上皮样型炎性肌纤维母细胞瘤1例并文献复习[J].临床与实验病理学杂志,2016,32(02):175-179.DOI:10.13315/j.cnki.cjcep.2016.02.013.
[12]彭晚娇,朱伟峰,卢建平,许春伟,陈刚.腹腔上皮样炎性肌纤维母细胞肉瘤临床病理分析并文献复习[J].临床与病理杂志,2016,36(10):1589-1593.
[13]崔华娟,赖日权,王卓才,彭大云,赖续文.肺上皮样炎性肌纤维母细胞肉瘤临床病理观察[J].诊断病理学杂志,2014,21(04):215-219.















共0条评论