[导读] 编译整理:强子
病理检查可谓当前疾病诊断手段中最为精准的,被誉为“金标准”。不过,病理检查也分很多种,从细胞学、组织学到免疫组化检查乃至分子检测不一而足。就同一疾病的诊断来说,不同层次的病理检查手段会各有优缺点。美国哥伦比亚大学医学院病理专家Hsiao等人就对NTRK融合肿瘤病理诊断中免疫组化pan-TRK和分子检测的结果进行了比较,发现免疫组化的敏感性及特异性均有不足,相关文献已发表于《Cancer Genet》。为帮助大家更好的了解这一问题并避免实际工作中的误诊误判,我们将该文要点编译介绍如下。
简介
NTRK基因(包括NTRK1、NTRK2、NTRK3)编码跨膜的受体酪氨酸激酶,后者参与神经组织的增殖、分化、成熟。涉及这些基因的融合易位被认为是很多癌种中的致癌事件,具体易位可发生于染色体内、也可发生于染色体间,一般产生的融合蛋白为NTRK中C末端的酪氨酸激酶结构域、而N末端则被融合配体取代。目前5’端融合配体已有80余种报道。
不同肿瘤类型中,NTRK基因融合的检出率不一,高者如婴儿型纤维肉瘤、分泌性乳腺癌、先天性中胚层肾瘤可大于90%,而低者如结直肠腺癌、胰腺癌、浸润性乳腺癌、非小细胞肺癌、恶性黑色素瘤中则只有0.1-1%。
研究发现,不管肿瘤的组织学类型及原发部位如何,靶向激酶抑制剂拉罗替尼、恩曲替尼对于具有NTRK融合的肿瘤都有临床效果,且FDA已批准这类药物用于具有NTRK融合的实体瘤。所以,目前进展期或转移性肿瘤中检测NTRK基因融合具有重要临床意义,NCCN多项指南也建议进行这一检测,如结肠癌、非小细胞肺癌、乳腺癌、中枢神经系统肿瘤、胰腺癌、甲状腺癌、胃癌、肝癌、卵巢癌。
临床实验室对NTRK融合的检测有多种方法,如FISH、免疫组化TRK蛋白过表达、RT-PCR、DNA基础上的二代测序、RNA基础上的二代测序。相比其他的泛瘤种标记物(如微卫星不稳定/错配修复缺陷、肿瘤突变负荷、PD-1/PD-L1表达)来说,临床检测NTRK融合非常具有挑战性,因为不同瘤种NTRK融合的发生率、组织中内源性TRK表达的水平(如神经和平滑肌)均有显著不同,且NTRK融合配体数量众多,分子诊断对这一指标的检测性能也有不同。
诸多学术团体提出了NTRK融合检测的诊断策略,以指导相关实验室更有效的进行这一检测。总体来说,对于NTRK融合几率高的肿瘤(如前述婴儿型纤维肉瘤多有NTRK3融合)可考虑进行FISH检测,而对于NTRK融合大概率阴性的病例则考虑其他检测手段,如RNA基础上的二代测序。
研究内容及结果
临床实践中,很多实验室无法常规对所有进展期或转移性实体瘤进行二代测序,所以会根据肿瘤是否有其他驱动性突变(一般是与NTRK致癌突变互斥的)、或免疫组化TRK过表达来选择加做二代测序的标本。本文目的就是尝试评估作者实际工作中检测NTRK融合的两种方案:对其他驱动突变阴性的肺、尿路上皮、胆管癌进行靶向RNA二代测序;对其他肿瘤通过pan-TRK免疫组化进行全瘤种的NTRK融合筛查、后续靶向RNA二代测序证实。
选择作者所在单位2018年1月1日至2021年1月20日期间、做过pan-TRK免疫组化及靶向融合检测的存档病例共计127例进行分析;具体涉及的病变部位有:肺(23例)、骨或软组织(19例)、胆道(19例)、尿道或膀胱(15例)、胃肠道(12例)、胰腺(9例)、子宫(6例)、乳腺(5例)、皮肤(3例)、前列腺(2例)、甲状腺(1例)、腹膜(1例)、卵巢或输卵管(1例)、头颈部(1例)及原发灶未明(10例)。检测流程详见图1。
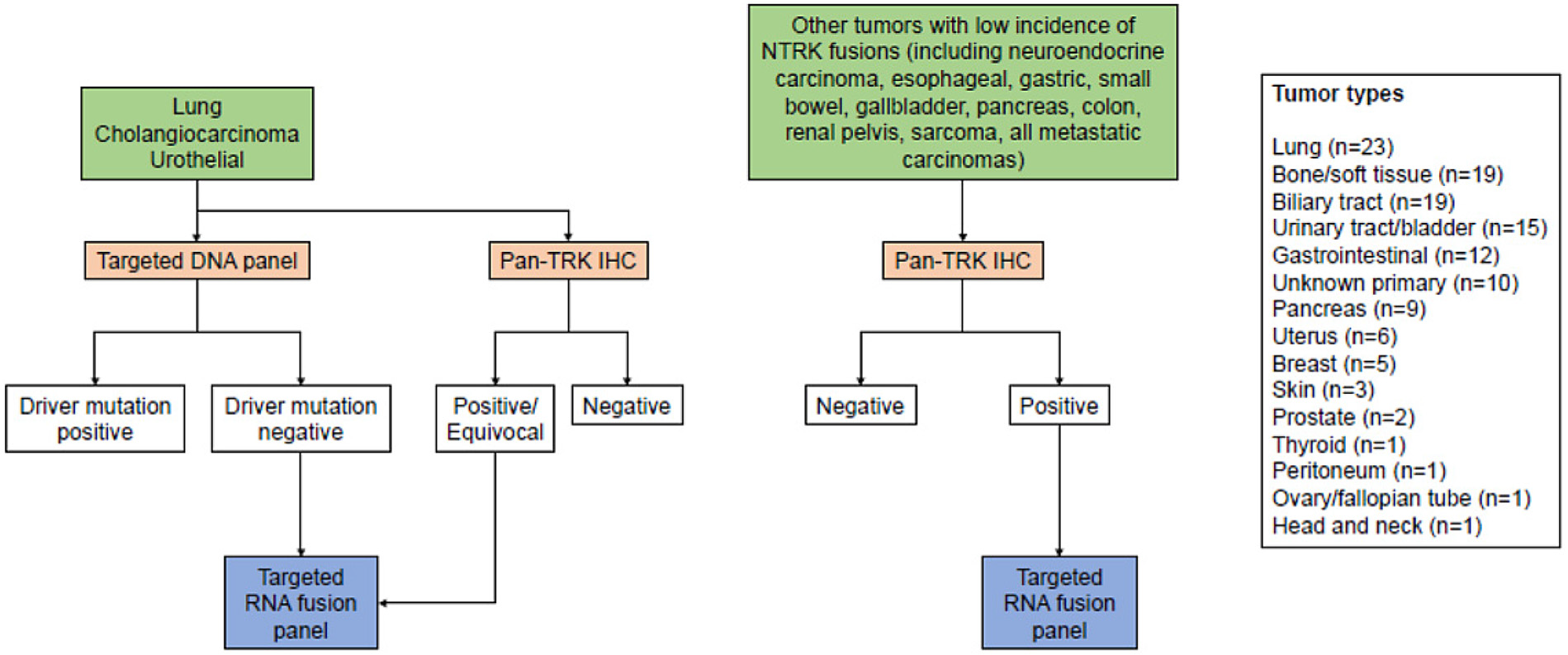
图1. 作者所在单位对于相关肿瘤NTRK融合的检测流程。对肺腺癌、胆管癌、尿路上皮癌,直接进行相应热点突变基因的靶向DNA测序(肺肿瘤包括EGFR、KRAS、BRAF、MET、ERBB2,胆管癌则包括KRAS、NRAS、BRAF、IDH1、IDH2、FGFR2,尿路上皮癌包括FGFR3、FGFR2、NRAS、HRAS、KRAS、ERBB2),如果结果阴性则进行靶向RNA测序;且这三种肿瘤会同时进行免疫组化pan-TRK检测。其他NTRK融合几率低的原发及转移瘤种则通过免疫组化pan-TRK筛选,阳性或结果不确定的病例通过靶向RNA测序证实。
127例标本中,免疫组化pan-TRK有63例(49.6%)阳性,但大部分(45/63,71.4%)阳性结构都是模糊着色、弱着色或局灶着色。弱阳性着色与结肠对照组织中肌间神经丛的着色强度相同,表明是内源性着色。
127例中检出基因融合者12例,其中4例为NTRK基因融合(其中1例在原发灶及后期转移灶中均检出),NTRK融合的检出率为3.1%(4/127)。就这四个病例的免疫组化来说,具有TPM3-NTRK1融合的结直肠癌为强阳性,着色部位为细胞膜和细胞质;着色不确定的为GOLGA4-NTRK3融合的胰腺癌,该例肿瘤细胞呈“原位杂交样”着色或颗粒状着色,与相同切片中神经组织的内源性强阳性着色形成鲜明对比。具有ADAM19-NTRK3融合的原发及转移标本中,pan-TRK免疫组化为阴性。
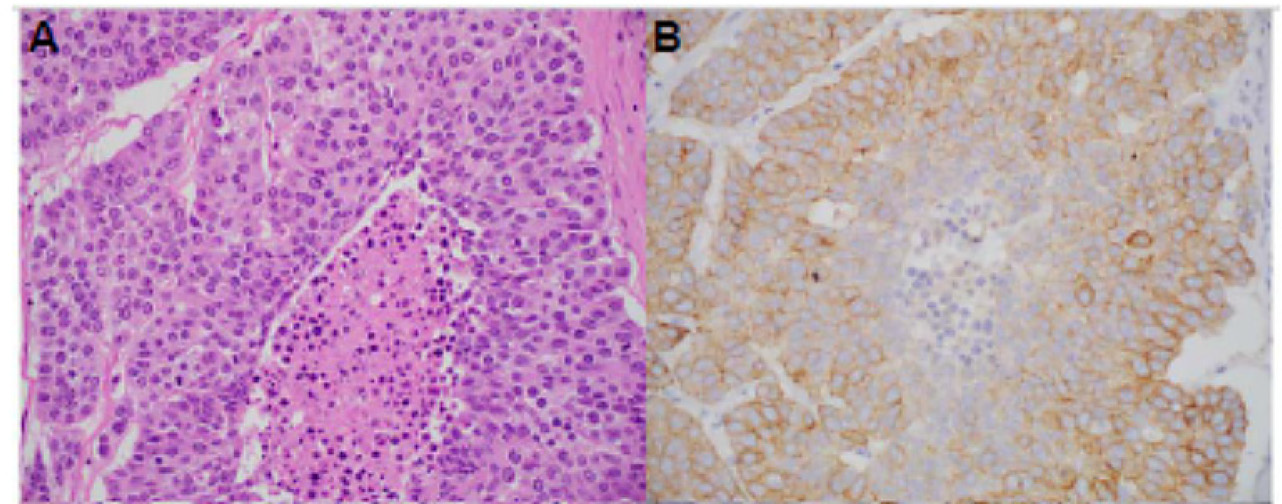
图2. 具有TMP3-NTRK1融合的结肠腺癌,免疫组化pan-TRK表现为细胞膜及胞质着色,明确为阳性。
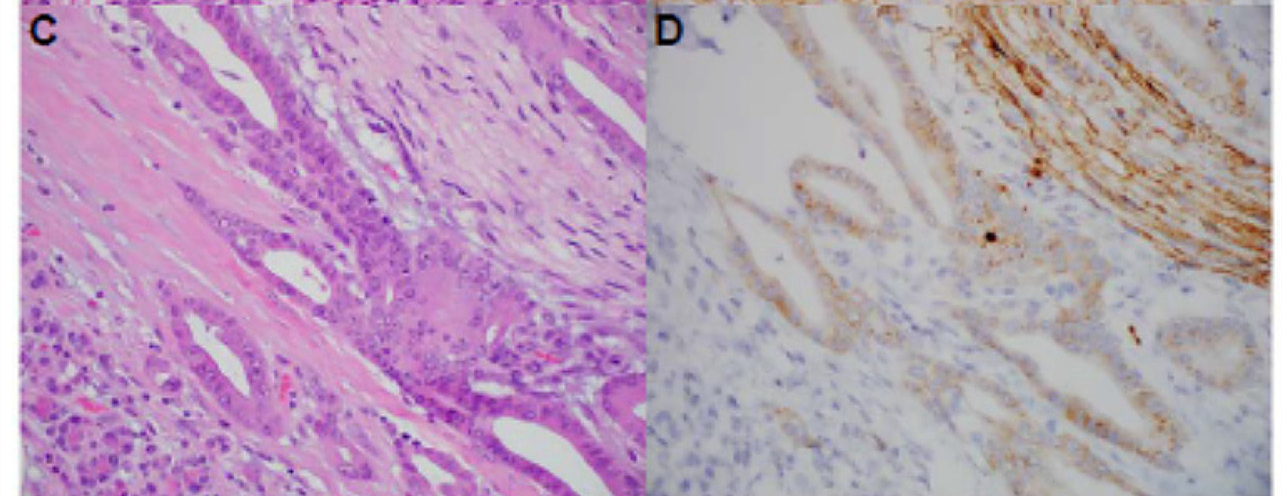
图3. 具有GOLGA4-NTRK3融合的胰腺癌,免疫组化pan-TRK呈“原位杂交样”着色,这样的判定为免疫组化结果不确定。
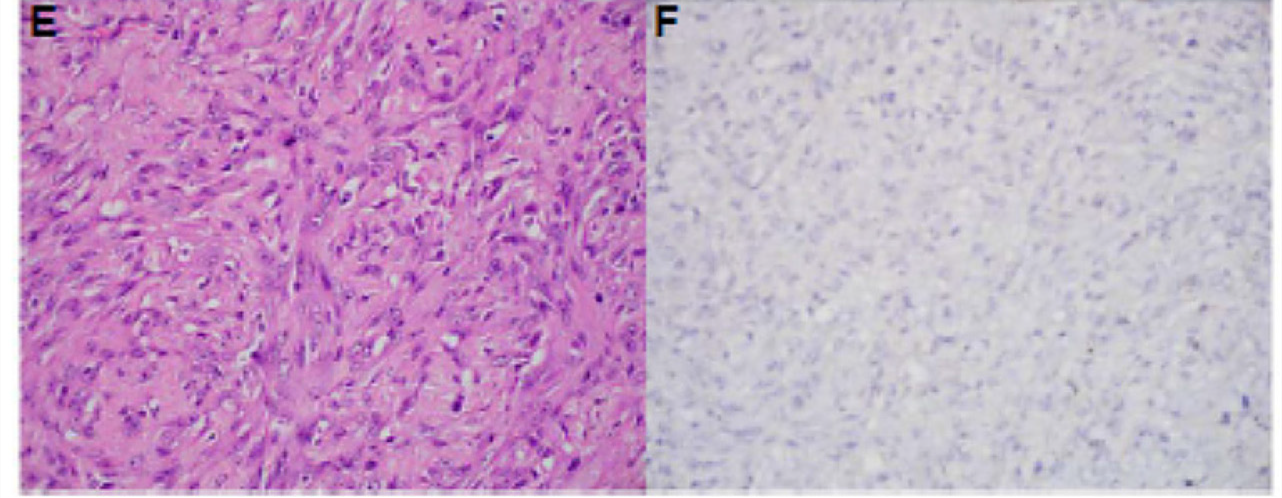
图4. 具有ADAM19-NTRK3融合的肺多形性/梭形细胞肉瘤,免疫组化pan-TRK结果阴性。
尽管例数较少,但上述结果表明免疫组化pan-TRK对于NTRK3融合的敏感性并不理想。
小结
对全瘤种进行NTRK融合筛查,可以筛选出可能自酪氨酸激酶抑制剂治疗获益的病例。但是出于效价比的考虑,可能很多单位无法做到。为平衡相关问题,包括作者所在单位在内、有很多的筛查策略提出,其目的都是为了更加有效的筛选出NTRK融合阳性几率高的病例进行靶向测序。
就免疫组化pan-TRK检测进行初步筛选来说,这一指标的阳性表达模式有很多可能,具体如胞质着色、细胞核着色、细胞膜着色、核旁着色及不同着色模式的组合。有报道称,NTRK融合配体基因的不同决定了免疫组化pan-TRK阳性着色的部位:TPM3融合的病例为细胞膜及胞质着色,ETV6融合的病例为细胞核着色,其他融合的病例则为核旁着色。NTRK基因的不同也会影响免疫组化阳性部位:NTRK1或NTRK2融合一般表现为胞质着色,而NTRK3融合则一般为细胞核着色。不同情况下免疫组化着色程度也有不同,强阳性、弱阳性、局灶着色等均可能出现。本文病例中也体现了上述特点;但一例NTRK3融合的病例未见细胞核着色、而是表现为颗粒状、原位杂交样胞质着色;另外两例NTRK3融合的病例则pan-TRK免疫组化为阴性,但它们的融合配体为其他少见情况。这说明免疫组化结果的确可能有助于预测融合基因的情况,但在少见融合配体中可能没有作用。
总之,本研究结果说明,免疫组化pan-TRK对于NTRK3融合的检出来说,可能敏感性有限。
点击下载原文文献
参考文献
Koehne de González A, Mansukhani MM, Fernandes H, Hsiao SJ. Pan-tumor screening for NTRK gene fusions using pan-TRK immunohistochemistry and RNA NGS fusion panel testing. Cancer Genet. 2022;262-263:47-52.
doi:10.1016/j.cancergen.2021.12.010

















共0条评论