[导读] 译者:慧海拾穗
【摘要】
EWSR1和TFE3都是众所周知的致癌基因。EWSR1编码一种RNA结合蛋白,参与多种软组织肿瘤,包括尤文氏肉瘤/外周神经外胚层肿瘤、促结缔组织增生性小圆细胞肿瘤、软组织透明细胞肉瘤(软组织的恶性黑色素瘤)、骨外黏液样软骨肉瘤和黏液样脂肪肉瘤。TFE3调节高尔基体和溶酶体稳态,并在肾细胞癌(RCC)、腺泡状软组织肉瘤、上皮样血管内皮瘤和血管周上皮样细胞瘤(PEComas)中发生断裂重排。本文报告1例罕见5’EWSR1和3’ TFE3的融合RCC。融合转录物保留了TFE3的大部分功能。其致瘤机制可能与TFE3的过表达有关,TFE3与EWSR1的调控元件并置,并易位至细胞核,破坏了高尔基体和溶酶体内环境平衡。这是第2例携带EWSR1-TFE3基因融合的RCC。
【前言】
EWSR1是一种广泛表达的RNA结合蛋白,在基因表达、RNA加工、细胞分化、自噬和有丝分裂中发挥作用。由于其多才多艺的作用,EWSR1的失调可导致中枢神经系统疾病或肿瘤。EWSR1融合基因与各种类型的肿瘤相关。例如,在尤文氏肉瘤/外周神经外胚层肿瘤中,一组ETS相关的转录因子基因,包括FLI1、FEV、ETV1、ETV4和ERG,与EWSR1基因发生融合。WT1、CREB1/ATF1、NR4A3、DDIT3等基因与EWSR1融合后,分别发生于促结缔组织增生性小圆细胞瘤肿瘤、软组织透明细胞肉瘤(软组织恶性黑色素瘤)、骨外黏液样软骨肉瘤、黏液样脂肪肉瘤。TFE3是一种专门识别E-box序列的转录因子,是高尔基体和溶酶体稳态的主要调节因子。在视网膜色素上皮细胞(ARPE-19)中,TFE3被mTORC1磷酸化,并通过与14-3-3结合保留在细胞质中。当这些细胞饥饿时,TFE3迅速去磷酸化,转位到细胞核,并与编码自噬和溶酶体生物发生的基因的CLEAR(协调溶酶体表达和调节)元件结合,以促进细胞生存。在高尔基体应激的细胞中,TFE3易位到细胞核并与编码糖基化酶、囊泡转运成分和高尔基体结构蛋白的基因GASE(高尔基体应激反应元件)结合,从而上调高尔基体的能力。TFE3在Xp11易位肾细胞癌、腺泡状软组织肉瘤、上皮样血管内皮瘤和血管周上皮样细胞瘤(PEComas)中发生癌基因重排。在此,我们报告了一例罕见的RCC病例,该病例含有EWSR1和TFE3基因融合,此前仅报道过1例。
【病例介绍】
患者,男性,33岁。腹部及盆腔CT扫描偶然发现左肾2.8厘米高强信号肿块影。检查没有发现肿块转移。部分肾切除术,肾及肿块大小2.5×2.3×2.5cm的肾,其中有一个大小为1.8×1.5×1.3cm的肿瘤。肿瘤组织切片苏木精和伊红(H&E)染色显示腺泡状巢状肿瘤,毛细血管网丰富。肿瘤细胞胞质透亮或嗜酸性,细胞核多形,有1~2个核仁(图1A, B)。偶见沙粒体和黑色素。免疫组化结果显示肿瘤细胞TFE3、Vimentin和P504S阳性,CD10、CK7和CD117阴性。Vimentin和P504S均为胞质阳性,TFE3为核染色(图1C-H)。一个用于肉瘤的RNA NGS靶向融合套餐,包括32个通常在肉瘤中作为“诱饵”基因参与的基因,检测到EWSR1-TFE3融合转录本(图2A)。随后用EWSR1和TFE3特异探针通过FISH证实了这两个基因的重排(图2B, C)。我们接下来进行RT-PCR和Sanger测序,结果显示EWSR1-TFE3及其互生产物TFE3-EWSR1均得到表达(图2D, E)。实时定量RT-PCR结果显示,EWSR1-TFE3的表达量比TFE3-EWSR1高10倍(图2F)。EWSR1-TFE3包含EWSR1的前9个外显子和TFE3的后8个外显子。EWSR1-TFE3融合的预测功能基序如图2G所示,包括富含syqg的转录激活域、EWSR1的RGG域、转录激活域(TAD)、基本螺旋-环-螺旋域和TFE3的亮氨酸拉链。在我们的病例中,EWSR1和TFE3上的断点都与已发表的RCC不同,后者包含EWSR1的前12个外显子和TFE3的后5个外显子。在我们的病例中,融合蛋白保留了所有重要的功能基序;而之前的病例中只有基本的螺旋-环-螺旋结构域和亮氨酸拉链,没有TAD,提示TAD在RCC肿瘤发生中可能是不必要的(图2G)。术后6个月临床随访(无辅助治疗),体格检查无明显异常,血液检查正常,血清肌酐正常,胸部、腹部、盆腔CT未见肿瘤复发迹象。
【讨论】
TFE3属于小眼转录因子(MiT)基因家族,其他三个成员包括TFEB、TFEC和MiTF。创始成员(founding member)MiTF与小鼠的小眼睛表型有关。4名MiT成员中有3名在RCC肿瘤发生中发挥作用;虽然MiTF胚系突变与遗传性肾细胞癌相关,但在散发性肾细胞癌中发现体细胞TFE3和TFEB重排导致的致癌融合蛋白。目前在RCC中共发现TFE3基因有14个融合伙伴,包括PRCC、ASPSCR1、SFPQ、NONO、CLTC、MED15、MATRI3、FUBP1、RBM10、KHSRP、PARP14、LUC7L3、DVL2,以及最近报道的EWSR1基因。其中,只有7个是重现性融合:PRCC-TFE3、ASPSCR1-TFE3、SFPQ-TFE3、NONO-TFE3、RBM10-TFE3、CLTC-TFE3和MED15-TFE3。我们的报告证实了TFE3的第8个重现性融合,即EWSR1-TFE3。这些TFE3重排的RCC的致癌机制尚不完全清楚。EWSR1-TFE3融合的两例RCC均保留TFE3 Ser321。可能TFE3与EWSR1的融合会影响其与mTORC1的相互作用,从而阻断其磷酸化作用,中断其与14-3-3的结合,导致EWSR1-TFE3的核易位。总之,我们描述了一种罕见的融合,涉及两个重要的致癌基因,即EWSR1和TFE3。其致瘤机制可能与TFE3的过表达有关,TFE3与EWSR1的调节元件并置,并易位至细胞核,导致破坏了高尔基体和溶酶体内环境平衡。
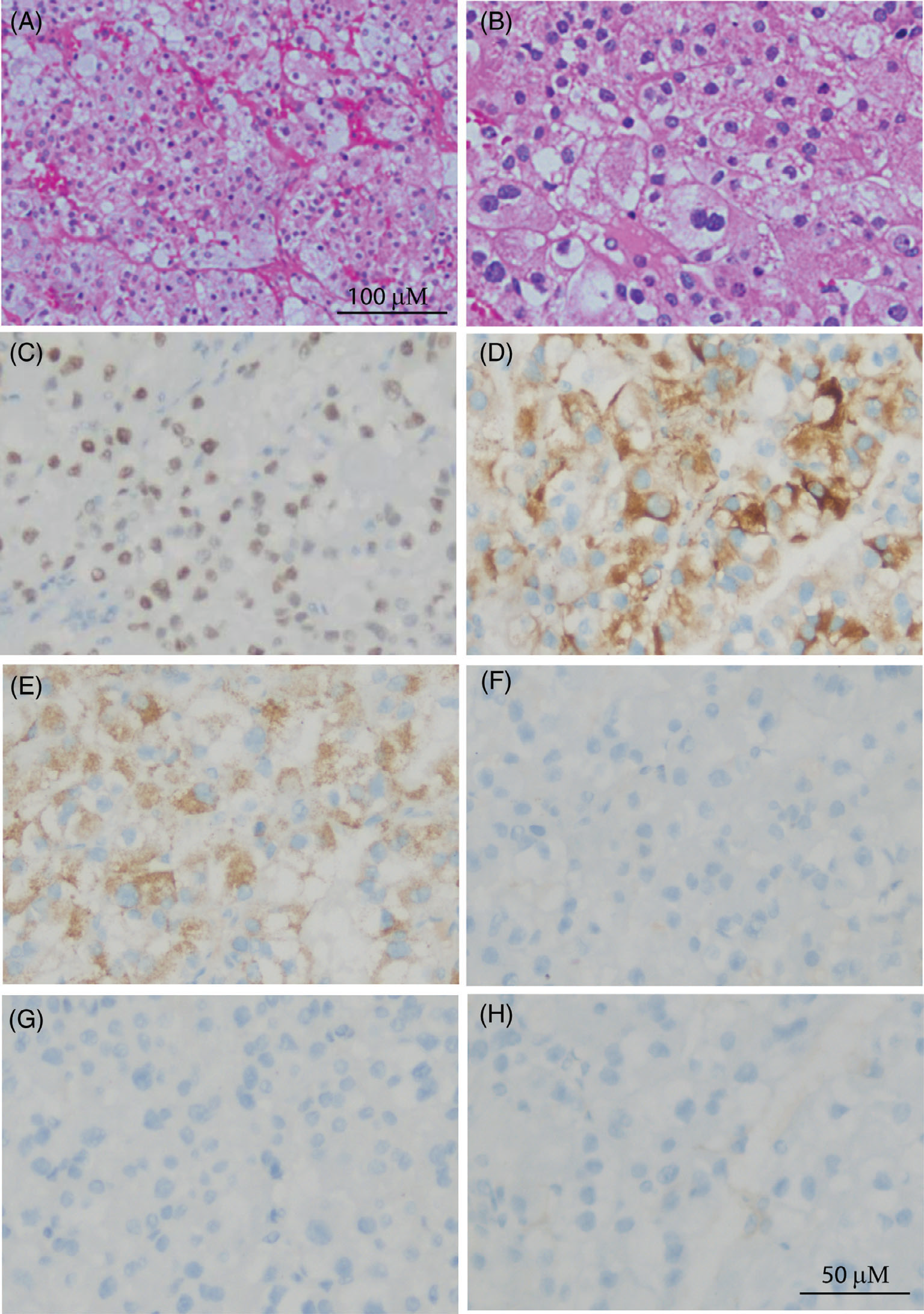
图1肿瘤组织切片HE及免疫组化染色:HE染色显示肿瘤呈腺泡状巢状分布,毛细血管网丰富(A)。肿瘤细胞胞质嗜酸性或透亮,细胞核多形(B)。免疫组化TFE3核阳性(C)、Vimentin胞质阳性(D)、P504S胞质阳性(E),CD10(F)、CK7(G)、CD117(H)阴性。
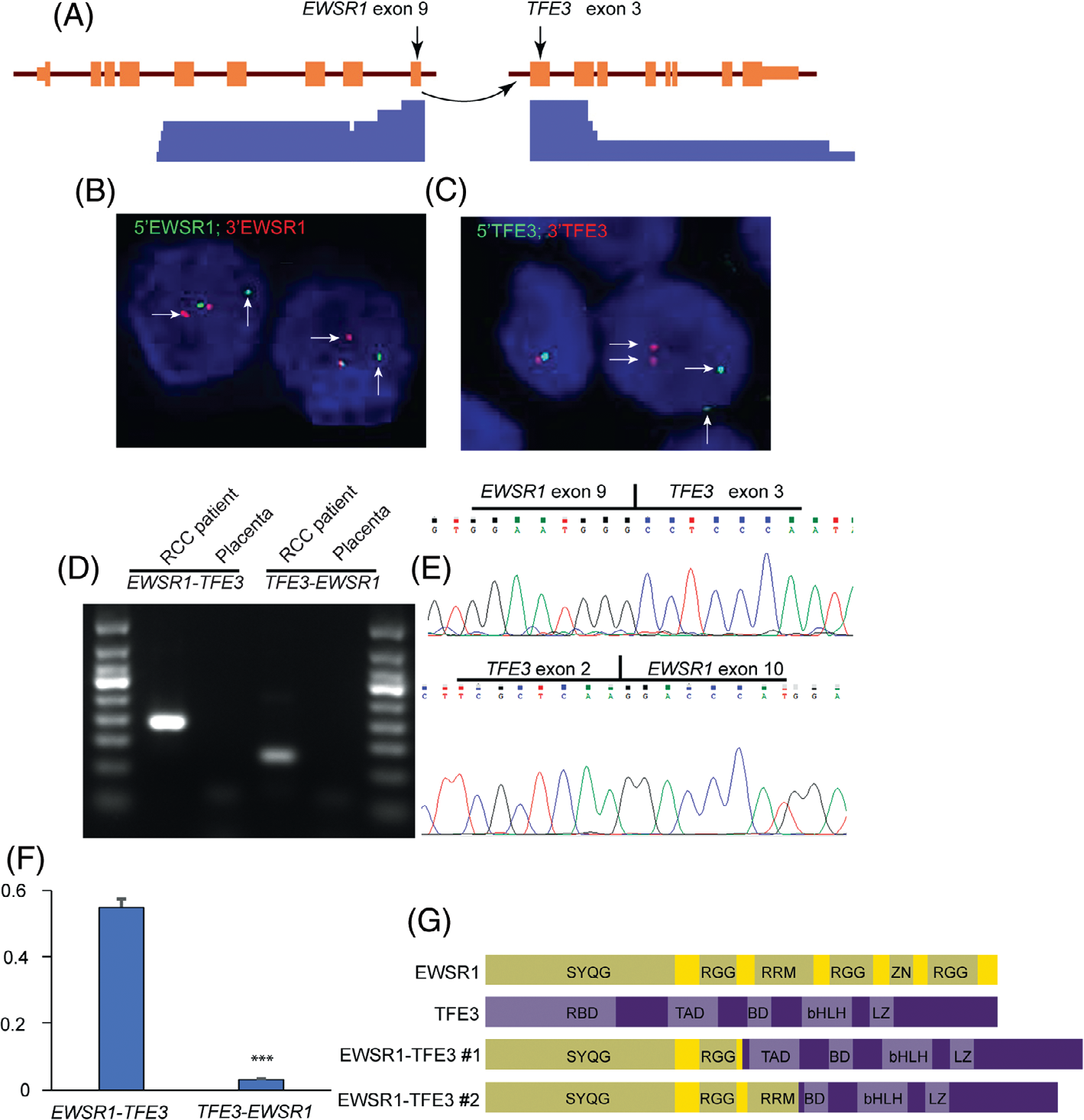
图2:基因检测结果显示EWSR1-TFE3基因融合
【参考文献】
[1] A renal cell carcinoma with EWSR1-TFE3 fusion gene[J].Genes Chromosomes Cancer, 2020,59:325-329.















共0条评论