[导读] 译者:慧海拾穗
儿童低级别胶质瘤的分子遗传学研究进展(1)
儿童低级别胶质瘤的分子遗传学研究进展(2)
儿童低级别胶质瘤的分子遗传学研究进展(3)
儿童低级别胶质瘤的分子遗传学研究进展(4)
【pLGG分子检测平台】
目前,对儿童低级别胶质瘤(pLGG)的分子分析采取了广泛的临床认证的实验室方法。然而,目前还没有“金标准”来检测潜在的分子事件,可以根据组织的大小和多少来预算使用哪种检测法方法。如上所述,研究人员应该努力开发能够识别单核苷酸多态性和基因融合的工具。简单而可靠的检测工具可用于检测常见的改变,如BRAF融合和BRAF p.V600E,可以对近2/3的pLGG进行分子检测。下面,我们讨论了一些常用的用于分子分析pLGG的检测策略,包括它们的组织需求、成本、周转时间和目标特异性等(表2)。
表2用于pLGG分子表征的常用检测技术,包括相关成本、投入需求、局限性和时间需求
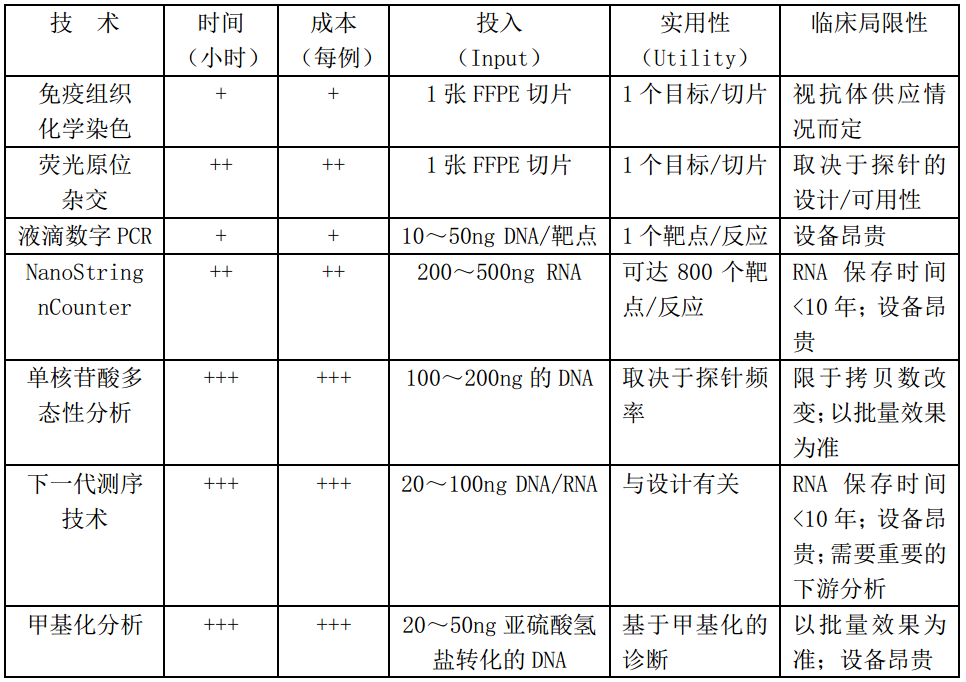
(1)免疫组织化学染色:免疫组化(IHC)是一种简单而可靠的检测方法,可以在大多数实验室中识别特定的改变。免疫组化能够及时、经济地检测表明肿瘤潜在突变状态的特异性蛋白表达,同时在过程中需要很少的组织。在pLGG中,IHC在BRAF p.V600E、H3.3 p.K27M和IDH1 p.R132H的检测中得到了很好的应用,并可用于甲醛固定石蜡包埋(FFPE)组织。然而,这种方法仅限于那些可用抗体的改变。
(2)荧光原位杂交:荧光原位杂交(FISH)可以实现单个细胞分辨率的基因融合和拷贝数事件的可视化。在pLGG中,FISH已被用于识别BRAF、FGFR1、ALK/ROS1/NTRK1/2/3融合和MYB/ MYBL1突变。它也可以用于识别共发生的CDKN2A缺失。FISH技术应用广泛,可用于FFPE标本,但劳动强度相对较高,一次只能测试单个基因改变。
(3)液滴数字PCR:点突变可以使用聚合酶链反应(PCR)技术检测。如果可行,液滴数字PCR(Droplet Digital PCR,ddPCR)的优势是它能够很好地检测到极低变异等位基因频率的突变。此外,ddPCR的高通量检测能力使测试在满负荷运行时负担得起。在这个过程中,单个DNA片段被分割成油液滴(oil-based droplets),并使用针对目标设计的标准TaqMan探针进行扩增。由于每一个油液滴没有竞争,每一个DNA片段都会被放大,从而具有无与伦比的灵敏度。ddPCR不仅能识别点突变,如BRAF p.V600E、H3.3 p.K27M、IDH1 p.R132H、FGFR1 p.N546K和p.K656E,而且根据拷贝数的比较,还能识别CDKN2A缺失、KIAA1549-BRAF[5]和FGFR1 TKD重复。这种技术对降解的DNA非常可靠,包括FFPE标本,并且需要最少的技术操作时间。然而,要实现多样化(multiplex)很困难,而且需要使用昂贵的设备。
(4)纳米系列计数器(NanoString nCounter):NanoString nCounter系统是一种杂交基础平台(hydridization based platform),能够检测多种融合转录本。NanoString可用于筛选常见融合基因,如涉及BRAF的融合(包括上述典型KIAA1549BRAF和非典型融合)和FGFR1-TACC1,以及包括涉及ALK、ROS1、NTRK和MET的罕见融合。该技术适用于FFPE标本,需要最少的技术操作时间,生物信息分析也相对简单。然而,投入需求相对较高(200~500ng RNA),必须知道融合伙伴和精确的断点,并且需要使用昂贵的设备。
(5)单核苷酸多态性(SNP)分析:在使用基因特异性工具无法发现特定改变的情况下,或者当拷贝数改变在肿瘤管理中发挥作用时,可以使用全基因组SNP阵列。SNP阵列是一种基于探针的分子分析技术,优化检测拷贝数变异。它们在pLGG分子谱中的应用包括BRAF和FGFR融合的鉴定、MYB和MYBL1的改变和CDKN2A的缺失。SNP阵列对FFPE标本的要求不是很高,但需要昂贵的试剂、较长的技术操作时间和批量样品,以及适量的标本(100~200ng的DNA)和昂贵的设备。
(6)下一代测序(Next generation sequencing)技术:近年来,使用下一代测序(NGS)平台对实体肿瘤进行分子检测已得到广泛应用。这些平台范围从大约300~500个(或更多)基因靶点,通常包括pLGG中的大多数改变基因。基于测序的方法具有在单一测试中同时检测大多数临床相关改变的优点,从而可以作出诊断、预后和治疗决定。然而,与其他技术相比,组织质量要求通常更高,技术动手时间和下游分析更复杂和耗时,导致更长的周转时间和成本。还需要获得昂贵的设备,所有这些都限制了这些方法在全球的使用。然而,在上述检测方法无法识别pLGG分子驱动的情况下,NGS方法具有极大的优势。
(7)甲基化分析(Methylation Profiling):DNA甲基化分析是另一种可以帮助诊断中枢神经系统肿瘤的工具。这种方法在帮助诊断困难的肿瘤实体方面特别有用,并且对FFPE标本上的要求不是很高。此外,当前甲基化阵列可以检测拷贝数的改变,尽管其分辨率低于SNP阵列。然而,甲基化分类在pLGG中可能不太实用,这可能是因为这些肿瘤中经常包含正常组织。此外,甲基化分析仍然昂贵,受批处理(batch effects)影响,必须在8组中运行。此外,因为甲基化谱的实用性属于肿瘤诊断,因此需要进一步的研究。
【pLGG的靶向分子治疗】
(1)BRAF抑制剂
第一代BRAF抑制剂包括达拉非尼(dabrafenib)和威罗非尼(vemurafenib,维莫非尼)已在携带BRAF p.V600E的黑色素瘤患者中显示出良好的效果,目前正在研究其在pLGG中的应用。文献报道,将这些药物用于单一药物治疗的病例报告显示了极好的结果,大多数报告的完全缓解。这些发现最近在一个更大的BRAF p.V600E肿瘤队列中得到证实,这些BRAF抑制剂中的任何一种都能诱导患者显著的细胞减少和延长生存。这些结果导致了一项多研究所I期临床试验,初步结果显示,达拉非尼的总有效率为41%。目前,一项优化给药安全性和耐受性的后续试验正在进行中(NCT01677741)。尽管第一代BRAF抑制剂对BRAF p.V600E肿瘤有效,但在KIAA1549-BRAF或BRAF野生型肿瘤中使用时,会导致RAS/MAPK信号的矛盾激活。这是一项索拉非尼(sorafenib)实验的病例,该实验导致肿瘤加速生长,并导致实验提前终止。为了纠正这一问题,研究人员设计了第二代“矛盾打破剂”,在不引起矛盾RAS/MAPK激活的情况下抑制BRAF。值得注意的是,CRAF融合pLGG对第一代和第二代BRAF抑制剂均无反应。这归因于CRAF融合伙伴介导的蛋白质相互作用。这强调了在做出治疗决定之前对pLGG进行仔细分子表征的必要性,并强调了在没有适当分子表征的情况下进行实验的风险。
(2)MEK抑制剂
对于不适合NF I型pLGG(NF1-pLGG、KIAA1549-BRAF融合等)的BRAF抑制剂, MEK抑制已成为一种有前景的治疗策略。目前,四种MEK抑制剂司美替尼(selumetinib)、曲美替尼(trametinib)、考比替尼(cobimetinib)和比美替尼(binimetinib)正处于不同的临床试验阶段。对于司美替尼, I期和II期试验均已完成。I期研究聚焦于与NF1相关的散发性难治性或进行性pLGG,显示32/38例患者表现出稳定或肿瘤大小缩小。在一项II期研究中也出现了类似的结果,使用司美替尼治疗复发性pLGG获得了令人印象深刻的结果,40%的NF1患者获得部分缓解,只有1例患者在治疗期间进展。鉴于这些良好的结果,正在努力评估司美替尼作为单一药物或联合药物在新诊断患者中的应用。曲美替尼试验共6例,2例局部反应,3例轻微反应,1例病情进展。
(3)FGFR1抑制剂
由于其功能的重要性和对癌症的频繁影响,多种小分子FGFR抑制剂被开发出来,其中一些已经在一系列恶性肿瘤的临床试验中。其中包括用于治疗FGFR-TACC融合的恶性胶质瘤的AZD4547 和其他几个先前综述的[Fibroblast Growth Factor Receptors (FGFRs): Structures and Small Molecule Inhibitors. Cells. 8(6). pii: E614. doi: https://doi.org/10.3390/cells8060614.]。这些试验的结果将不可避免地影响这些药物在儿童胶质瘤的适用性。
(4)ALK/ROS1/NTRK抑制剂
ALK、ROS1和NTRK的改变在pLGG中相对少见。方便的是,这些基因的改变在包括肺癌和结直肠癌在内的成人恶性肿瘤中很常见,因此,获得联邦政府批准的靶向药物已经开发和检测。这些药物包括克唑替尼(Crizotinib)、色瑞替尼(ceritinib)、卡博替尼(cabozantinib)以及许多研究药物,如布加替尼(brigatinib)(ALK/ROS1)、恩曲替尼(entrectinib)(ROS1/TRK)、larotrectinib(拉罗替尼)(TRK),后者最近被批准用于治疗TRK改变的癌症。在儿童胶质瘤中,恩曲替尼和larotrectinib都显示出了强有力的抗肿瘤作用。这些结果导致目前一项儿科I/Ib期研究正在进行,以评估恩曲替尼在中枢神经系统原发性肿瘤中的作用。
•••End•••
【参考文献】
[1]Ryall et al. Pediatric low-grade glioma in the era of molecular diagnostics. Acta Neuropathologica Communications (2020). https://doi.org/10.1186/s40478-020-00902-z














共0条评论