[导读] 译者:慧海拾穗
【前言】
中枢神经系统肿瘤是儿童最常见的实体肿瘤,其中儿童低级别胶质瘤(pediatric-type low-grade gliomas,pLGG)是最常见的,约占所有儿童脑瘤的30%。pLGG被世界卫生组织(WHO)定义为 I级或II级恶性肿瘤,包括可出现在整个中枢神经系统的各种组织学类型。本文对儿童pLGG的组织形态学分类及分子遗传学研究进展进行综述。
【pLGG的组织形态学分类】
pLGG是一组异质性肿瘤,主要包括胶质细胞组织的肿瘤,包括星形细胞和/或少突胶质细胞,以及神经-胶质细胞混合形态的肿瘤。根据目前WHO的分类,这些肿瘤被认为是I级和II级,它们与高级别胶质瘤的区别在于其特殊的形态学特征,而在弥漫性胶质瘤中,则是因为其没有坏死、核分裂象和微血管增生。表1列出了pLGG的组织学诊断及其标志性的分子改变(图1)。在很多病例中,不同的组织实体很容易区分,但也有一些病例存在形态学的重叠,包括多形性黄色星形细胞瘤和神经节细胞胶质瘤之间的组织学重叠,以及胚胎发育不良型神经上皮瘤和少突胶质细胞瘤之间的组织学重叠。此外,典型界限清楚的肿瘤,如毛细胞星形细胞瘤,可能具有浸润性成分,导致诊断和分级困难。对于深部中线肿瘤,一个小的活组织检查是唯一可行的方法,但精确的组织学诊断可能尤其具有挑战性。对于这种情况,这些方法很少能捕捉到肿瘤的真正复杂性,而经典的形态学特征往往缺乏诊断依据。除了这些困难,pLGG在形态上与成人更常见的肿瘤也存在形态学上的重叠。这造成了关于适当分级和治疗的混淆,并且由于使用类似的术语,即弥漫性星形细胞瘤和少突胶质细胞瘤而加剧。在最近的WHO分类中,弥漫性星形细胞瘤和少突胶质细胞瘤都根据IDH1突变的存在或不存在进行分类,此外还有1p/19q共缺失。在儿童年龄组,具有少突胶质细胞瘤或弥漫性星形细胞瘤形态的肿瘤通常没有IDH1突变和/或1p/19q共缺失,更值得关注的是弥漫性星形细胞瘤IDH野生型。后者引起了人们对胶质母细胞瘤(glioblastoma,GBM)的关注。这两种诊断都可能导致成人弥漫性胶质瘤的常规治疗,包括细胞毒性化疗和放疗,特别是在青少年和年轻的成人年龄组。然而,在IDH1野生型病例中,儿童少突胶质细胞瘤最常见的是FGFR1突变包括TKD串联重复或SNVs或BRAF p.V600E(表1)。最近有年轻人多形性低级别神经上皮性肿瘤(polymorphous low-grade neuroepithelial tumor of the young,PLNTY)的报道。这些肿瘤均具有少突胶质细胞瘤样细胞成分和高度浸润的形态特征,但具有典型IDH突变型少突胶质细胞瘤少见的良性临床病程。这些肿瘤不携带IDH1突变,而是FGFR2/3融合(下文进一步讨论)或BRAF p.V600E。IDH1野生型弥漫性星形细胞瘤最常见BRAF p.V600E突变,约占40%的病例。此外,它们有时包含KIAA1549-BRAF融合、FGFR1 SNV或MYB或MYBL1改变。后一种改变最初是在儿童弥漫性星形细胞瘤中描述的,到目前为止的报道表明,它们在没有治疗的情况下具有良性的临床过程。最近,这些被归为同类弥漫性胶质瘤(isomorphic diffuse glioma)。在这些病例中,误诊可能导致过度治疗,导致潜在的有害后遗症。认识到对成人弥漫性胶质瘤的分子基础的理解增加,为了提高诊断的可重复性并为患者提供重要的预后信息,IDH1突变和1p/19q缺失状态被纳入了最近的WHO修订版。将类似的分子特征纳入pLGG的分类将有助于更准确地识别这些实体,更重要的是,将其与成人型胶质瘤区分开来,后者预后较差,需要更积极的治疗。
表1 WHO公认的pLGG组织学诊断及常见分子学改变
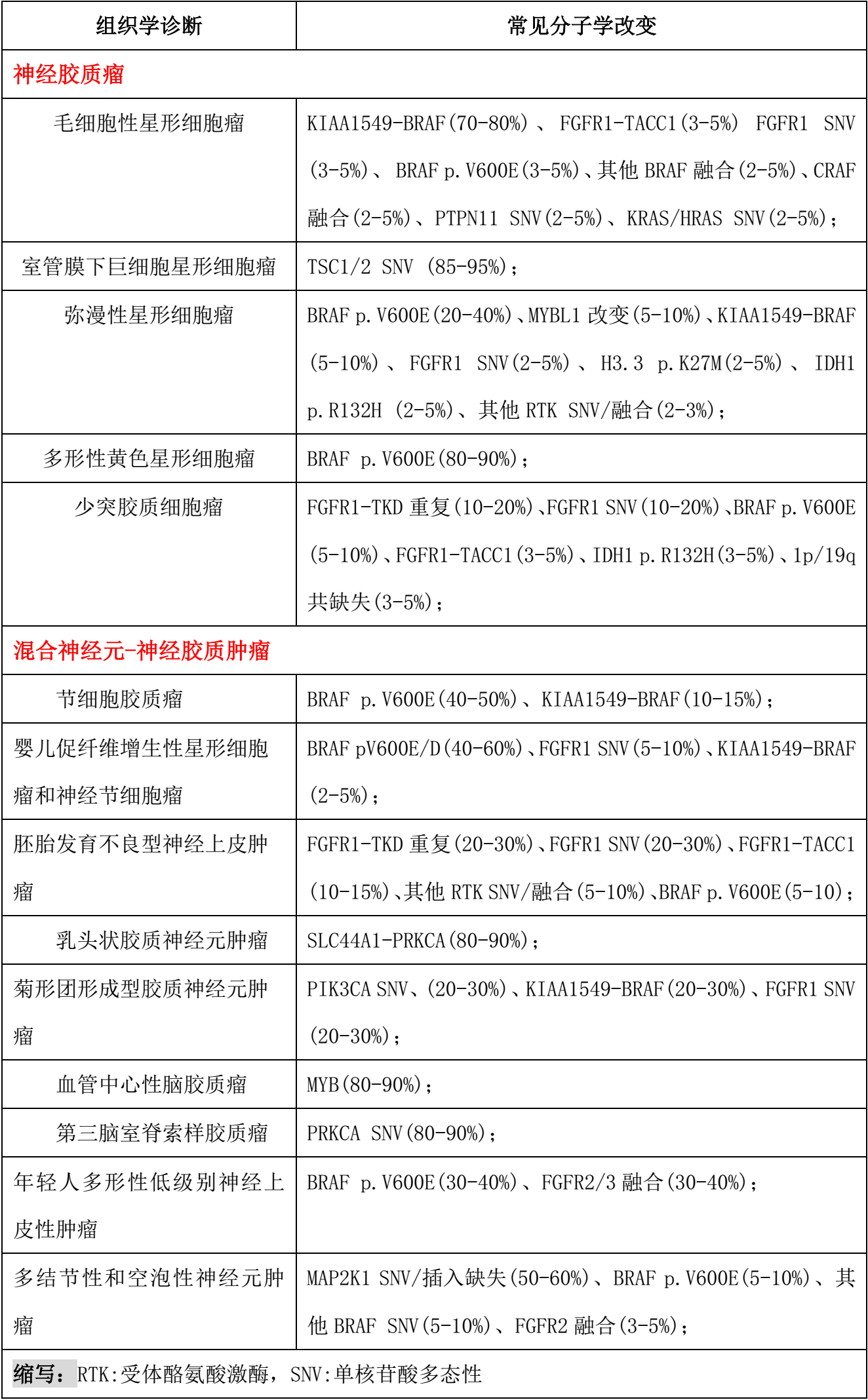
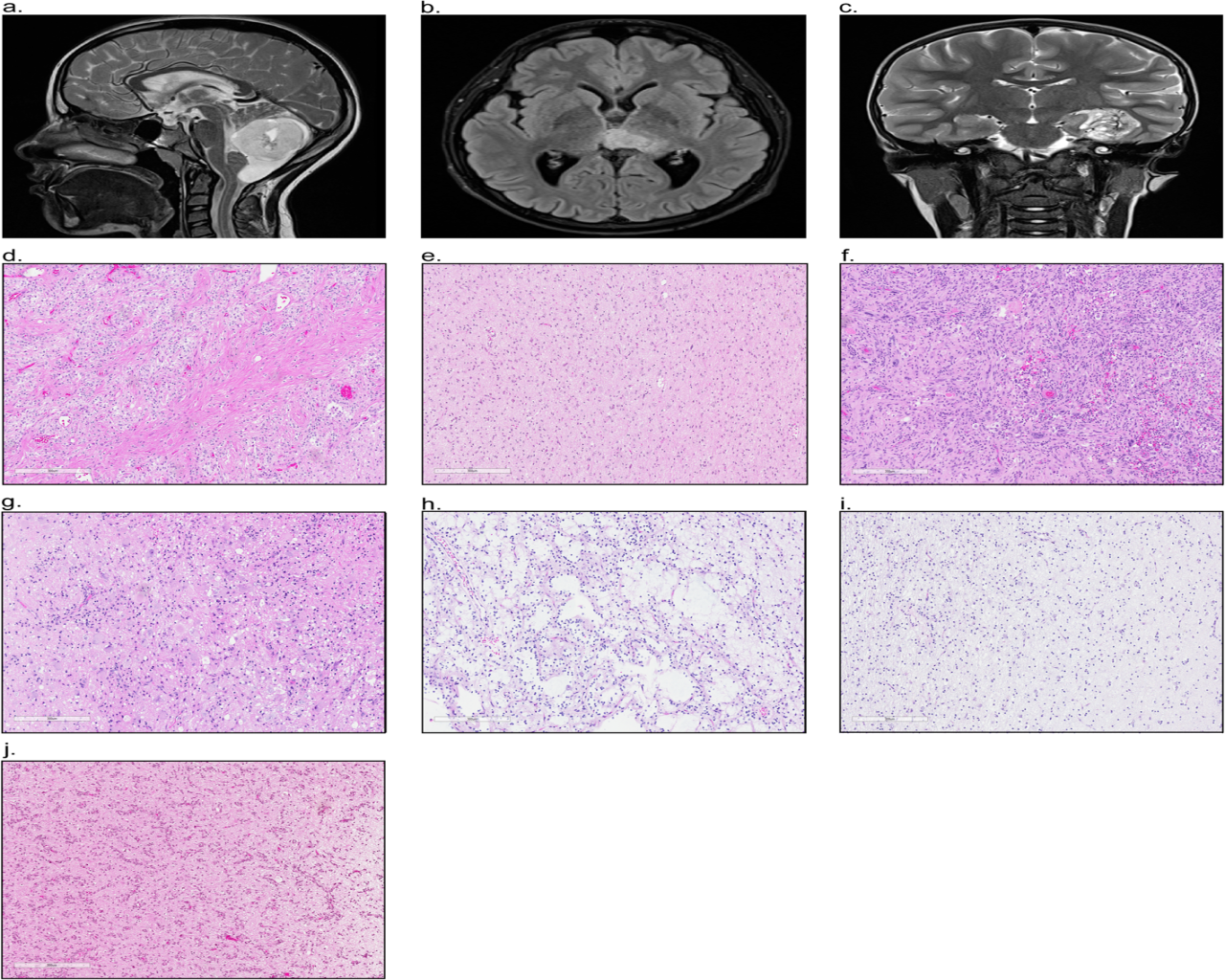
图1所示为磁共振成像(MRI)显示发生于小脑(a)、丘脑(b)和枕叶(c)的儿童低级别胶质瘤,HE染色突出了典型的组织学特征:毛细胞性星形细胞瘤(d)、弥漫性星形细胞瘤(e)、多形性黄色星形细胞瘤(f)、神经节细胞胶质瘤(g)、胚胎发育不良型神经上皮瘤(h)、少突胶质细胞瘤(i)和血管中心性胶质瘤(j)。
【pLGG的基因表达谱】
(1)RAS/MAPK通路的上调:过去十年对pLGG的潜在生物学产生了前所未有的见解。重要的是,我们现在知道大多数pLGG是由一个单一的基因事件驱动的,导致RAS/MAPK通路的上调。我们首次发现RAS/MAPK参与pLGG发病机制来自神经纤维瘤病I型(NF1)患者,其中10~15%发展为低级别胶质瘤。从那时起,分子分析的努力发现了这一通路中的额外改变,其频率如此之高,以至于许多人假设pLGG是一种“单通路疾病”。pLGG中最常见的RAS/MAPK通路改变概述如图2所示。
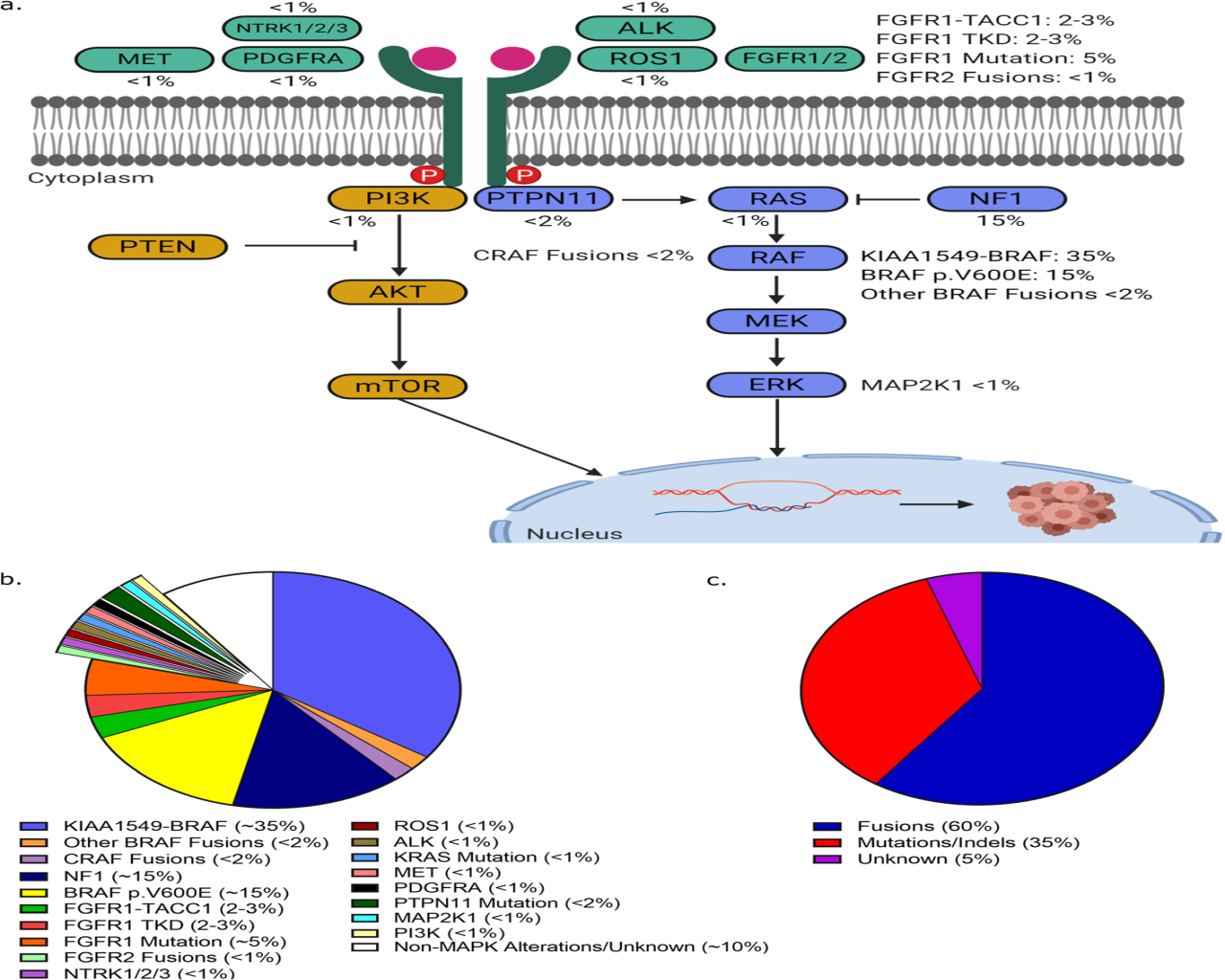
图2所示:在儿童低级别神经胶质瘤中识别出的RAS/MAPK改变示意图(a);在人群水平上,在儿童低级别胶质瘤中发现RAS/MAPK改变的平均频率(b);儿童低级别胶质瘤基因的改变类型(c)。
(2)神经纤维瘤病1型:神经纤维瘤病I型(NF1)是世界上最常见的遗传性肿瘤易感性综合征,与多种临床表现相关,包括皮肤色素沉着异常、学习障碍、癫痫和血管病变。NF1是由NF1肿瘤抑制基因的胚系突变引起的,该基因编码神经纤维蛋白,一种GTPase激活蛋白,作为负调控RAS。10~15%的NF1患儿会在视觉通路内发展为低级别胶质瘤,另外3~5%的患儿会在视觉通路外发生。与NF1相关的胶质瘤通常表现为野生型等位基因的缺失,因此,神经纤维蛋白作为RAS负调控因子的内源性功能丢失。通常,NF1-pLGG无症状且无症状,无需治疗干预,在某些情况下,无需治疗就会复发。然而,在临床恶化(最常见的是视力下降)的情况下,化疗是治疗的一线方案。尽管病程是良性的,但NF1-pLGG发生在年幼儿童(<2岁)和/或视神经通路以外的患儿被认为具有更侵袭的进展和/或死亡风险。历史上,由于NF1-pLGG的位置不确定,以及所获得的附加信息缺乏临床应用,因此不需要对其进行活检。然而,最近的一项研究发现,NF1-pLGG确实存在额外的基因改变。最常见的是,这些是影响RAS/MAPK通路或涉及转录调节因子的额外异常。此外,NF1-pLGG的突变谱与NF1--高级别胶质瘤(HGG)不同,后者含有TP53、CDKN2A和ATRX的改变。因此,从被认为风险较高的患者中获取活检,可能被证明是有价值的,可以识别需要精细和/或新的治疗方法的患者,并将其与NF1-HGG区分开来,特别是在成人中。
•••未完待续•••
【参考文献】
[1]Ryall et al. Pediatric low-grade glioma in the era of molecular diagnostics. Acta Neuropathologica Communications (2020). https://doi.org/10.1186/s40478-020-00902-z
















共0条评论