[导读] 作者:吕亮,张英(重庆市公共卫生医疗救治中心 病理科,400036)
【关键词】黏膜相关淋巴组织(MALT);淋巴瘤;病理诊断;治疗与预后
患者男性,52岁,无明显诱因出现左侧胸部间断性钝痛3个月,以深呼吸及咳嗽时为甚,1周前前往县中心医院行胸部CT,提示左肺上叶下舌段、下叶感染性性病变并实变,双侧胸膜增厚,为求进一步治疗,患者于2021年3月3日入我院胸外科。患者2年前因发热、活动后气促在县人民医院行胸腔抽液引流600ml,诊断结核性胸膜炎(未见病理报告),规律抗结核治疗13个月后在医师指导下停药。专科查体:生命体征平稳,胸廓对称、无畸形,胸骨无叩痛。呼吸运动正常,肋间隙无增宽、变窄,呼吸规整。左肺下叶叩诊呈实音,右肺及左肺上叶叩诊清音,左肺下叶呼吸音减弱,右肺及左肺上叶呼吸音清晰,语音传导正常,未闻及干湿性啰音、胸膜摩擦音。辅助检香:结核金标+蛋白芯片结核抗体IgM(金标)阳性,余结核基因相关抗体检查结果为阴性;血常规:红细胞4.99(1012/L)↓,血红蛋白14800(g/L) ↑,白细胞459 (109/L) ↑,血小板268 (109/L) ↑,中性细胞数240(109/L);肿瘤标志物无升高,梅毒抗体阳性。患者一般情况好,神志清楚,病程中无咳嗽、咳痰、发热、畏寒、潮热、盗汗、咯血、消瘦,既往有吸烟史及冶游史,以胸痛为主诉,未诉其他特殊不适,本院CT结果与院外CT结果均可见左肺下叶实变,无肺门淋巴结增大,实变区病灶无明显变化且原因不明,有手术指征,与患者及家属交代病情后,患者手术意愿强烈,于3月8日行左肺下叶切除术+胸膜粘连烙断术+肺修补术,术中见左侧胸腔广泛粘连,胸壁未见结节,左肺下叶前内基底段及外基底段实变,质地较硬,质硬区大小约15x10x7cm。
病理检查 巨检:(左肺下叶)左肺下叶切除标本一个,大小约14x9x7cm,切开见一灰黄色区域,大小约2x1.5x1.5cm,切面灰黄灰红色,质中。镜检:送检组织原有正常结构被破坏,形成淋巴上皮样病变,肿瘤细胞弥漫浸润,呈小淋巴样细胞,细胞核圆形或卵圆形,胞质丰富嗜碱性,核分裂少见,病灶周围见反应性淋巴滤泡增生。免疫组化:CD21、CD23(残存FDC网+)、CD20、PAX-5、BCL-2、MUM-1阳性,P53、c-MYC、CD3、CD5、CD10、BCL-6、CK、CyclinD-1阴性,Ki-67增殖指数约5%,结核脱氧核糖核酸检测阳性。病理诊断:原发性肺黏膜相关淋巴组织淋巴瘤(Primary pulmonary mucosa-associated lymphoid);结核。
术后行左侧胸腔闭式引流,同时予以抗炎、止血、抗结核等治疗。复查胸部X线:左下肺野透光减低,可见斑片状稍高密度影,术侧肺呼吸音降低,未闻及干湿啰音,提示病灶稍有吸收。复查胸部CT:左侧胸壁软组织增厚,左侧胸腔少量积气,压缩约15%,考虑术后改变,无需特殊处理。目前患者术后恢复好,胸腔负压引流液少,神志清,无气促、呼吸困难,病情平稳。术后病理提示MALT ,但无肺门及其他部位淋巴结肿大,病变较局限,与患者沟通后,建议随访复查,继续抗结核治疗,患者于3月24日出院,截至8月,随访5个月,无复发。
讨论 原发性肺淋巴瘤(Primary pulmonary lymphoid,PPL)是一种罕见的起源于肺的淋巴细胞恶性克隆性增殖性疾病,累及单肺或双肺,占肺原发性恶性肿瘤的0.5-1.0%,占原发性结外淋巴瘤的3.0-4.0%[1]。PPL包括原发性肺HL和NHL(PPHL和PPNHL),其中PPNHL最为常见,多数病变起源于支气管相关淋巴组织,其中黏膜相关淋巴组织(MALT)淋巴瘤最常见(58.0-90.0%),弥漫性大B细胞淋巴瘤(10%)、滤泡性淋巴瘤、套细胞淋巴瘤和淋巴浆细胞性淋巴瘤较少见[2-4]。边缘区淋巴瘤(MZL) 占所有B细胞非霍奇金淋巴瘤的8-12%,包括3个亚型:结外MZL (EMZL70%)、脾MZL(SMZL20%) 和淋巴结MZL (NMZL10%)[4],MALT占EMZL的大部分,好发于胃(35%)、眼附件(13%)、肺(9%)、皮肤(9%)、唾液腺(8%)和甲状腺(2%)等部位,是一种低级别非霍奇金B细胞淋巴瘤,于1983年被病理学家Peter Isaacson和 Dennis Wright描述,他们注意到某些胃淋巴瘤出现Peyer斑块样特征,Peyer斑块是回肠末端淋巴样细胞积聚,这些观察结果很快扩展到其他结外部位,形成了当前MALT淋巴瘤定义的基础[5,24]。关于各器官MALT淋巴瘤的潜在病理机制尚未完全解决,确切患病率仍不清楚,虽然起源部位不同,但MALT常与自身免疫情况、慢性炎症有关,血清结果包括单克隆丙种球蛋白病,高达30%的病例出现血清单克隆IgM升高,潜在的免疫刺激可使其进展为侵袭性高级别淋巴瘤,细菌可通过激活免疫细胞内信号通路、调节细胞凋亡和细胞增殖,引发慢性炎症,来参与B淋巴细胞转化和淋巴瘤的发生。幽门螺杆菌是I类致癌物,可在胃粘膜中长期定植,毒力因子CagA蛋白和VacA毒素激活内质网激酶、p38丝裂原活化蛋白激酶等信号通路,导致胃上皮细胞的损伤和解体,重组肌动蛋白细胞骨架、抑制B淋巴细胞凋亡[6],同时巨噬细胞和树突状细胞分泌IL-8、IL-3、TNF-α、一氧化氮和氧自由基,使细胞膜去极化,改变线粒体膜通透性,破坏溶酶体功能,诱导慢性持续性炎症的发生、细胞凋亡及T淋巴细胞的浸润,反应性CD4T淋巴细胞产生高水平的IFN-γ,促进肿瘤性B细胞的增殖[7-8]。宿主自身产生的趋化因子受CXCR3及其配体Mig在活化的T细胞和恶性B细胞上表达,另有研究提出胃MALT淋巴瘤的发展与CCR7、CXCR3和CXCR表达增加以及CXCR缺失有关[9]。伯氏疏螺旋体感染皮肤导致莱姆病,在感染过程中,淋巴细胞浸润真皮,形成非典型淋巴滤泡,持续的炎症(如慢性萎缩性肢端皮炎和多发性神经根神经炎)可导致单克隆B细胞增殖和BCL-2蛋白表达[10]。眼部附件(结膜、眼眶软组织和泪器)MALT淋巴瘤被报道与鹦鹉热衣原体有关,带菌或发病的鸟类、家禽、野生水鸟、鹦鹉、金丝雀等鸟类是重要的传染源,人类接触后常导致无症状感染,也可引起慢性结膜炎、肺炎、肝炎和心包炎,患病率差异较大,部分MALT患者未检测到衣原体[11],衣原体可诱导宿主自身抗原发生免疫反应,机体无法消除病原体导致淋巴生成,目前鹦鹉热衣原体感染机制仍处于模拟与实验阶段[12]。肺部或支气管的淋巴管由气道黏膜区域的淋巴组织组成,主要由B细胞组成,吸入的抗原刺激机体分泌细胞因子及免疫球蛋白,B细胞形态功能发生变化,导致结外淋巴组织积聚, 慢性炎症可能是感染、自身免疫、吸烟、环境或其他未知因素,特异性的病原体尚未发现[16]。约30-50%的胃肠道和肺部MALT淋巴瘤患者,可出现细胞遗传学突变T(11;18)(q21;q21),其他遗传学突变包括T(14;18)(q32;q21)、T(1;14)(p22;q32)、T(3;14)(p14.1;q32)[13]。肺部MALT淋巴瘤好发于老年患者,中位年龄66岁,年轻患者及儿童少见,男女比例约1:1[14]。临床表现通常不明确或缺乏,可出现慢性咳嗽、咳痰、呼吸困难、胸痛、咯血、发热、疲劳、消瘦等非特异性症状,影像学无特征表现,易与肺癌混淆,常表现为单侧肺部实变或结节影,密度均匀或呈片状高密度影,纵隔无明显异常[15],经纤维支气管镜活检通常难以确诊,因标本较小,故外科肺活检是必要的。
MALT淋巴瘤是由小B细胞组成的结外边缘区淋巴瘤,肿瘤细胞可呈中心细胞样细胞、单核样细胞、小淋巴细胞样细胞,免疫母细胞和中心母细胞散在其中,核分裂少见,偶尔出现大细胞,部分病例伴有浆细胞分化或背景大量T淋巴细胞。肿瘤细胞沿滤泡周围浸润性生长,形成边缘区分布,侵犯套区或滤泡区(滤泡植入),最终播散形成大的弥散区域,上皮常被散在或聚集成团的肿瘤细胞浸润和破坏,形成淋巴上皮病变。肿瘤细胞表达全B细胞抗原:CD20、PAX5、CD19、CD79α、Bcl-2,CD10、Bcl-6残存滤泡阳性,CD21、CD23滤泡树突细胞网阳性,IgM、IgG、IgA通常阳性,限制性轻链表达,一般不表达CD5,Ki-67指数<20%[17]。鉴别诊断:(1)反应性炎症:反应性淋巴细胞可浸润上皮,但不会形成肿块或显著破坏性改变。(2)浆细胞瘤:MALT淋巴瘤伴大量浆细胞分化时难以与浆细胞淋巴瘤鉴别,但缺乏淋巴上皮病变及CD20阴性表达,应诊断浆细胞淋巴瘤。(3)套细胞淋巴瘤:小到中等单一的淋巴细胞弥漫浸润性生长,无大细胞,肿瘤细胞表达CD5、cyclin-D1。(4)滤泡性淋巴瘤:肿瘤细胞结节状弥漫性生长,表达B细胞抗原,MALT淋巴瘤累及淋巴结伴有滤泡植入时,难以与滤泡性淋巴瘤鉴别,分子遗传学可提供帮助,近半数MALT淋巴瘤MNDA阳性,<10%的滤泡性淋巴瘤阳性。(5)其他:肺结核抗酸染色阳性,临床病史明确,影像学资料可资鉴别;肺癌多为单发病灶,组织学及免疫组化可协助诊断;淋巴细胞性间质性肺炎、慢性非特异性炎症镜下特点及免疫组化可鉴别[18]。
MALT淋巴瘤通常表现出惰性病程,多为局部病变,进展缓慢,由于其罕见性和异质性,没有标准的治疗方法可用,治疗选择取决于两个主要方面:受累器官和疾病的扩展,包括手术切除、免疫疗法、化学疗法、放射疗法。对于一定比例的患者,包括老年患者、伴有严重合并症的患者、完全切除病灶的患者或是无症状的患者,观察等待策略是合理的。病灶局限,仅位于一侧,无其他器官及淋巴结转移的病例,手术切除是很好的选择,可以大大降低肿瘤负荷,我们的患者正是如此,且术后恢复良好。在胃MALT淋巴瘤、眼附件MALT淋巴瘤、皮肤MALT淋巴瘤患者中,针对幽门螺杆菌、鹦鹉热衣原体和伯氏疏螺旋体刺激引起的慢性炎症,分别使用铋剂四联疗法(奥美拉唑+阿莫西林+果胶铋+克拉霉素)、头孢菌素、四环素和强力霉素等抗生素治疗是首选的一线治疗[19],对于抗生素难治性局部疾病的患者,放射治疗具有良好的广泛应用,被用作挽救性治疗,目前尚不存在一个普遍接受的放射治疗方案,建议剂量25-30gray,最小靶剂量25gray,毒性较小。眼附件MALT淋巴瘤患者通常在治疗后2至5年发生白内障,MALT 淋巴瘤患者会出现短暂的厌食、恶心或消化不良,唾液腺MALT淋巴瘤患者会出现口干,肺MALT淋巴瘤患者出现纤维化,这些并发症通常需要长期调整[22]。对于复发性或难治性病例,建议选择利妥昔单抗+苯达莫司汀或利妥昔单抗+苯丁酸氮芥作为一线化方案疗,MALT淋巴瘤患者临床病程缓慢,预期寿命较长,化疗药物的毒性在治疗选择中很重要,不建议CHOP或R-CHOP化疗方案,以尽量减少毒性,保持疗效[20]。尽管MALT淋巴瘤罕见且缺乏标准治疗方案,但预后良好,5年生存率为86-95%,中位生存期超过12年[21],鉴于疾病的惰性,应避免就诊间隔过短,前2年每3至4个月一次,随后3年每6个月一次,此后每年一次,直到完成10年的随访,即使在第10年复发,终生临床随访依旧是合理的[23]。
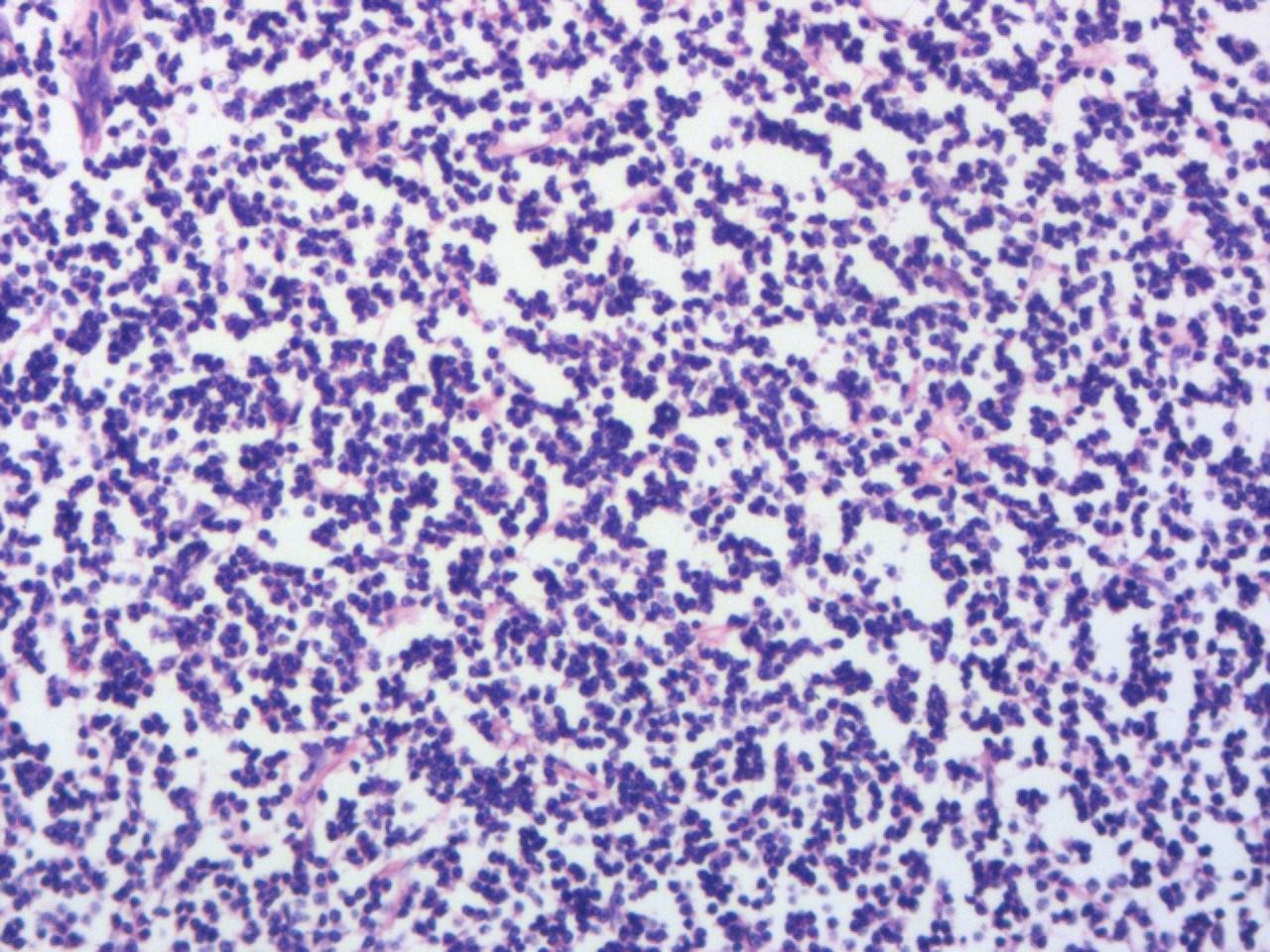
图1 大片弥漫小B细胞,肺组织正常结构破坏(HE 低倍)
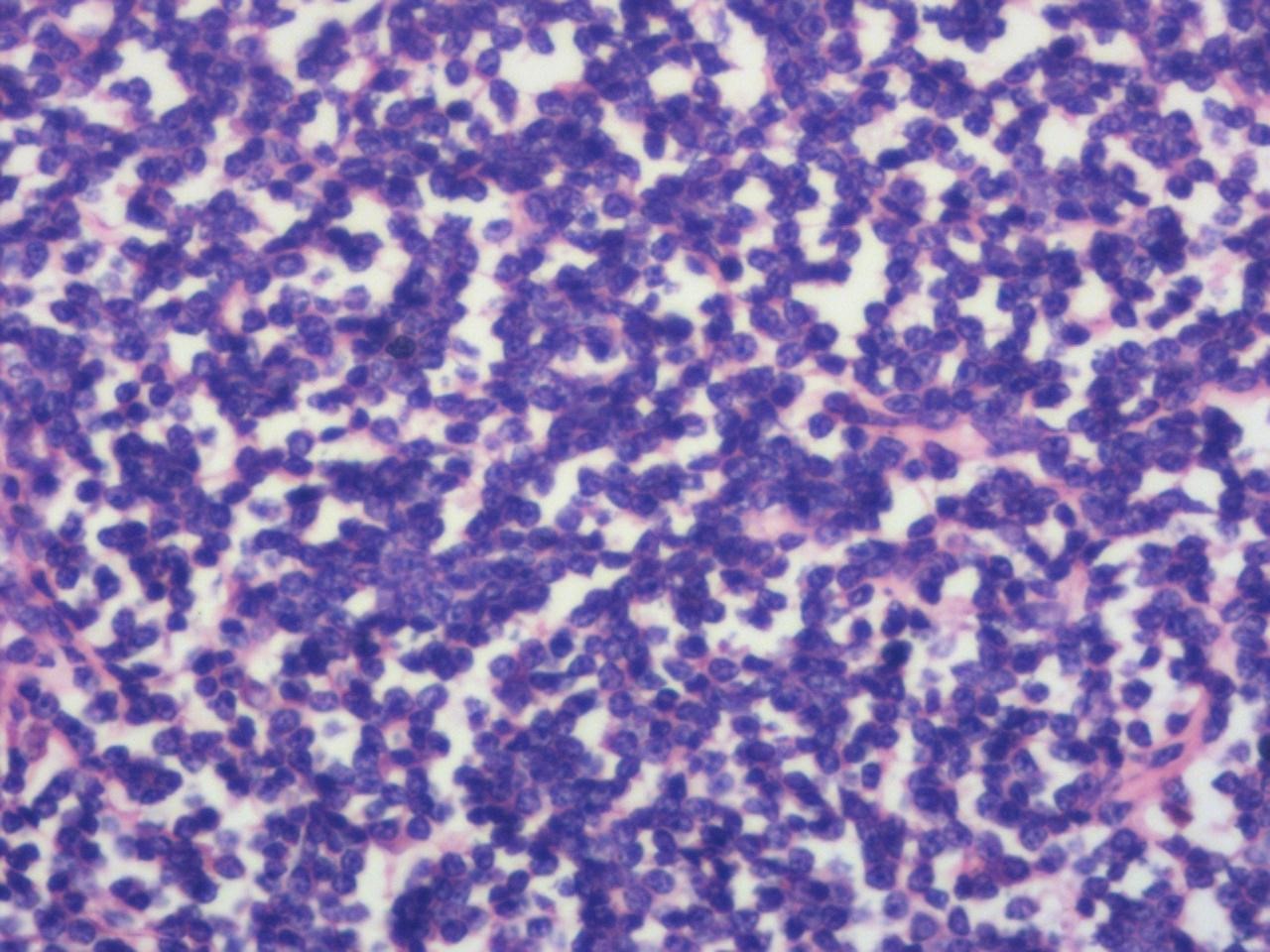
图2 大片弥漫小B细胞,肺组织正常结构破坏(HE 高倍)
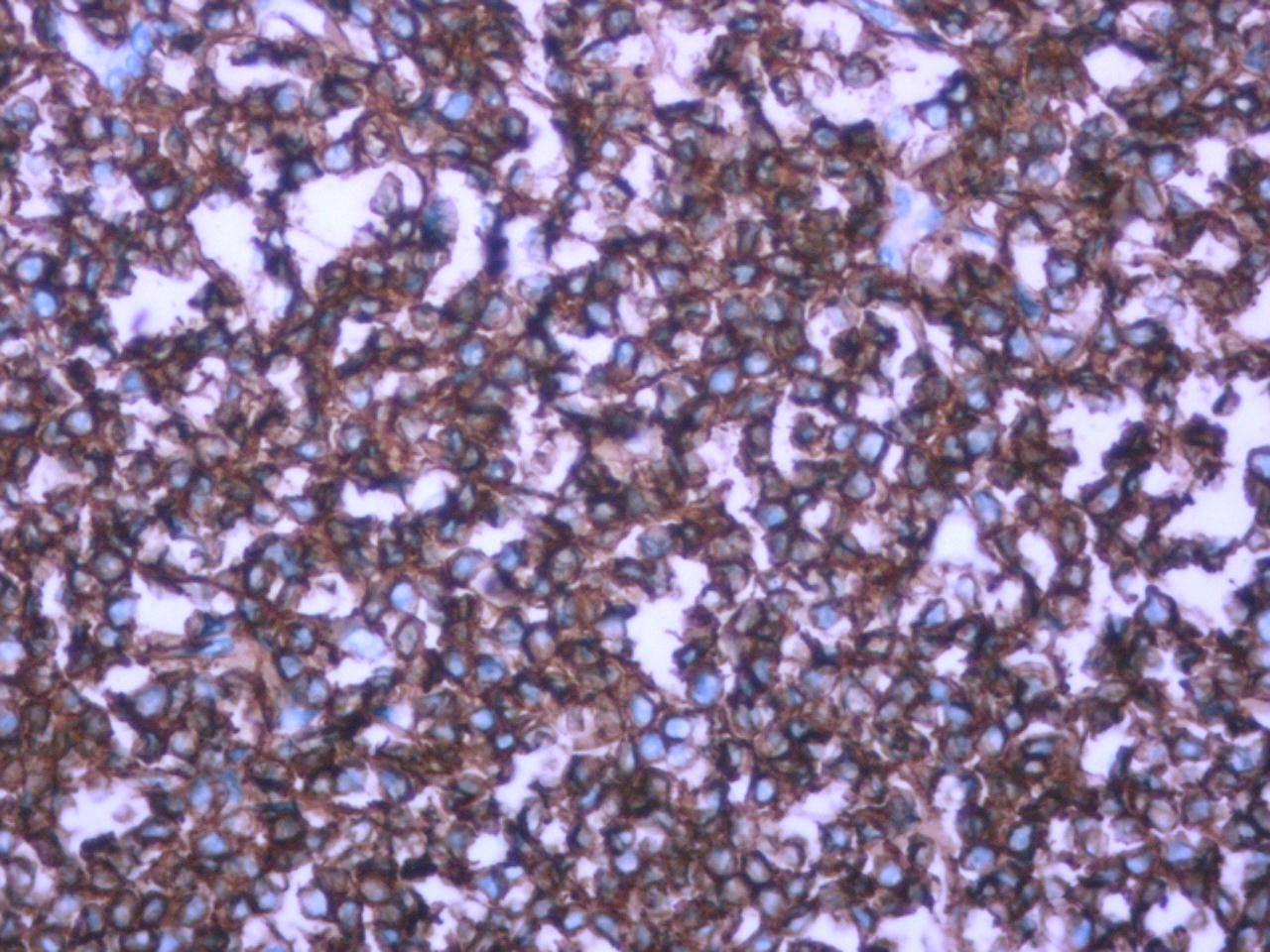
图3 肿瘤细胞CD20(+) EnVision两步法
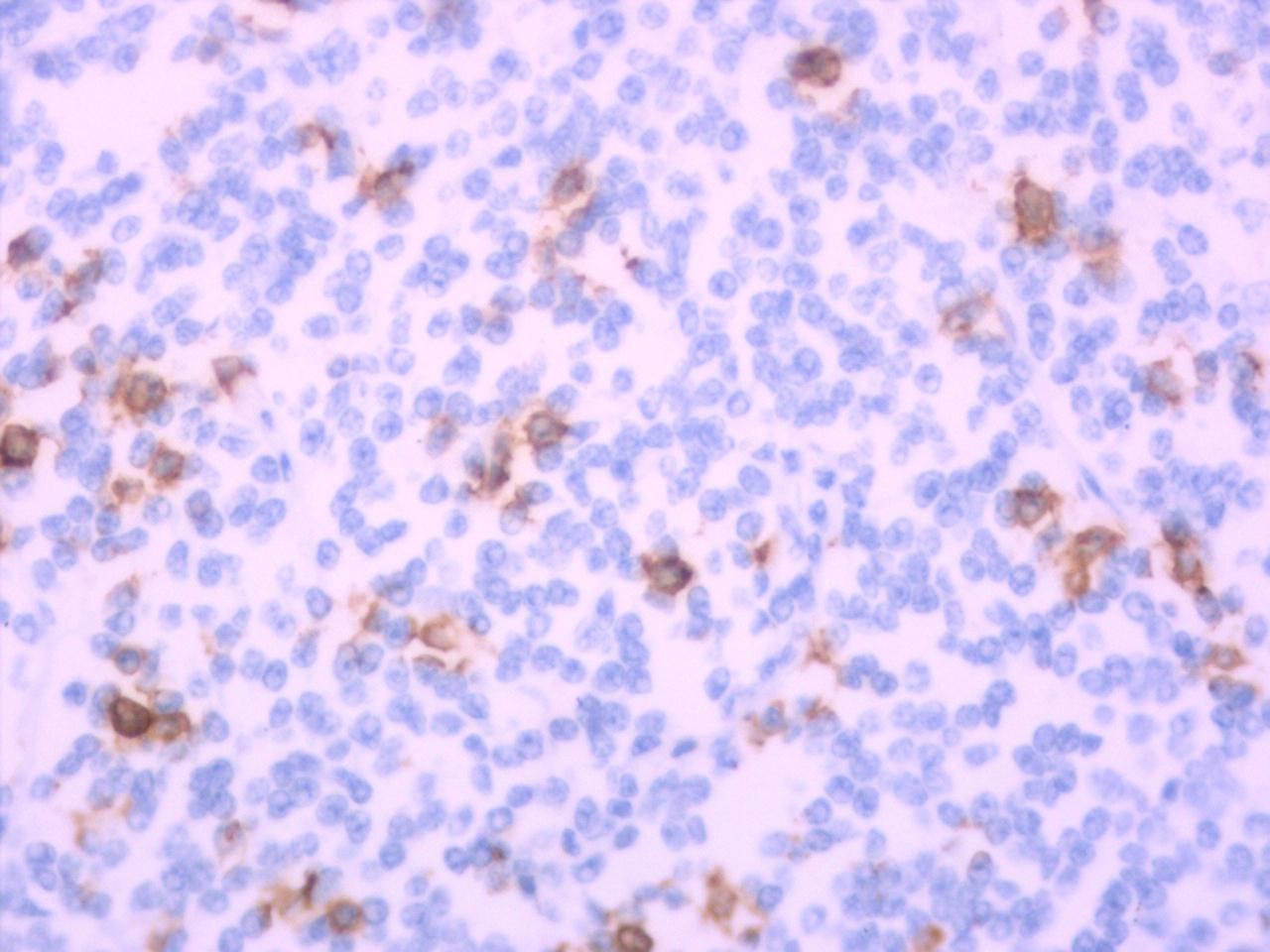
图4 肿瘤细胞CD3(-) EnVision两步法
参考文献
[1] P J Kurtin,J L Myers,H Adlakha,et al. Pathologic and clinical features of primary pulmonary extranodal marginal zone B-cell lymphoma of MALT type[J]. Am J Surg Pathol, 2001 ,25(8):997-1008.
[2] Restrepo CS, Carrillo J, Rosado de Christenson M, et al. Lymphoproliferative lung disorders: a radiologic-pathologic overview. Part II: Neoplastic disorders[J]. Semin Ultrasound CT MR, 2013 ,34(6):535-49.
[3] Pier Luigi Zinzani,Maurizio Martelli,Venerino Poletti,et al. Practice guidelines for the management of extranodal non-Hodgkin's lymphomas of adult non-immunodeficient patients. Part I: primary lung and mediastinal lymphomas. A project of the Italian Society of Hematology, the Italian Society of Experimental Hematology and the Italian Group for Bone Marrow Transplantation[J]. Haematologica ,2008,93(9):1364-71.
[4] Steven H Swerdlow,Elias Campo,Stefano A Pileri,et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms[M]. 2016 ,127(20):2375-90.
[5] Max I Schreuder,Michiel van den Brand,Konnie M Hebeda,et al. Novel developments in the pathogenesis and diagnosis of extranodal marginal zone lymphoma[J]. 2017,25;10(3-4):91-107.
[6] Fischbach W, Malfertheiner P. Helicobacter Pylori Infection[J]. Dtsch Arztebl Int, 2018,115(25):429-436.
[7] Pauline Floch,Francis Mégraud,Philippe Lehours. Helicobacter pylori Strains and Gastric MALT Lymphoma[J]. Toxins, 2017,9(4):132.
[8] Leila Hasanzadeh,Ehsanollah Ghaznavi-Rad,Safieh Soufian,et al. Expression and Antigenic Evaluation of VacA Antigenic Fragment of Helicobacter Pylori[J]. Iran J Basic Med Sci, 2013,16(7):835-40.
[9] Alexander J A Deutsch,Elisabeth Steinbauer,Nicole A Hofmann.et al. Chemokine receptors in gastric MALT lymphoma: loss of CXCR4 and upregulation of CXCR7 is associated with progression to diffuse large B-cell lymphoma[J]. Mod Pathol, 2013,26(2):182-94.
[10] Antonio Travaglino,Silvia Varricchio,Mirella Pace,et al.Borrelia burgdorferi in primary cutaneous lymphomas: a systematic review and meta-analysis[J]. J Dtsch Dermatol Ges, 2020 ,18(12):1379-1384.
[11] E Chanudet,P Adam,A G Nicholson,et al.Chlamydiae and Mycoplasma infections in pulmonary MALT lymphoma[J]. Br J Cancer, 2007,97(7):949-51.
[12] Dimitrios Kalogeropoulos,Alexandra Papoudou-Bai,Panagiotis Kanavaros,et al.Ocular adnexal marginal zone lymphoma of mucosa-associated lymphoid tissue[J]. Clin Exp Med, 2018,18(2):151-163.
[13] Francesca Sanguedolce,Magda Zanelli,Maurizio Zizzo,,et al.Primary Pulmonary B-Cell Lymphoma: A Review and Update[J]. Cancers, 2021,13(3):415.
[14] Sergio Piña-Oviedo,Annikka Weissferdt,Neda Kalhor,et al. Primary Pulmonary Lymphomas[J]. Adv Anat Pathol, 2015,22(6):355-75.
[15] Xiaohui Wu,Chunju Zhou,Ling Jin,et al. Primary pulmonary lymphoma in children [J]. Orphanet J Rare Dis, 2019,14(1):35.
[16] S Y Foo,S Phipps. Regulation of inducible BALT formation and contribution to immunity and pathology [J]. Mucosal Immunol, 2010,3(6):537-44.
[17]Swerdlow SH, Campo E, Harris NL, et al. WHO classification of tumours of haematopoietic and lymphoid tissues. 4th ed., revised[M]. Lyon: International Agency for Research on Cancer; 2017. World Health Organization Classification of Tumours.
[18]Abbondanzo SL,Rush W,Bijwaard KE,et al.Nodular lymphoid hyperplasia of the lung:a clinicopathologic study of 14 cases[J].Am J Surg Pathol,2000,24(4):587-597.
[19]Alice Blosse,Sara Peru,Michael Levy,et al.APRIL-producing eosinophils are involved in gastric MALT lymphomagenesis induced by Helicobacter sp infection[J].Sci Rep,2020,10(1):14858.
[20]Markus Raderer,Gerald Jäger,Stefan Brugger,et al.Rituximab for treatment of advanced extranodal marginal zone B cell lymphoma of the mucosa-associated lymphoid tissue lymphoma[J].Oncology,2003,65(4):306-10.
[21]C Thieblemont,F Berger,C Dumontet,et al.Mucosa-associated lymphoid tissue lymphoma is a disseminated disease in one third of 158 patients analyzed[J].Blood,2000,95(3):802-6.
[22] Ejima Y, Sasaki R, Okamoto Y, et al. Ocular adnexal mucosa-associated lymphoid tissue lymphoma treated with radiotherapy[J]. Radiother Oncol, 2006,78(1):6-9.
[23] Raderer M, Streubel B, Woehrer S, et al. High relapse rate in patients with MALT lymphoma warrants lifelong follow-up[J]. Clin Cancer Res. 2005 ,11(9):3349-52.
[24] Isaacson P, Wright DH. Malignant lymphoma of mucosa-associated lymphoid tissue. A distinctive type of B-cell lymphoma[J]. Cancer,1983,52(8):1410- 1416.

















共0条评论