1.概述
涎腺导管癌 (salivary duct carcinoma,SDC) 属于一类罕见的高度侵袭性恶性肿瘤,起源于涎腺导管上皮细胞,约占涎腺恶性肿瘤1%-3%。该肿瘤由Kleisasser等1968年首次报道,SDC可为原发性,也可继发于多形性腺瘤恶变,因其组织形态学表现与乳腺导管癌极为相似而得名。1991年WHO分类中已明确将其列为涎腺恶性肿瘤类型,2005年WHO分类SDC被定义为“类似于高级别乳腺导管癌的侵袭性腺癌”,新版(2017)WHO分类未做明显变化。SDC主要发生于大涎腺,以腮腺最为常见,肿瘤多生长迅速,易发生淋巴结转移,血行转移率高,易侵犯神经。笔者通过最近碰到SDC病例,对国内外相关文献复习,望能对其临床特征,病理形态学特征及免疫表型,临床治疗及预后情况有初步了解认识。
2.临床特征
SDC患者以中老年多见,发病年龄26-90岁,平均年龄63岁,男性好发,文献报道男女比约3:1。最常发生于腮腺(约95.3%),其次为颌下腺、舌下腺、小涎腺、上颌及喉部等部位。临床多数病例呈现为迅速生长团块,伴有面瘫或疼痛,常伴有局部淋巴结转移,1/3以上病例可发生远处转移,转移部位最常见的部位是肺(54%)、骨(46%)和淋巴结(42%),另外有脑转移者文献报道。临床预后差。
SDC影像学检查无特异性表现,CT为等或低密度影,可有沙粒样钙化,MRI病灶T1WI呈等信号,T2 WI混杂高信号,肿瘤生长较快可有坏死囊变,信号多不均匀,肿瘤恶性程度高,血供丰富,多明显均匀强化。最终确诊有赖于病理学。
3.病理学特征
SDC大体上多为实性肿块,无包膜,部分可伴有囊性变,切面白色、褐色或灰色,质地较硬,通常与周围组织分界不清。SDC形态学包括导管扩张,导管内细胞排列成实性、乳头状、罗马桥、筛状,并可有中央粉刺样坏死及小钙化灶。浸润性成分包括小管、筛状、条索、小梁及巢状结构,间质为促纤维组织增生的癌性间质,部分区域可出现鳞状分化。经常见到神经及脉管侵犯。文献描述了乳头状/微乳头状、肉瘤样、黏液性、嗜酸性粒细胞和基底样形态变异,但很少见。SDC主要为嗜酸性和颗粒状细胞质,细胞核染色质粗大,可能有突出核仁,常有明显核多形性。以往研究表明大多数SDC为原发,部分SDC也可从多形性腺瘤恶性转化而来。癌在多形性腺瘤(carcinoma expleomorphic adenoma,CXPA)中是一种侵袭性涎腺恶性肿瘤,典型高度上皮恶性肿瘤与原发性或复发性良性混合瘤,其恶性成分多为非特殊类型的腺癌及SDC。
曾有学者提出低度恶性涎腺导管癌( low grade salivary duct carcinoma,LGSDC) 概念,也被称为涎腺导管原位癌,并认为其可发展成为高度恶性SDC。其特点为肿瘤类似于乳腺导管内癌,肿瘤细胞常局限于在导管内生长,瘤细胞常向导管内突起形成筛网状及微乳头状的结构,但如今大多数这类肿瘤已被归入为低度恶性筛状囊性癌,而通常所说涎腺导管癌意指高度恶性涎腺导管癌。最新版(2017年)WHO涎腺肿瘤分类将其统一归为涎腺导管内癌,并分为低级别和高级别。
免疫表型:通常SDC广谱和低分子量CK、上皮膜抗原(EMA)呈阳性表达,CK7可强阳性,CK20偶有局灶阳性;而S-100和肌上皮标记物阴性,肿瘤细胞增殖指数Ki-67多超过25%。研究发现乳腺及大汗腺标志物GCDFP-15在80%病例阳性表达。另有研究发现GATA3在大部分病例呈阳性表达,而HER2表达在不同报道中差异很大。乳腺癌雌激素受体α(estrogen receptor α,ERα)和孕激素受体(progesterone receptor,PR)这两种标志物在SDC中表达罕见,而73%病例表达雌激素受体β亚型(estrogen receptor β,ERβ)。另外有67%-83%病例表达AR。因此AR及GATA3通常用作确认SDC诊断的有用免疫标记物。
4.鉴别诊断
①其他涎腺肿瘤如肌上皮癌、腺样囊性癌(adenoid cystic carcinoma,AdCC)、上皮-肌上皮癌(epithelial-myoepithelial carcinoma,EMCA)等可发生高级别转化(high-grade transformation,HGT),部分区域中可出现类似于SDC粉刺样坏死区域,其与SDC关键在于前者存在常规组织形态学,需广泛大体取材和仔细镜下观察。
②转移性鳞状细胞癌(squamous cell carcinoma,SCC)也需要和SDC区分,虽然唾液腺原发性SCC非常罕见,但皮肤或黏膜SCC可转移至颈内淋巴结后直接延伸或结外扩散而涉及涎腺,免疫组化标记物AR和p63区分开来。
③低级别筛状囊腺癌(low-gradecribriform cystadenocarcinoma,LGCCA)和SDC间可能存在组织形态学重叠,目前命名为涎腺导管内癌。SDC有高级别细胞学形态和侵袭性生长,免疫表型表现为AR阳性,而S-100和SOX10阴性,而LGCCA为低级别细胞学,组织学结构为导管内/原位成分,而S-100及SOX10阳性表达而AR为阴性。前者可有PLAG1或HMGA2基因重排,PIK3CA、HRAS、P53、ERBB2基因学改变,后者偶有RE基因重排。
④乳腺癌转移到唾液腺:该肿瘤罕见,组织形态学上很难鉴别,但临床多有乳腺癌病史,女性患者多见,免疫组化标记物CK7可为原发性SDC和转移性肿瘤鉴别诊断,此外ER和PR阳性表达提示为乳腺导管癌转移可能性大。
5.发病机制
SDC起源于涎腺主导管和小叶间导管,导管上皮细胞恶性转化可能是在先前存在的多形性腺瘤中。目前SDC发病原因仍不清楚,偶有报道其继发于慢性阻塞性涎腺炎,但有待大宗病例进一步研究探索。
Shimura等研究表明SDC患者基因改变发生概率最高为TP53基因,其次为PIK3CA,H-RAS,BRAF和AKT1;TP53免疫组织化学强阳性和全阴性皆与临床预后不良相关;PIK3CA/H-RAS /BRAF突变只发生在原发SDC中,而这些突变和HER2过表达/扩增相互排斥,这可提示二者存在不同基因组改变;20%的SDC病例异常表达PI3K/Akt信号通路蛋白,且p-Akt阳性提示较好的临床预后,PI3K阴性和PTEN缺失与低AR表达相关。甘丙肽受体(GALR1和GALR2)是GPCR超家族成员之一,GALR1介导细胞周期停滞,而GALR2通过p27 kip1,p57 kip2和细胞周期蛋白D1共同途径介导细胞周期停滞和细胞凋亡。Kanazawa等研究表明GALR1和GALR2在SDC组织中甲基化率显著升高,p27 kip1和p57 kip2表达与GALR1和GALR2甲基化率显著负相关。此外GALR1和/或GALR2甲基化率与OS降低显著相关。这些结果表明GALR1和GALR2可能作为SDC潜在预后因素和治疗靶点。
6.肉瘤样SDC
SDC诸多亚型如低级别型、富于黏液样变型、乳头型、侵袭性微乳头型及与嗜酸细胞型、涎腺导管内癌等均被文献报道。2000年Henley等首次描述了3例肉瘤样变异型涎腺导管(sarcomatoid salivary duct carcinoma,SSDC),是一种以同时出现癌与肉瘤样成分为特征的肿瘤。癌肉瘤特征是癌和肉瘤同时存在的双相性肿瘤,而SDC是既往所报道癌肉瘤中最常见的上皮性成分,因此伴有SDC成分的癌肉瘤可能就是SSDC。 据统计SSDC常发生于老年男性,患者年龄为34-74岁,平均年龄为58岁。发病部位以大涎腺多见,小涎腺及喉及软腭等也有文献报道。CT检查常提示有软组织肿块影及淋巴结肿大。
关于SSDC发病机制,尚无最终定论。目前免疫组化、超微结构、分子遗传学结果均示肿瘤起源于朝向多种方向分化的同一类多潜能干细胞: ①肉瘤样成分出现不同程度EMA及CK 阳性。②电镜超微结构也提示此类肿瘤是癌伴肉瘤样分化,而不是肉瘤,③分子遗传学分析表明这类肿瘤中癌与肉瘤样成分存在相同单克隆特征及杂合性缺失。因此采用SSDC命名表明了其起源方式及肉瘤样成分源自SDC分化,比癌肉瘤更为恰当。另外报道病例中有7例同时发现有多形性腺瘤成分,因此推测这些肿瘤可能源于多形性腺瘤恶变。
Williams等强调各类变异型SDC局灶显示经典大汗腺样分化特征,此特征有助于SDC诊断与鉴别诊断。SSDC组织学特征见典型筛状结构及中央粉刺样坏死,与乳腺高级别导管原位癌组织学结构极为相似。肿瘤呈实性片状、管状排列,可见导管扩张及粉刺样坏死,肿瘤细胞较大,胞质丰富嗜酸性,核呈轻度到中度异型性,呈大汗腺样分化。此类肿瘤中最常见肉瘤样成分是纤维肉瘤、平滑肌肉瘤、软骨肉瘤、骨肉瘤、多形性未分化肉瘤及横纹肌肉瘤等。免疫组化研究发现,AR阳性率为97.8%,高于普通型SDC。多数既往报道AR阴性SSDC,最后都被归类于其他类型涎腺肿瘤。文献报道还提示HER2及P53表达与SSDC临床预后差存在相关性,目前原因尚不明确。
鉴别诊断:①碰撞瘤:该肿瘤罕见,由两种独立形态学的恶性肿瘤成分混合出现,缺乏移行过渡区域,而在SSDC中常可发现移行过渡现象有助于鉴别两者。免疫组化检测SSDC中肉瘤样成分可局灶或部分呈CK阳性表达,而碰撞瘤则不会出现这种特征。②皮脂腺癌:腮腺相对更常见肿瘤,免疫表型AR与p63检测有助于区分。③转移性鳞状细胞癌。④其他涎腺恶性肿瘤高级别转化。
7.临床治疗及预后
目前公认治疗手段是手术切除,术后辅助放疗,然而传统治疗方法结果并不理想,经过手术和放疗患者在3年内复发病死率达到60%以上。而传统化疗通常被用于姑息治疗,临床效果也并不理想。一些研究发现AR和ERβ阴性SDC肿瘤更具有侵袭性,但由于SDC肿瘤罕见性,还需要大宗病例进一步深入研究探索。
HER2过表达或扩增被认为是该肿瘤不良预后因素。在对于SDC的免疫表型研究,25%-90%病例检测到了HER2过表达,并且提示不良临床预后。在免疫表型HER2表达与荧光原位杂交(fluorescence in situ hybridization,FISH)不一致也是SDC研究中值得关注的问题。一些研究者尝试使用曲妥珠单抗治疗HER2阳性SDC, HER2阳性患者或许可以尝试使用靶向治疗以提高患者生存率。
AR是核固醇激素受体,其主要配体是睾酮和α-双氢睾酮(dihydrotestosterone,DHT)。AR直接与DNA结合或与其他转录因子相互作用调节多种效应基因转录,导致肿瘤细胞生长及分化。雄激素剥夺治疗(androgen deprivation therapy,ADT)已被用于前列腺癌患者及其他恶性肿瘤。ADT可通过直接抑制AR(抗雄激素治疗)或通过下调促性腺激素释放激素(gonadotropinreleasing hormone,GnRH)受体信号输出,导致血清睾酮水平降低(化学去势)来实现。研究表明在64%-77%病例可检测到AR表达,研究尝试对AR阳性SDC患者使用ADT疗法,结果表明ADT对约50%病例有效,这还有待进一步探讨。
8.小结
SDC是恶性程度高的涎腺恶性肿瘤之一,60%-80%患者通常在5年内死亡,约33%患者发生局部复发和远处转移。目前标准治疗是完全手术切除加颈部淋巴结清扫,然后辅助放疗及化疗,新治疗手段还在探索中。此外SSDC为罕见亚型,对于其生物学行为及预后认识还有待于积累更多病例,进行更深入的研究。
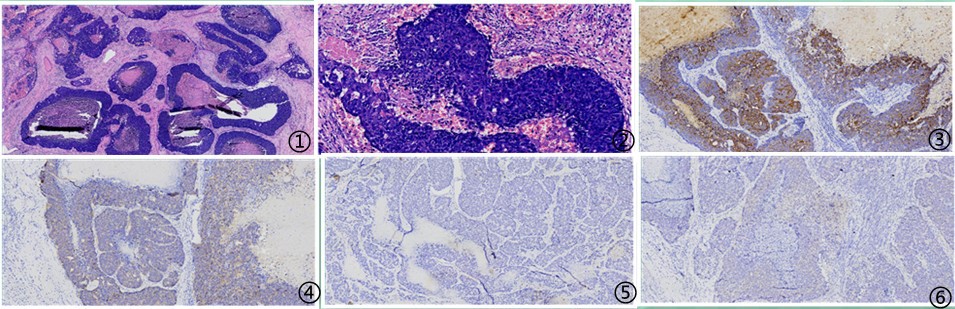
图1低倍镜下见类似乳腺导管内癌及浸润性癌成分;图2肿瘤细胞胞质丰富红染,胞核大且核仁明显,核分裂常见;图3肿瘤细胞CK弥漫强阳性;图4肿瘤细胞CD117弱阳性;图5肿瘤细胞P40阴性;图6肿瘤细胞HER2弱阳性;
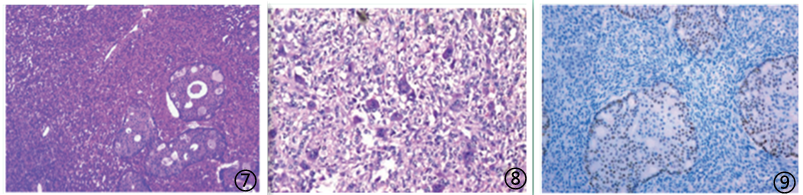
图7 肉瘤样变异型由癌和肉瘤两种成分构成;图8肉瘤样成分由间变梭形细胞、多核巨细胞、横纹肌样细胞呈弥漫性生长;图9 癌成分肿瘤细胞AR呈胞核阳性,肉瘤成分阴性;图片来自于参考文献,如有侵权,请联系删除。
主要参考文献:
[1]罗冰,徐志锋,林景兴,张丽丽,潘爱珍.涎腺导管癌的CT及MR特征研究[J].功能与分子医学影像学(电子版),2018,7(01):1385-1388.
[2]赵芳,宋琛,卫拴昱,余飞燕,肖虹.涎腺导管癌AR、HER-2和Ki-67蛋白的表达及分子分型[J].山西医科大学学报,2020,51(01):26-32.
[3]高利昆,成志强,袁静萍,阎红琳,刘琳.肉瘤样变异型涎腺导管癌临床病理观察[J].诊断病理学杂志,2016,23(12):949-952+958.
[4]史晓兰,左淑英,宋艳芳,马青松,马广贞.肉瘤样变异型涎腺导管癌1例报道[J].诊断病理学杂志,2020,27(07):508-510.
[5]Uchihashi Toshihiro,Kodama Shingo,Sugauchi Akinari,Hiraoka Shinichiro,Hirose Katsutoshi,Usami Yu,Tanaka Susumu,Kogo Mikihiko. Salivary duct carcinoma of the submandibular gland presenting a diagnostic challenge: A case report.[J]. World journal of clinical cases,2021,9(12):
[6]何时,何同梅,卢建平,许春伟,胡丹.31例涎腺导管癌的临床病理分析[J].临床与病理杂志,2019,39(07):1412-1420.
[7]Kishi Fumihisa,Matsuda Ryosuke,Nakamura Mitsutoshi,Nakagawa Ichiro,Motoyama Yasushi. A case of brain metastasis from salivary duct carcinoma of the parotid gland[J]. Interdisciplinary Neurosurgery: Advanced Techniques and Case Management,2021,25:
[8]Aarti Goswami MD,Amy J. Zhang MD,Shifteh Vahidi MD,Tetyana Mettler MD,Jimmie Stewart 3rd MD,Khalid Amin MD. Oncocytic features in salivary duct carcinoma, a potential pitfall for misdiagnosis as Warthin tumor in fine needle aspiration specimens: A cytomorphologic analysis of 14 cases[J]. Diagnostic Cytopathology,2020,48(7):
[9]江小玲.1例涎腺导管癌临床病理、免疫组化染色特点及鉴别诊断[J].齐齐哈尔医学院学报,2013,34(15):2207-2209.
[10]王梓聿,衣晓丽,袁胜利.HER2靶向药物联合化疗治疗HER2阳性涎腺导管癌1例[J].口腔颌面外科杂志,2020,30(03):191-194.
[11]汤显斌,郝颖华,姚莉,李丹,袁玲玲,申霞,王代忠,刘平,王铁延,罗森源,周美霖.浸润性微乳头状涎腺导管癌的临床病理学特征[J].中华病理学杂志,2020(05):479-480-481.















共0条评论