胰腺导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasm,IPMN) 是指一类起源于主胰管或分支胰管的分泌黏液的上皮源性肿瘤,导管上皮大多呈乳头状增生,研究认为IPMN发病率占胰腺外分泌肿瘤1%-3%,而在胰腺囊性肿瘤(pancreatic cystic neoplasm,PCN)中占20%-50%,其中约15%胰腺IPMN手术标本中伴有浸润性癌成分。笔者最近在日常工作中碰到一例,现将其临床特征、病理形态学及免疫表型结果、临床治疗及预后,结合国内外文献报道,汇报如下,望能提高临床对该肿瘤的认识。
1 病例汇报
患者老年女性,78岁,以中上腹痛为主要表现,呈持续性痛,无腰背部放射,无恶心呕吐,无腹胀腹泻,无畏寒发热,行MRI提示“梗阻性胆管扩张,考虑胆总管下段癌,肝内见多发小结节,转移可能性”,门诊以“梗阻性黄疸”收入住院。MRCP示肝内外胆管及胆总管扩张,胰头及胆总管下段区域见大小约44㎜×35㎜不规则肿块,与胰头部分界不清。术前查肿瘤标记物癌胚抗原升高,于全麻下行“胰头十二指肠切除术+胰腺颈体部分切除术+腹腔粘连松解术”,送检术后标本至病理科。
大体:胰头处可见一灰白色肿物,切面呈多囊状,囊内含透明胶冻样物,体积4cm×4cm×2cm,镜下呈多中心性,肿瘤位于扩张导管内且形成囊肿,管腔衬覆黏液柱状上皮,上皮扁平或形成乳头,囊壁或导管周围缺乏卵巢样间质,局灶乳头不规则分支,呈筛状排列,肿瘤细胞排列拥挤,极向消失,细胞核异型性明显,核分裂象可见。区域淋巴结见肿瘤组织转移。肿瘤细胞免疫组化CA19-9、CDX2、CEA、CK20、CK7、EGFR、MUC2、MUC5AC、MUC6、P53、CK19及CK8/18等呈阳性表达;肿瘤细胞PD-1、PD-L1、ER及PR等为阴性;肿瘤细胞增殖指数Ki-67约30%。
最终诊断:胰腺导管内乳头状黏液肿瘤(肠型为主),伴浸润性癌(导管腺癌)。浸润性癌分期:pT1cN1Mx。区域淋巴结可见癌组织转移。
患者术后在我院接受继续治疗,目前状态尚可。
2 讨论
2.1 流行病学
IPMN是一种少见类型的PCN,目前认为起源于胰腺导管,由可分泌黏液的高柱状上皮细胞组成,伴或不伴有小乳头状改变,构成囊性扩张的主胰管或分支胰管,直径通常大于1cm。病变中包含多种类型细胞,并伴有不同程度异型性增生,通常认为是一种癌前病变。早在1936年研究者就第一次描述了一种特殊的胰腺病变-导管内黏液性肿瘤,自1982年由Ohhashi等首次命名以来,病理学者及外科医生对IPMN进行了广泛而深入的探讨,并于1996年被WHO消化系统肿瘤收录。2004年在日本仙台召开国际专家会议并发表了关于IPMN的首次国际共识,随着越来越多IPMN患者的发现,在2012年修改发布了关于IPMN的福冈国际诊疗指南。近年来随着对该疾病的认识及影像学检查水平的提高,越来越多的IPMN患者得以在疾病早期被发现。WHO将其定义为涉及到主胰管和(或)其主要分支的一种分泌黏液的乳头状肿瘤,定义概括为①起源于主胰管或分支胰管上皮;②肉眼可见(通常直径≥1.0cm)并伴有不同程度导管扩张;③伴不同程度黏液分泌;④非浸润性导管内乳头状病变,可伴有不同程度的结构和(或)细胞异型性。
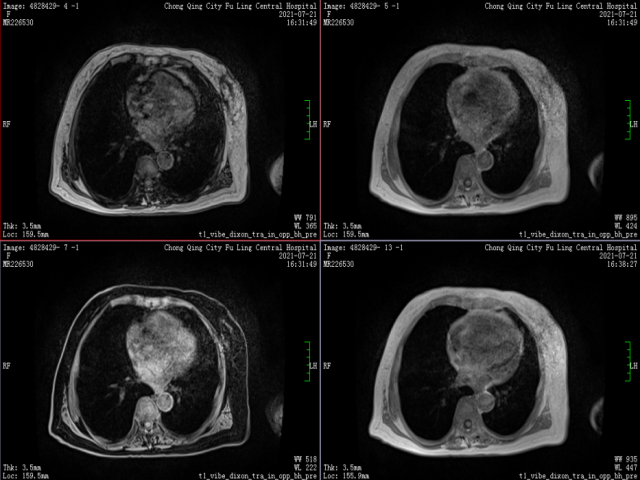
图1 影像学提示胰腺头部囊性占位;
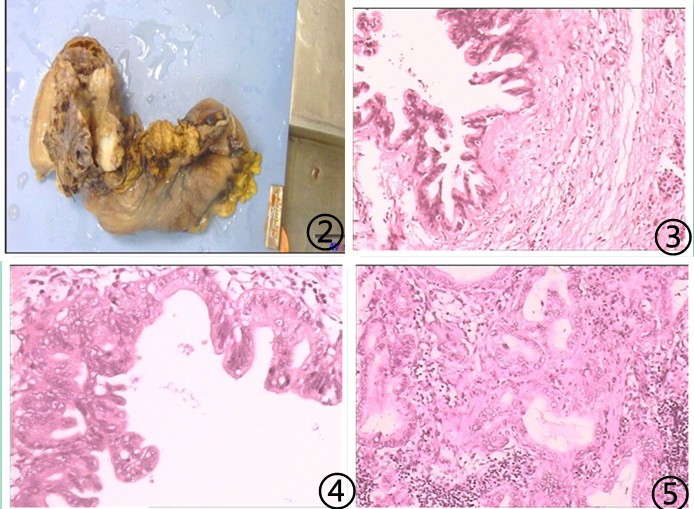
图2 肿瘤大体呈多房囊性,内含黏液;图3 囊肿腔衬覆黏液柱状上皮,上皮扁平或形成乳头,囊壁或导管周围缺乏卵巢样间质;图4 局灶肿瘤细胞排列拥挤,极向消失,细胞核异型性明显,核分裂象可见;图5 区域淋巴结可见癌组织转移;
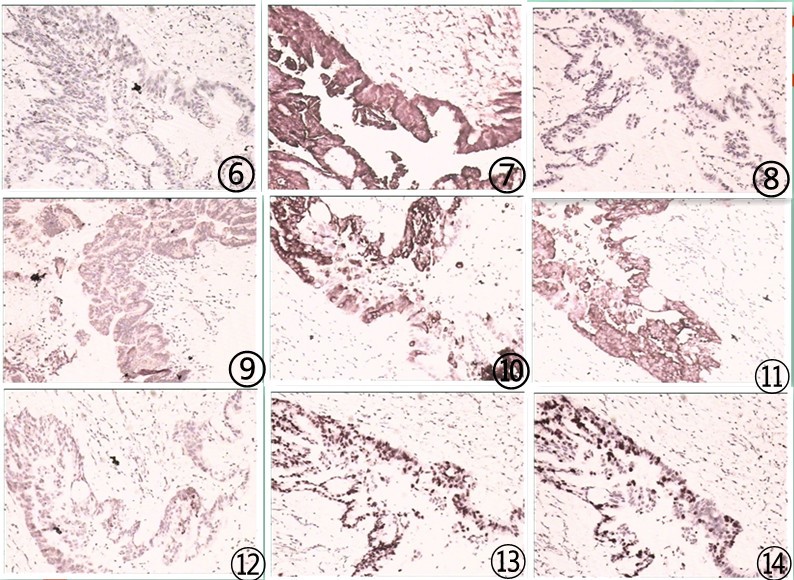
图6 肿瘤细胞CA199弱阳性;图7 肿瘤细胞CEA弥漫强阳性;图8 肿瘤细胞CK7弱阳性;图9肿瘤细胞CK19阳性;图10 肿瘤细胞MUC2弥漫强阳性;图11 肿瘤细胞MUC5AC弥漫强阳性;图12 肿瘤细胞MUC6阳性;图13 肿瘤细胞P53核阳性;图14 肿瘤细胞增殖指数Ki67约30%;
根据2006年国际共识IPMN按侵犯部位可分为主胰管型(main ductal-IPMN,MD-IPMN,16%-36%)、分支胰管型(branch ductal-IPMN,BD-IPMN,40%-65%)及混合型(mixed type IPMN,MT-IPMN,15%-23%),随着病情的进展,MD-IPMN与BD-IPMN可相互转化,最终发展为MT-IPMN。根据2005年Furukawa等提出按上皮细胞种类区将IPMN可分为胃型、肠型、胰胆管型及嗜酸型,其中胰胆管型及嗜酸型极少见;胃型常见于BD-IPMN且常伴有低级别异型增生;肠型多为MD-IPMN且常高级别异型增生;胰胆管型几乎均伴有高级别异型增生;而嗜酸型是一种特殊类型,目前新版WHO消化系统肿瘤已单独分类。根据异型增生程度又可分为低、中、高级别异形增生型(目前采用二分法)及浸润性癌。若IPMN恶变将继续侵犯胃、十二指肠、胆总管、空回肠及结肠等部位。MD-IPMN有60%-92%可能性转化为高级别异形增生型及浸润性癌,BD-IPMN则有15%-25%恶性转化几率。
一般认为IPMN多发生于老年男性,年龄52-78岁,平均年龄为67.3岁,男女比例为3:1。在我国每年明确诊断为IPMN的患者数呈逐年上升趋势,IPMN的临床表现多种多样,与肿瘤的大小、生长速度、位置等因素有关,部分患者甚至无症状。Jeurnink等报道IPMN患者临床表现为上腹部不适或疼痛、恶心呕吐、后背放射痛、消瘦、糖尿病相关症状及黄疸等。IPMN相关浸润性癌患者的发病年龄通常比不伴浸润性癌IPMN患者年轻3-5岁,患者中位年龄为65岁,男性多于女性(1.5:1),临床表现大多为腹部不适或消化道症状,出现胰腺导管腺癌症状,包括黄疸、腹痛、消瘦及心神不宁等。
2.2 影像学特征及实验室检测
目前诊断IPMN主要依靠影像学检查,包括超声、CT、MRI、磁共振胰胆管造(MRCP)、经内镜逆行性胰胆管造影(ERCP)及超声内镜(EUS),而MRCP已成为各国诊断IPMN最有效的方法,如果不能耐受MRCP,则可采用胰腺薄层CT重建。目前公认“高危因素”包括:梗阻性黄疸患者胰头部囊性占位;强化的实性成分,增强的囊壁结节≥5 mm,主胰管直径>10 mm。“令人担忧特征”包括:≥3cm囊肿;囊壁结节<5mm;囊壁增厚强化;主胰管直径5-9mm;主胰管直径突然改变,远端胰腺萎缩;区域淋巴结肿大;血清学糖类抗原19-9 (carbohydrate antigen 19-9,CA19-9)升高;囊肿生长速度>5mm/2年。
此外还可通过肿瘤标记物对IPMN进行辅助诊断,2012年福冈指南指出CA19-9及CEA升高可作为IPMN的辅助诊断指标。CA19-9是一种细胞表面糖蛋白,主要用于结肠癌、直肠癌、胃癌等胃肠道肿瘤的研究。血清CA19-9水平是唯一被证实与胰腺导管腺癌诊断及预后有直接相关性的血清学标志物。近年来血清CA19-9检测亦被纳入IPMN患者术前检查及术后随访常规。Kim等研究示IPMN相关浸润性癌患者中血清CA19-9水平显著升高。You等发现CA19-9、CA24-2、癌胚抗原(carcinoembryonic antigen,CEA)及超敏C反应蛋白与IPMN相关浸润性癌密切相关,术前行此类标志物的检测,可有效预测肿瘤的侵袭性,其中血清CA19-9和CEA升高是IPMN癌变的独立预测因素,而联合评估血清CA19-9、CA24-2和CEA水平可提高预测准确率。Hirono等多因素分析研究结果示术后血清CA19-9升高是IPMN复发转移的重要的危险因素之一。
2.3 诊断及鉴别诊断
大体肿瘤呈多房囊性,内含黏液样物。镜下肿瘤由产生黏蛋白的柱状细胞组成,病理形态学表现为乳头状增生,囊肿形成和不同程度的细胞异型性,但是缺乏黏液性囊腺瘤特征性的卵巢样间质。
IPMN相关浸润性癌的常见组织学类型包括导管腺癌和胶样癌。Katabi等认为约50%的IPMN相关浸润性癌为胶样癌,但Yamada等研究结果显示56例IPMN相关浸润性癌中导管腺癌42例,胶样癌14例。研究结果提示亚洲人群的IPMN相关浸润性癌类型以导管腺癌为主,与西方人群(以胶样癌为主)有较大差异,这一差异是否为普遍现象以及造成这一差异的原因还有待更多深入研究。此外Morales-Oyarvide等关于年轻IPMN患者研究结果显示其癌变率仅为17%,且年轻患者中47%IPMN相关浸润性癌为胶样癌。
主要鉴别诊断包括以下胰腺良恶性囊性病变:
①浆液性囊腺瘤(Serous cystadenoma,SCA):胰腺囊肿性病变16%,好发于中老年女性,胰腺体尾部多见;患者多无症状,血清肿瘤标志物无异常;影像上边界清楚,极少有恶变;囊壁衬覆单层立方或扁平上皮,胞核圆形居中,细胞异型性不明显,核分裂象罕见;免疫组化标记物Inhibin和MUC6等阳性表达。
②导管内管状乳头状肿瘤(Intraductal tubulopapillary neoplasm,ITPN):占胰腺导管内肿瘤3%,好发于中老年,男女无明显差异,半数位于胰头部;肿瘤实性结节状位于囊状扩张的主胰管内,囊内黏液少见;肿瘤呈背靠背排列形成筛状,大部区域表现为被纤维包绕的巢状,巢团内常见粉刺样坏死,缺乏胞内黏蛋白和胞外黏液;肿瘤细胞呈立方形,胞浆嗜酸性,胞核圆形或卵圆形,异型性明显,可见核分裂象;约70%病例伴浸润性癌;免疫组化标记物CK7、CK19、MUC1、MUC6阳性表达;而MUC2和MUC5AC多为阴性。
③黏液性囊性肿瘤(Mucinous cystic neoplasm,MCN):约占胰腺囊性肿瘤8%,几乎均为女性,好发于胰体尾部,患者无明显症状;大体切面呈单房或多房囊性,内壁光滑,囊内含黏液;镜下见黏液性上皮和卵巢样间质,黏液性上皮高柱状,无明显乳头结构,肿瘤细胞可出现不同程度异型和各种细胞分化;卵巢样间质是诊断MCN必要条件;约15%MCN伴浸润性癌(通常为管状腺癌);免疫组化标记物上皮细胞CK7、CK8/CK18、CK19、CEA和MUC5AC阳性表达;间质SMA、MSA、Desmin、PR、ER等可表达。
④胰腺假性囊肿(Pseudocysts):最常见的胰腺囊性病变,好发于中青年男性,通常具有胰腺炎或胰腺创伤病史;影像显示单房囊性肿物,无附壁结节;大体单发,多为单房,囊壁厚且内壁粗糙不平,囊壁缺乏衬覆上皮,周围胰腺显示急慢性胰腺炎。
⑤导管内嗜酸性乳头状肿瘤(Intraductal oncocytic papillary neoplasm,IOPN):好发于中老年,多位于胰头部,患者可表现为慢性胰腺炎症状;大体囊内可见易碎乳头或实性结节,囊内黏液少见;肿瘤呈乳头状生长,乳头局灶细胞排列略呈筛状或融合呈实性;肿瘤细胞呈立方或柱状,胞浆丰富呈嗜酸性颗粒状,胞核大而圆,核仁明显,几乎所有病例均伴有高级别异型增生,1/3伴浸润性癌;免疫组化标记物MUC1和MUC6呈阳性,而MUC2及MUC5AC阴性。
2.4 发病机制
IPMN的病因尚不清楚,从目前研究认为可能和内分泌激素水平紊乱及基因改变有关,在分子水平上已证实IPMN的发病与泛激素水平升高有关。Hong等发现原癌基因K-ras第12位密码子突变可导致IPMN,此类突变可在IPMN患者胰液中检测到。K-ras基因是一种原癌基因,其所在信号通路在调控细胞生长和恶性肿瘤转化的过程中起重要作用。约20%人类肿瘤中都存在K-ras基因突变,K-ras基因突变与胰腺癌的发病及预后密切相关。K-ras基因突变位点常位于该基因2号外显子12号和13号密码子上及3号外显子的61号密码子,其中常见突变形式为:G12C、G12R、G12S、G12V、G12D、G12A、G13V/D等。Kaino等报道IPMN患者胰腺液中检测K-ras有69%突变率。研究说明K-ras基因突变与IPMN肿瘤组织浸润及分化密切相关,通过该基因突变检测可能为预测IPMN发生侵袭及恶性程度提供重要手段。
最近Dal等证实GNAS基因第201位密码子突变在IPMN发病过程中也发挥着重要的作用,其编码的G-蛋白的水平与高级别异形增生型IPMN的发生有着密切的关系。Tsai等2013年的一项研究发现52%胃肠型IPMN患者体内存在GNAS。Amato等报道TP53和BRAF基因参与高级别异形增生型IPMN的发病过程,该现象提示可能有多种基因改变在IPMN发病过程中发挥作用,其作用的分子机制及通路值得更深入的研究。
2.5 临床治疗及预后
2012年福冈指南关于IPMN手术的主要指征包括:①存在阻塞性黄疸;②存在固化结节;③主胰管直径≥10mm。如出现上述征象患者应尽快手术。次要指征包括:①囊肿直径>3cm;②囊肿壁强化增厚;③CT平扫发现附壁结节;④主胰管直径5-9 mm;⑤伴有远端胰腺萎缩的主胰管直径突然变化;⑥影像学检查发现有淋巴结肿大;⑦出现急性胰腺炎。近年欧洲循证指南增加了绝对适应症:有细胞病理证实的实性肿块,且明确强化的黏膜结节>5mm;相对适应症则包括病灶年增长≥5mm,CA19-9>37U/ml,囊性肿块直径≥40mm,新发糖尿病及IPMN引起的急性胰腺炎。IPMN手术治疗方式通常包括胰十二指肠切除术、胰体尾切除术(又称胰远端切除术)及全胰腺切除术。而是否使用全胰腺切除在国际上仍存在争议,胰腺全部切除会导致胰岛素依赖性糖尿病,带来严重的消化问题及其他代谢并发症,因此IPMN患者应尽可能采用节段性胰腺切除术,尽量多地保留外分泌及内分泌胰腺。
影响胰腺IPMN预后的主要因素包括肿瘤大小、是否有浸润性癌成分、浸润性癌成分的组织学类型、胰腺切缘情况、淋巴结转移情况等。既往研究认为IPMN的组织学类型与其预后相关,胃型患者的预后优于肠型及嗜酸细胞型,而胆胰型患者预后最差。以往研究亦认为IPMN相关浸润性癌类型为导管腺癌患者预后差于胶样癌。
3 小结
总之IPMN是常见的胰腺囊肿性病变,目前被认为癌前病变,IPMN相关浸润性癌是一类特殊类型的胰腺恶性肿瘤,血清CA19-9水平在不同的癌变类型间存在差异,对恶变及复发有着重要的意义,IPMN相关浸润性癌的癌变类型、肿瘤发生部位及大小是否是评价患者预后情况的危险因素,还有待进一步研究与探讨。
参考文献:
[1]张晓鸽, 赵建军, 王庆宇,等. 中国人胰腺导管内乳头状粘液性肿瘤B-RAF基因(V600E)突变的研究[J]. 中国实验诊断学, 2015, v.19(12):2077-2080.
[2]于军, 王峰, 李开良,等. 胰腺导管内乳头状黏液性肿瘤患者K-ras基因的突变[J]. 中国老年学杂志, 2018, v.38(07):1612-1613.
[3]王婷, 谢吻, 林晓珠,等. 胰腺导管内乳头状黏液性肿瘤相关浸润性癌临床病理及预后因素分析[J]. 诊断学理论与实践, 2018(3).
[4]Clinical implication of serum carcinoembryonic antigen and carbohydrate antigen 19-9 for the prediction of malignancy in intraductal papillary mucinous neoplasm of pancreas[J]. Journal of Hepato-Biliary-Pancreatic Sciences, 2015, 22(9).
[5] You L , Ma L , Zhao W J , et al. Emerging role of tumor markers and biochemistry in the preoperative invasive assessment of intraductal papillary mucinous neoplasm of the pancreas[J]. Clinica chimica acta; international journal of clinical chemistry, 2016, 454:89-93.
[6]孙勤学, 陈振东, 赵亦军,等. 胰腺导管内乳头状黏液性肿瘤恶变的影像表现[J]. 临床放射学杂志, 2020, v.39;No.354(01):83-87.
[7]何闻恺. 胰腺导管内乳头状黏液性肿瘤的研究进展[J]. 交通医学, 2016, 030(006):584-588.
[8]陈兰, 张甜, 俞国冰. 胰腺浆液性囊腺瘤12例临床病理分析[J]. 现代实用医学, 2019, 031(006):778-779,封3.
[9]衡道 胰腺常见囊性病变之癌前病变及胰腺常见囊性病变之恶性肿瘤和非肿瘤性病变及胰腺常见囊性病变之良性肿瘤
















共0条评论