[导读] 编译整理:强子
乳腺乳头状肿瘤包括了诸多肿瘤类型。不过,由于该组肿瘤并不常见,因此诊断中常出现显著不一致。此外,对该组肿瘤中某些病种的认识还有一定争议,如“包裹性”乳头状癌是否为浸润性肿瘤、实性乳头状癌中浸润性成分的评估等。尽管最新的2019年版世界卫生组织乳腺肿瘤著作中对部分问题进行了讲述,但具体细节方面仍有不足。近日,美国康奈尔大学医学院(Weill Cornell Medical College)病理专家Ami、Syed及克利夫兰医学中心(Cleveland Clinic)病理专家Raza联合在《Int J Surg Pathol》杂志发表文章,对乳腺乳头状肿瘤相关争议问题进行了综述,并做了一些评论。为帮助大家更好的了解相关问题并指导临床实践,我们将该文要点编译介绍如下。
乳腺乳头状肿瘤概述
广义来说,乳头状肿瘤应定义为上皮在纤维血管轴心上的增生。上皮类型、上皮的复杂或单一、纤维血管轴心的显著程度,在不同的乳腺乳头状肿瘤中各不相同。大部分乳腺乳头状肿瘤为良性,恶性者仅占一小部分,文献中报道不足1%。
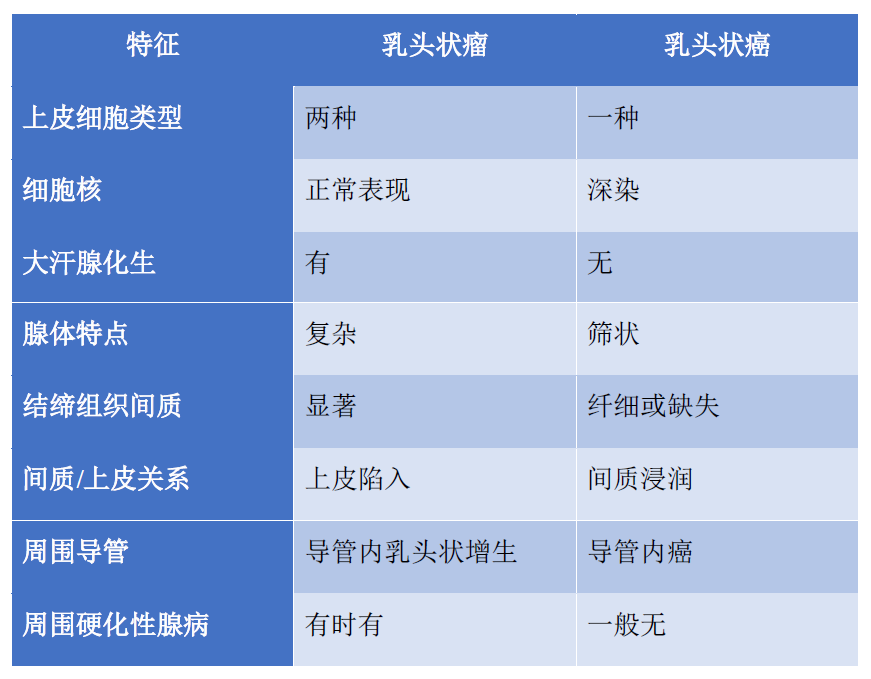
1962年,Kraus及Neubecker列出了乳腺乳头状肿瘤良恶性鉴别的关键特征。这五十余年来,尽管有小的修订,但大部分经受住了时间的考验。1970年,第二版AFIP著作中的乳腺肿瘤卷纳入了Kraus及Neubecker标准的修订版,并注明了关键之处-“不过,关键诊断中最重要的是经验,而不是简单的、条条框框式的指南”。
表1. Kraus及Neubecker提出的乳腺乳头状肿瘤良恶性鉴别关键特征
2016年,Rakha等提出,乳腺乳头状肿瘤“仍是一个有争议的病种,这不仅体现在其临床处理上,也体现在其组织学诊断特征和分类上”。这一意见的得出,是根据6个病例、各一张HE染色切片供约600名病理医师解读所得出的研究结果。该研究得出的结论是:乳腺乳头状肿瘤分为原位癌和浸润性癌的一致性很低;上述6个病例得出的诊断自乳头状瘤、至浸润性乳头状癌不一而足!这么低的诊断一致率可能有两个原因:这类肿瘤固有的复杂性,诊断标准之间的不一致。
世界卫生组织著作的目的,是对诸多器官肿瘤的分类及诊断做到标准化,当然也包括了乳腺肿瘤。其一系列连续修订的版本具有权威性,得到了全球的遵循。最新的乳腺肿瘤世界卫生组织著作是2019年版本。该版本中整合了基础科学和临床科学的相关进展,并修订了包括乳腺乳头状肿瘤在内的诸多肿瘤的诊断标准。不过,按照本文原作者意见,关于乳腺乳头状肿瘤部分仍有某些不明确之处。因此本文将对世界卫生组织乳腺肿瘤著作中描述的乳腺乳头状肿瘤相关争议进行讨论,并对某些问题进行点评。
乳头状病变的免疫组化
前述Rakha关于乳腺乳头状肿瘤的研究中,参与者仅观察HE染色切片,并无免疫组化切片供参与者阅片。世界卫生组织著作中,乳腺乳头状肿瘤强调的是病变内、病变周边有无肌上皮细胞并借此来区分乳腺乳头状肿瘤的良恶性。不过,众所周知,“常规HE染色切片中,有时可能很难确定肌上皮的有无”。因此,乳腺乳头状肿瘤中通过免疫组化来确定是否有肌上皮,是明智的选择。
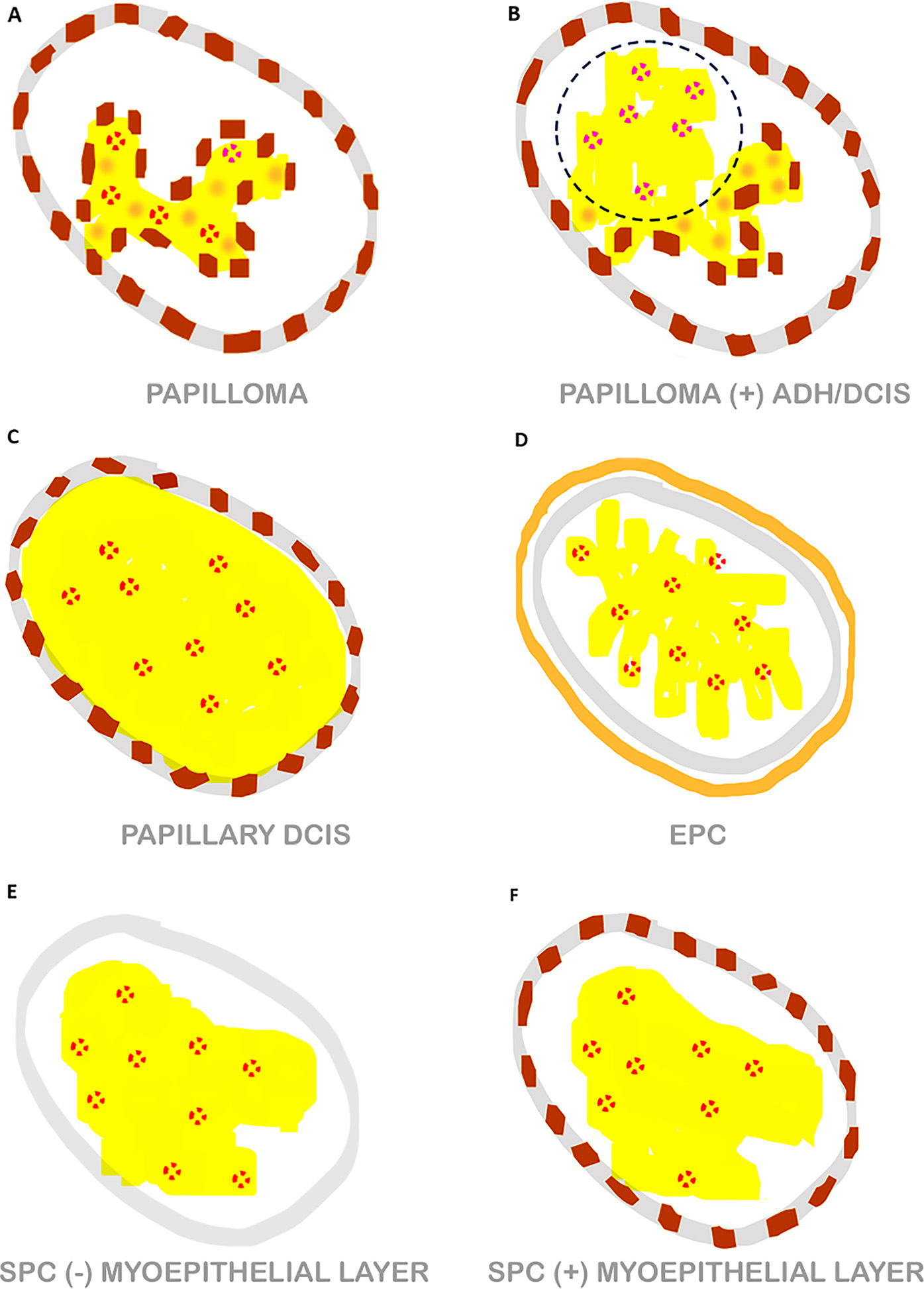
图1. 不同类型导管内乳头状肿瘤结构示意图。
(A)良性导管内乳头状瘤。形态不均的上皮细胞(体现为图中黄色、淡棕色混杂)、围绕纤维血管轴心增生。受累导管(灰色)周围及病变内有明显的肌上皮(棕色所示)。
(B)伴导管上皮非典型增生或导管原位癌的导管内乳头状瘤。导管上皮非典型增生<3mm,导管原位癌≥3mm。这种情况下,形态均一的上皮细胞(体现为图中为黄色部分),导管上皮非典型增生或导管原位癌的部分结构僵硬(虚线圆形所示),同时良性部分为形态不均的上皮细胞增生(体现为图中黄色、淡棕色混杂)。受累导管周围、未被导管上皮非典型增生或导管原位癌累及的乳头状瘤中,有肌上皮细胞存在(棕色所示);但导管上皮非典型增生或导管原位癌部分则并无肌上皮细胞。
(C)乳头状导管原位癌。形态均一的细胞(体现为图中黄色部分)呈乳头状增生。受累导管周边有显著肌上皮(棕色所示),而肿瘤性病变内并无肌上皮细胞。
(D)包裹性(囊内)乳头状癌。形态均一的细胞在囊内呈形态均一的增生,受累导管周围无肌上皮。肿瘤性病变内也并无肌上皮细胞。周边一般有厚度不一的纤维性“包膜”(棕黄色)。
(E、F)实性乳头状癌。病变中,形态均一的细胞(体现为图中黄色部分)呈实性增生,免疫组化中肌上皮标记可呈两种染色情况,但这两种情况下,肿瘤内都没有肌上皮。实性乳头状癌中,较常见的是受累导管(灰色)周围无肌上皮(E);少见情况下,病变周边可见肌上皮(F中棕色所示)。
乳腺乳头状肿瘤中,免疫组化实际应用中需注意如下事项:
(1) p63是肌上皮细胞的可靠标记;不过细胞核为高级别的乳头状癌(偶见于细胞核为低级别的乳头状癌)可能会表达p63;
(2) 乳腺乳头状肿瘤中的上皮细胞有鳞状分化的时候,或乳腺乳头状肿瘤中伴低级别腺鳞癌的时候,免疫组化p53阳性也可能会误导相关病变的解读;
(3) 良性大汗腺病变(包括乳头状病变)内及周边小部分区域可能会莫名其妙的缺失肌上皮,不能因此而将其判定为恶性;
(4) 伴腺体的硬化性陷入时,乳腺乳头状肿瘤的肌上皮免疫组化可能并不可靠。这样的病例中,应进行多项肌上皮免疫组化检测(包括胞质阳性及细胞核阳性的指标);因为对具体病例来说,不同肌上皮免疫组化标记的着色情况可能并不一致;
(5) 乳腺乳头状肿瘤中,免疫组化高分子量CK(如CK5/6)在上皮细胞为阴性,则倾向于非典型、或恶性乳头状肿瘤;不过,一定要注意:乳腺乳头状肿瘤中的上皮细胞具有大汗腺样胞质、或者形态学呈立方状、或者细胞核呈高级别的时候,可能不会象非乳头状肿瘤中CK5/6预想的免疫组化表达结果。正常和肿瘤性大汗腺上皮、立方状上皮中的CK5/6免疫组化一般为阴性,细胞核为高级别的细胞可能CK5/6阳性;
(6) 乳腺乳头状肿瘤中,免疫组化ER呈弥漫、强阳性则支持恶性诊断;但,高级别乳头状癌和大汗腺细胞构成的导管内乳头状瘤可能会ER阴性。
未完待续
乳头状乳腺肿瘤:对世卫组织 2019 年标准和分类的持续争议和评论
参考文献
Patel A, Hoda RS, Hoda SA. Papillary Breast Tumors: Continuing Controversies and Commentary on WHO's 2019 Criteria and Classification. Int J Surg Pathol. 2021;10668969211035843.
doi:10.1177/10668969211035843















共0条评论