1 概述
浆母细胞淋巴瘤(plasmablastic lymphoma,PBL)是一类罕见高度侵袭性B细胞淋巴瘤,在非霍奇金淋巴瘤中所占比例不足3.0%,占HIV相关非霍奇金淋巴瘤比例为2.6-8.0%。1997年Delecluse等人首次报道了16例口腔PBL,其中15例患者HIV检测结果阳性,在组织形态学上与弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)极其相似,但表现浆细胞免疫表型,呈现侵袭性临床进程和不良预后过程。2001年世界卫生组织(World Health Organization,WHO)淋巴造血系统肿瘤分类中将其归到HIV感染相关淋巴瘤中,2008年WHO淋巴造血系统肿瘤分类将PBL从DLBCL中单独分列出,将其归类为人类免疫缺陷综合征相关淋巴瘤(acquired immundeficiency syndromerelated lymphoma,ARL),2016年WHO淋巴造血系统肿瘤分类则继续将PBL作为大B细胞淋巴瘤独立亚型,并认为与HIV和EB病毒感染有关,或与其他免疫缺陷状态相关,如长期服用免疫抑制剂、实体器官移植术后或老年相关免疫衰退症等,其中移植后免疫异常者占50%。
2 临床特征
PBL最常受累部位为口腔及胃肠道,其次为淋巴结和皮肤等,其他部位罕见文献报道。PBL最初于艾滋病患者中发现,目前全世界范围内HIV阴性病例不断涌现,但其主要发病人群仍为AIDS患者,其中HIV阳性者占69% ,而HIV阴性则占31%。绝大多数文献报道的中国病例为HIV阴性,其中HIV阴性PBL患者发病年龄为2-86岁,平均年龄为58.9岁,显示较高年龄(半数以上患者大于60岁)和男性(男女比例为2.29∶1)发病倾向性。目前为止病例数最多的单中心病例研究,国内为21例,国外为61例。
3 发病机制
PBL的发病机制仍然不甚清楚,公认致病因素包括HIV感染、EBV感染和MYC基因重排。感染HIV人群是罹患各种类型肿瘤的高危因素,尤其是非霍奇金淋巴瘤,研究认为患者淋巴瘤生成与免疫系统缺陷、基因突变和细胞因子等因素相关,但具体机制尚不甚清楚,尚需大样本病例的深入研究报道。
有研究发现65%以上PBL患者EB病毒检测阳性,其中HIV相关PBL病例中74%病例为EB病毒检测阳性,而在HIV阴性PBL病例所占比例为54%,该现象提示EB病毒可能是一个潜在的危险因素。EB病毒作为最早发现与人类肿瘤相关病毒,可在B淋巴细胞中长期潜伏感染,在机体免疫力下降时激活且大量增殖。EB病毒抗原能阻止B细胞的多种细胞调亡通路,如FAS介导的细胞凋亡通路和BCR介导的细胞凋亡通路,从而导致肿瘤细胞的快速增殖;也可因CD4阳性T细胞持续性减少,破坏CD8阳性细胞毒性T细胞介导的抗病毒免疫应答作用,从而不能有效控制EB病毒感染的B细胞增生,在此过程中单克隆增生最终形成PBL发生。
MYC基因重排是PBL中首个被发现的细胞遗传学异常,MYC异常可见于50%以上PBL患者,其中IgH基因是MYC基因重排主要伴侣伙伴。MYC致癌基因与细胞增殖和细胞分化过程相关,从而可促进细胞凋亡,MYC基因易位可阻止PBL的细胞凋亡过程,但具体机制尚未明确。目前有研究报道无EB病毒感染患者往往也无HIV感染,MYC基因重排与PBL的浆母细胞形态及侵袭性临床过程有关,在PBL的发病中起着重要的作用,其具体机制尚需进一步研究。
也有研究表明PBL的发病机制可能与染色体异常或某些信号通路密切相关,Valera等研究认为Bcl-2、Bcl-6或PAX5等多个基因扩增与PBL有关,主要由t(8;14)(q24;q32)染色体异常导致。另外seegmiller等研究发现Notch1在淋巴祖细胞发育过程中T系及B系选择过程中是重要的调节信号,Notchl蛋白通过活化mTOR信号通路,从而抑制B细胞特殊转录因子表型的表达,可抑制B系淋巴细胞表达,则导致肿瘤恶性转化,因此认为PBL发生还可能与Notch1信号途径的活化有关。
此外PBL与人类疱疹病毒8型(HHV-8)的相关性还有待商榷。早期文献研究多认为该病毒感染与PBL发病有关,随着目前研究的深入,近年来文献报道很少提及。
4 病理形态学
巨检主要累及淋巴结以外部位,尤其是在黏膜组织,表现为边界不清且呈侵袭性生长肿物,少数病例表现为局部淋巴结肿大。
PBL组织形态学上相似但均具有浆细胞免疫表型。镜下特点为弥漫浸润的中等偏大肿瘤样淋巴细胞弥漫性浸润生长,肿瘤细胞圆形或椭圆形,呈免疫母细胞样或浆母细胞样,胞浆较为丰富,偶见核周空晕,核分裂象易见;可见凋亡小体及由巨噬细胞浸润而形成的星空现象,背景浸润细胞中包含小的成熟的淋巴细胞。
免疫表型肿瘤细胞不表达CD20,也有文献报道10%病例呈灶阳或弱阳性,约半数可表达CD79a,弥漫强表达CD38、CD138、Mum-1等标记物,EMA、CD45和CD79等呈不同程度阳性表达,且T细胞标记物如CD3和CD5在某些病例中也可呈阳性表达。此外CD10阳性率为30%,CD10表达应视为发生淋巴瘤时的异常表达。肿瘤细胞增殖指数Ki-67非常高(>60%),EBER原位杂交60%-75%病例呈阳性,既往报道HIV阳性PBL患者EBER阳性率约为75%,移植后为67%,其余者为50%。
Kane等于2009年提出诊断口腔黏膜PBL最低标准:弥漫增生大细胞具有高核浆比,中等量双嗜性胞浆,胞核圆形和明显中位核仁,核分裂象活跃,可见凋亡小体,缺乏肿瘤性浆细胞。免疫表型CD20阴性,LCA弱阳性或阴性,CD138/VS38c呈弥漫阳性表达,有免疫球蛋白轻链限制性表达,Ki-67高表达(>60%)。PBL被证实存在两种主要子类型,一种是口腔黏膜型,常侵袭口腔黏膜,由免疫母细胞构成,组织形态学呈一致性表现,无或有极轻微浆母细胞分化;另一种是有浆母细胞分化PBL,主要由大量免疫母细胞和浆母细胞构成,表现为各种浆母细胞分化及单克隆轻链表达。两种病理类型临床特点、流行病学和免疫表型均不尽相同。目前研究认为两者是不同的临床病理学实体型:位于口腔病例HIV和EB病毒感染率高,临床预后较好;而位于口腔外病例HIV和EB病毒感染率低,临床预后较差。
5 鉴别诊断
PBL需与多种肿瘤鉴别诊断。其中非淋巴造血系统肿瘤包括低分化癌、恶性黑色素瘤、横纹肌肉瘤等,根据组织形态学及免疫表型容易鉴别诊断。需鉴别淋巴造血系统肿瘤包括浆细胞瘤、DLBCL、Burkitt淋巴瘤、间变性大细胞淋巴瘤(ALCL)、髓系肉瘤、原发性渗出性淋巴瘤及其他伴有浆细胞/浆母细胞分化淋巴瘤等,根据肿瘤细胞形态学特征及弥漫强表达CD38、CD138、Mum-1等标记物,Ki-67指数高特点,与上述大多数淋巴造血系统肿瘤容易鉴别诊断。
①浆细胞骨髓瘤:鉴别诊断最困难,两者均好发老年人,肿瘤细胞均有浆细胞样特征,免疫表型亦相似,然而治疗方案却迥然不同,临床症状及预后方面的差异是鉴别主要依据,因此两者鉴别诊断需要综合判断:如果患者出现溶骨性破坏、高钙血症、骨髓受累、肾功能障碍、无免疫缺陷相关因素、血清免疫球蛋白升高等症状,则倾向于诊断间变性/浆母细胞性浆细胞瘤;如果肿瘤位于骨外、有免疫缺陷、EB病毒感染、Ki-67指数非常高倾向于诊断PBL,但目前Ki-67阳性指标尚缺乏统一标准。如果实在难以确诊时可做“介于PBL和间变性浆细胞瘤之间的浆母细胞肿瘤”诊断性描述。
②Burkitt淋巴瘤:PBL常见于HIV患者,B细胞标记CD20为阴性,而浆细胞标记呈阳性表达,肿瘤细胞高增殖指数且EBER多为阳性。而Burkitt淋巴瘤尽管增殖指数高并常伴有EBER阳性表达,但患者为儿童和青少年,如果形态学表现为星空现象、细胞形态学单一、细胞紧密连接成片状镶嵌样排列和高细胞增殖指数则提示可能为Burkitt淋巴瘤,该肿瘤细胞中等大小,不常有浆细胞分化,其本质为生发中心起源的B细胞淋巴瘤,免疫表型为CD45、CDl9、CD20、bcl-6阳性表达,而CD138和VS38c阴性,肿瘤细胞Ki-67增殖指数近100%。。
③DLBCL:该肿瘤较为常见,可伴有浆细胞分化,但B细胞标记CD20常呈弥漫强阳性表达。肿瘤细胞无明显嗜碱性胞质,尽管少量病例可接近PBL高增殖指数,但大体上其增殖指数较PBL为低,鲜有肿瘤细胞同时表达CD20和CD38或CD138的情况。
④ALCL:无论ALK阴性还是ALK阳性者,形态学均表现为胞质丰富核多形性的淋巴样细胞,肿瘤细胞CD3和EMA阳性表达,且T细胞标记物阳性,而EBV检测为阴性。
6 临床治疗及预后
HIV阴性PBL标准化治疗方案尚未建立,仍没有统一的临床治疗标准,对其治疗经验主要来源于全世界范围内的病例报道。手术切除+化疗仍是主要治疗方案,联合化疗常作为初始治疗尝试,CHOP(环磷酰胺、多柔比星、长春新碱、强的松)或CHOP类似方案是PBL常用的化疗方案,临床总缓解率约为70%。硼替佐米是一种蛋白酶体抑制剂,无论联合或不联合化疗,对HIV阴性PBL患者均有着不错的临床效果,可能克服化疗抵抗并改善临床预后。已有文献报道含硼替佐米的方案用于治疗HIV阴性PBL并在复发性/难治性或未经治疗患者中取得了良好结果。与化疗或放疗相比,自体造血干细胞移植(autologous hemopoietic stem cell transplantation,ASCT)表现出可行性,并且是作为一线治疗缓解患者的巩固治疗手段,尤其是具有高危因素的患者,因此有可能成为提高患者生存率最有效方法之一。HIV阴性PBL中异基因移植目前尚未见文献报道。
PBL自然病程极短,临床进展较快,高度侵袭性且临床预后极差。HIV阳性者中位OS为3个月,HIV阴性者为4个月。据文献报道,高龄(患者年龄大于 60 岁)、临床分期为Ⅲ期或Ⅳ期、患者ECOG体能评分>2、骨髓浸润或淋巴结累及、MYC基因重排或扩增者、未接受化疗治疗或化疗未能达到CR者、免疫抑制均是临床预后不良的因素。此外EBER阴性者及肿瘤细胞增殖指数Ki67高于80%者预后差。95%以上PBL患者在确诊时已是临床晚期,且研究发现口腔外更易发生播散和远处转移,故常在不到6个月内死亡。
7小结
综上所述PBL是一种少见具有独特免疫表型的淋巴瘤类型,其生物学和分子学发病机制仍不清楚,好发于HIV阳性患者口腔及消化道等部位,以硼替佐米为基础的化疗方案及GEMOX是其不错治疗方案。PBL具有高度侵袭性生物学行为,因其临床特征不够典型,所以要结合临床特征、免疫表型和分子生物学特征等综合分析。
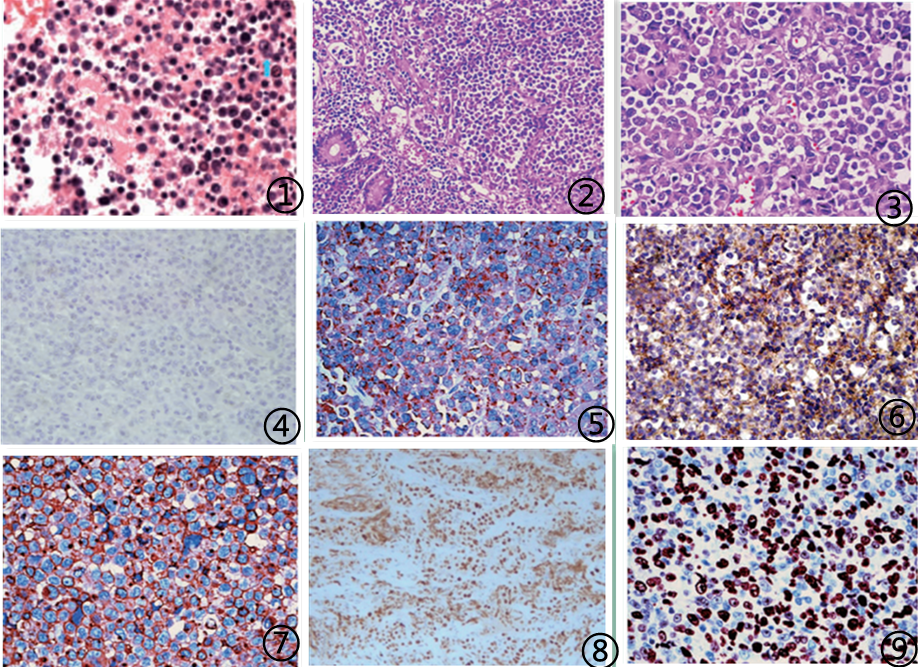
图1胸腔积液沉渣包埋中肿瘤细胞丰富,可见单核及双核浆母细胞;图2低倍镜下浆细胞样分化肿瘤细胞弥漫浸润;图3高倍镜下肿瘤细胞胞质丰富,嗜碱性,胞核形态不规则,核偏位,核仁大而明显;图4肿瘤细胞CD20(-),EnVision 法;图5肿瘤细胞CD79a(++),EnVision 法;图6肿瘤细胞CD38(++),EnVision 法;图7肿瘤细胞CD10(++),EnVision 法;图8肿瘤细胞MYC(+),EnVision 法;图9肿瘤细胞Ki-67阳性指数约80%,EnVision 法;图片来自于参考文献11,8,6,13,如有侵权,请联系删除。
参考文献:
[1]Delecluse HJ,Anagnostopoulos I, Dallenbach F.et al.Plasmablastic Lymphomas of the Oral Cavity: A New Entity Associated With the Human Immunodeficiency Virus Infection[J].blood,1997,89(4):1413-1420.
[2]范舟,李基炜,易平勇,等. 5例浆母细胞淋巴瘤临床病例分析和文献回顾[J]. 肿瘤药学, 2018, v.8(01):130-134.
[3]Swerdlow, Steven, H,et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms[J]. Blood: The Journal of the American Society of Hematology,2016,127(20).
[4]文禄, 郭英, 谢云霞,等. 人类免疫缺陷病毒阴性的阴道残端浆母细胞淋巴瘤一例并文献复习[J]. 现代生物医学进展, 2014, 14(020):3860-3862.
[5]李芬,丁文双,左卓,等.浆母细胞性淋巴瘤11例临床病理分析及文献复习[J]. 中华病理学杂志,2016.
[6]范国庆, 刘一雄, 文璐,等. 浆母细胞淋巴瘤的临床病理特征的研究[J]. 现代肿瘤医学, 2014, 22(11):2690-2694.
[7]贾秀琴, 李玮, 李德刚,等. 椎管内浆母细胞淋巴瘤1例并文献复习[J]. 现代肿瘤医学, 2017, 25(013):2129-2131.
[8]王宏伟, 赵敏, 陆云龙,等. 小肠浆母细胞淋巴瘤临床病理观察[J]. 诊断病理学杂志, 2013(06):349-352.
[9]冯娟, 徐莉, 董红娟,等. 浆母细胞淋巴瘤临床病理特征及预后分析[J]. 中国实验血液学杂志, 2018, 26(05):106-110.
[10]孟芝兰, 师杰, 赵雨,等. 胸腔积液细胞病理学诊断浆母细胞淋巴瘤的探讨[J]. 诊断病理学杂志, 2012(03):179-182.
[11]魏建国, 袁晓露, 刘文英,等. 胃肠道浆母细胞型淋巴瘤临床病理特点分析[J]. 医学研究杂志, 2015, 44(001):80-83.
[12]陈易华, 易海, 王超,等. 胃浆母细胞淋巴瘤2例临床病理观察[J]. 诊断病理学杂志, 2020, v.27(06):55-57.
[13]陈晨, 周宇红, 顾思楠,等. 11例HIV阴性浆母细胞淋巴瘤(PBL)的临床特征分析[J]. 复旦学报(医学版), 2019(6).














共0条评论