[导读] 编译整理:强子
分子检测已慢慢“渗入”了不同组织、器官的病理诊断,且为病理诊断带来了显著变化。比如,不同部位、不同类型的肿瘤可能具有相同的分子遗传学异常。同时,分子检测对于某些形态学并不常见肿瘤的进一步研究,提供了更多信息。近日,美国病理医师Liu Zhonghua在《Head Neck Pathol》杂志发表文章,报道了一例INI缺失型甲状腺癌病例的详尽病理特征及预后信息。为帮助大家更好的了解这方面问题,我们将该文要点编译介绍如下。
病例展示
患者女性,67岁,颈部异物感、疲倦就诊于其他单位。体检可见右侧甲状腺增大,超声证实右侧甲状腺有一5.2cm血供丰富肿物。超声引导下细针穿刺,考虑为“可疑Hurthle细胞肿瘤”。甲状腺全切术中发现病变有广泛甲状腺外受累、右侧颈动脉鞘受累。右侧颈部外侧淋巴结清扫,26枚淋巴结有2枚转移。术后病理考虑为肉瘤,后经其他单位会诊考虑为甲状腺间变性癌。术后PET-CT检查,右侧锁骨上可见一11mm高代谢淋巴结。碘131扫描阴性。术后8个月时随访PET-CT,仅见上述颈部病变及纵隔淋巴结病变,未见其他远处转移。
病理资料复习
甲状腺全切标本,大体检查可见一6*5*4cm不规则、无包膜肿物,境界清楚,累及甲状腺右叶及峡部。切面灰白,有黏液样表现,局灶可见出血、坏死。可见腺外受累,手术切缘多处可见受累。
此前细针穿刺细胞学涂片中,肿瘤细胞体积大,呈黏附性差的簇状;瘤细胞的细胞核大、居中或偏位,有显著核仁,胞质丰富、嗜酸性,背景为黏液样。与组织学表现相似,部分细胞呈浆细胞样或横纹肌样形态。
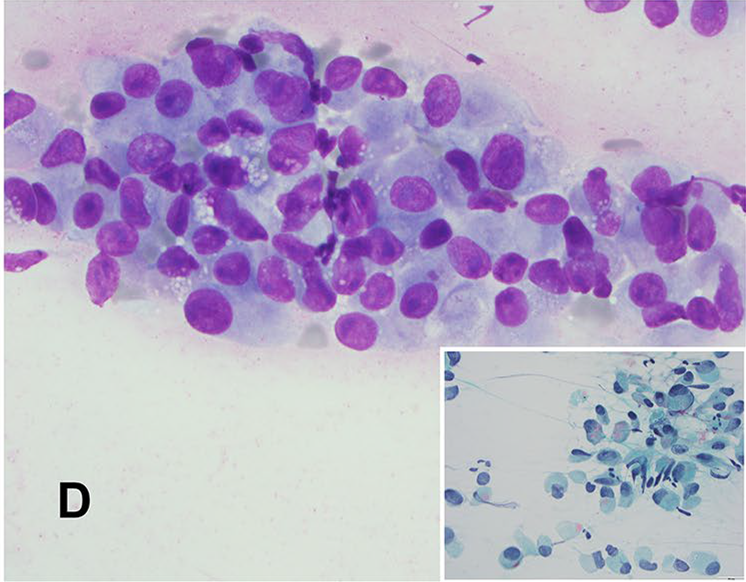
图1. 细针穿刺涂片检查,肿瘤细胞体积大,呈黏附性差的簇状,部分瘤细胞呈上皮样/横纹肌样形态。
组织学上,肿瘤细胞呈结节状或片状,有显著实性结构。可见广泛腺外播散、脉管受累、甲状腺旁淋巴结转移。具有广泛纤维化、局灶坏死及出血,部分间质黏液样变。核分裂罕见。瘤细胞以上皮样为主,部分为横纹肌样/浆细胞样。上皮巢内局灶可见中性粒细胞。未见基底样形态或鳞状分化表现。广泛取材,未见分化型甲状腺癌成分。
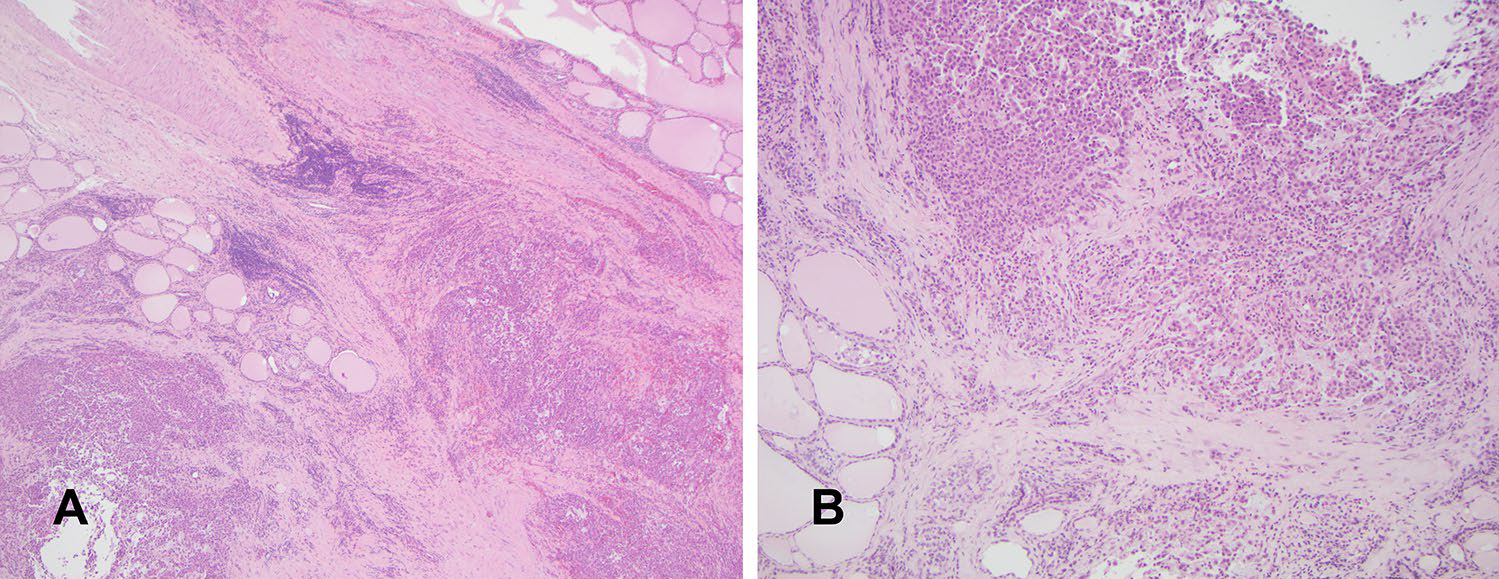
图2. 肿瘤结节伴广泛腺外播散(左),并以实性生长为主(右);局灶间质有黏液样变,且可见出血、坏死灶(未示)。
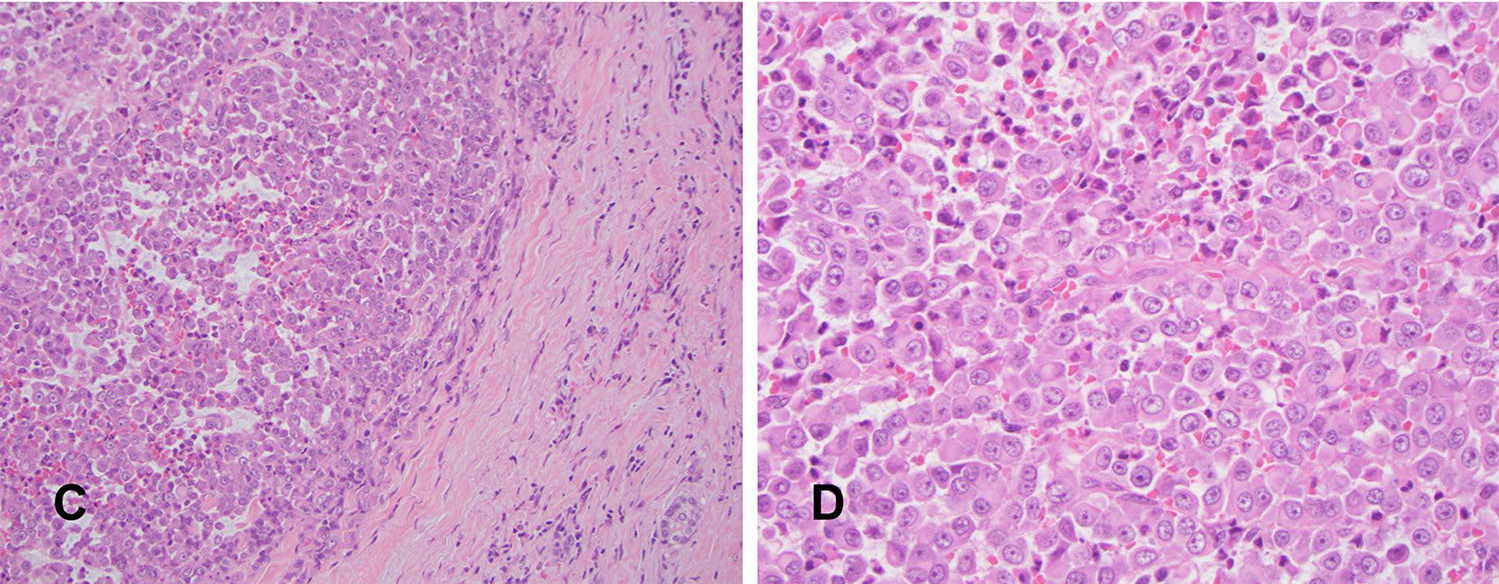
图3. 肿瘤细胞大部分为形态均一的上皮样,细胞核圆形,染色质散在,有显著的居中核仁,胞质丰富、嗜酸性。极少数肿瘤细胞呈横纹肌样形态,未见基底样成分。
淋巴结转移灶细胞形态与原发灶相似,也是表现为形态相对单一的上皮样细胞,但浆细胞样/横纹肌样细胞形态更为多见,间质黏液样变更为显著。
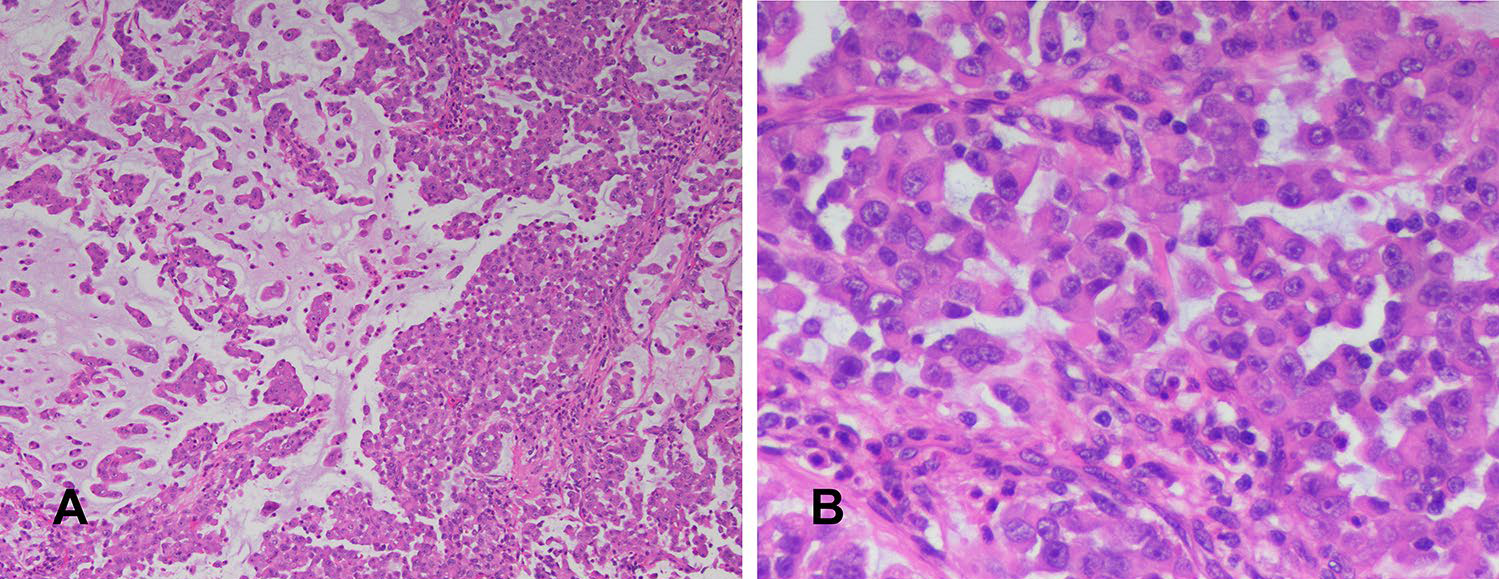
图4. 淋巴结转移灶与原发灶形态有所不同:间质显著黏液样变,使得肿瘤形成假乳头状、腺泡状,但并无真正腺性分化(左);细胞以上皮样形态为主,但横纹肌样形态的细胞比原发灶更多了(右)。
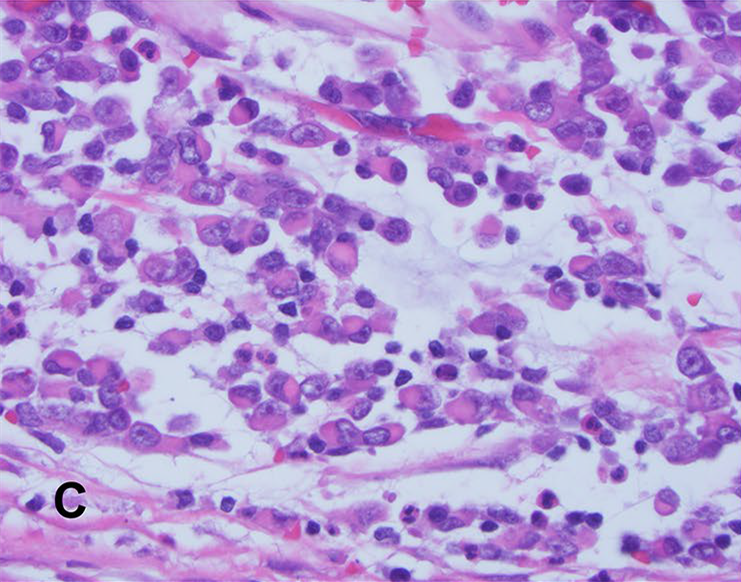
图5. 淋巴结转移灶中的横纹肌样细胞,细胞核偏位。
免疫组化检测,原发肿瘤及淋巴结转移灶中的肿瘤均表达AE1/AE3、CK18,且均是强阳性为主、伴少部分弱阳性;EMA和vimentin弥漫阳性,p63和CEA局灶阳性。阴性指标有TTF-1、Tg、PAX-8、CK5/6、CK7、CK20、CK19、S100、Syn、calcitonin、CD31、CD34、CD56、CD99、GFAP、Melan-A、HBME-1、calponin、desmin、SMA、MSA、myogenin、p40、D2-40、CDX-2、SOX10、HMB-45、BCL-2、MUC4、FLI-1、BRAF V600E。增殖指数5-30%不等,平均15%。特殊染色,胞质内未见黏液成分。
免疫组化INI1检测,肿瘤细胞无细胞核着色,而间质、血管内皮及正常滤泡细胞中仍有细胞核着色。供对比的184例甲状腺肿瘤标本INI1均为细胞核阳性着色,其中良性肿瘤88例,恶性肿瘤96例,恶性肿瘤具体包括了滤泡癌10例、乳头状癌66例、髓样癌8例、低分化癌3例、间变性癌9例。
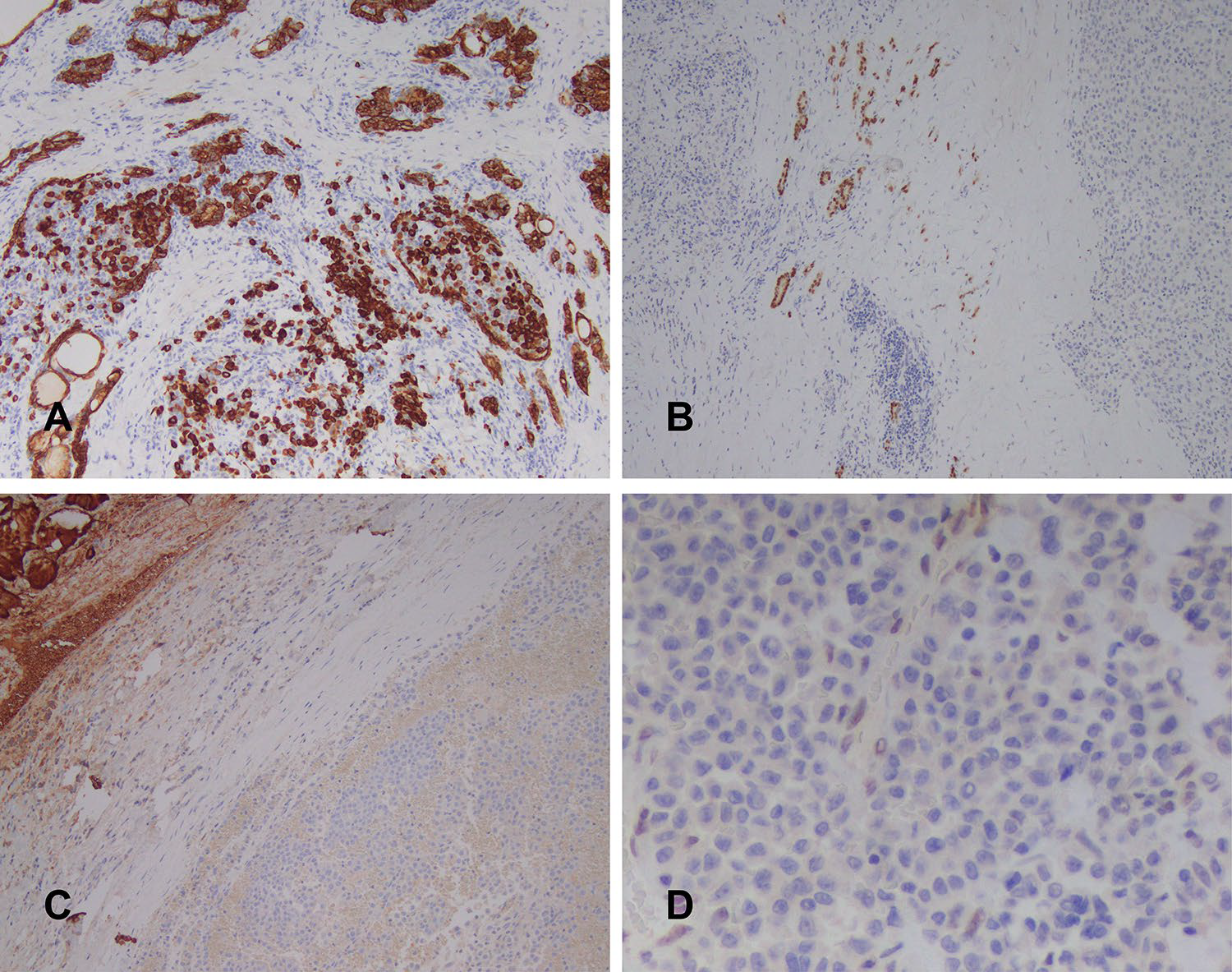
图6. 免疫组化检测,肿瘤细胞表达CAM5.2,但阳性程度有一定差异(左上);不表达PAX-8(右上)、Tg(左下);肿瘤细胞不表达INI1,内皮细胞及散在淋巴细胞可作为内对照(右下)。
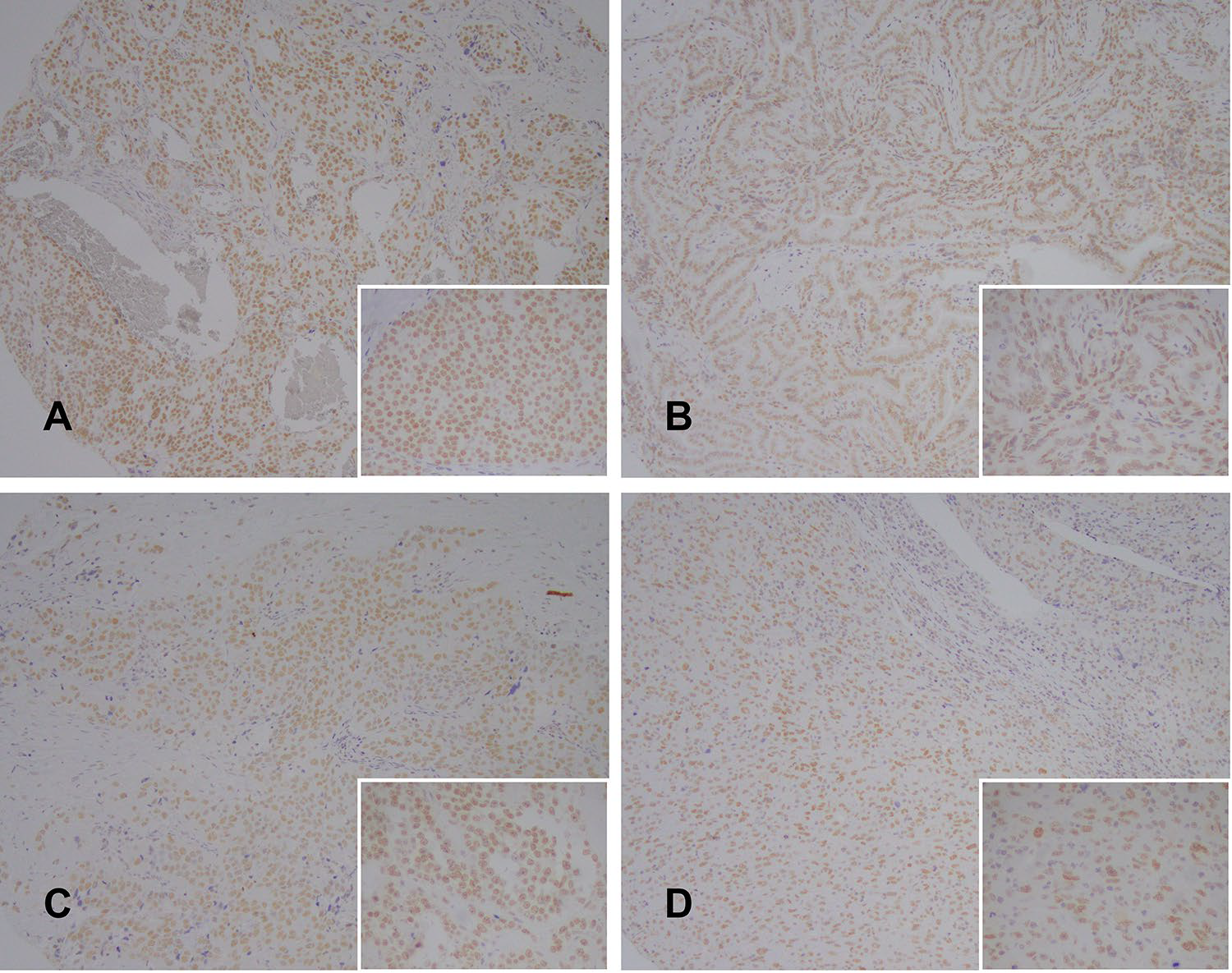
图7. 作为对照的甲状腺病例中,INI1均为细胞核阳性表达:左上为甲状腺髓样癌,右上为甲状腺乳头状癌,左下为甲状腺低分化癌,右下为甲状腺间变性癌。
进一步行二代测序,可见SMARCB1/INI1基因移码突变;此外还可见Notch1、TET2基因突变;未见BRAF V600E、KRAS、NRAS、HRAS基因突变及RET/PTC1、RET/PTC3、PAX 8/PPARγ融合。原位杂交检测EBER、HPV 16/18均阴性。
手术切除并辅助放化疗后,患者出现了严重并发症:甲状腺功能减退、食管狭窄、营养不良、严重低钠。确诊14个月后,患者因无法控制的低钠而去世。
小结
SMARCB1/INI1是SWI/SNF ATP依赖性染色质重塑复合物的核心亚基,在所有正常细胞的细胞核均有表达,因此推测这是一个肿瘤抑制基因。SMARCB1突变导致相应蛋白的细胞核表达缺失,可见于多种良性及恶性上皮性、间质性肿瘤,如上皮样肉瘤、肌上皮肿瘤、肾髓质癌、骨外黏液样软骨肉瘤、上皮样恶性外周神经鞘瘤、横纹肌样亚型的癌等。
大部分INI1缺失的癌均为上皮样和/或横纹肌样或浆细胞样组织形态,且临床行为侵袭性强。发生于头颈部的这类肿瘤,最常见原发部位是鼻腔鼻窦处。对于甲状腺而言,横纹肌样肿瘤非常罕见。相似形态学表现的情况,多见于甲状腺间变性癌或低分化癌,罕见于滤泡癌。且文献中也有报道,称淋巴结转移灶中的横纹肌样形态要比原发灶更为显著。
具体到INI1缺失型甲状腺癌来说,这一肿瘤类型非常罕见,却并无显著分化特点;因此组织学呈实性、梁状、假腺样等结构,间质黏液样变;瘤细胞黏附性差,形态呈横纹肌样及上皮样等表现,但并无基底样特点;临床极具侵袭性。
参考文献
Liu Z, Seshadri M, Gupta V, Papanicolau-Sengos A, Merzianu M. INI1-Deficient Thyroid Carcinoma is an Aggressive Disease with Epithelioid and Rhabdoid Phenotype. A Case Report, Survey of INI1 Expression in Thyroid Lesions and Literature Review. Head Neck Pathol. 2021;10.1007/s12105-021-01338-0.
doi:10.1007/s12105-021-01338-0




















共0条评论