1、概述
腺样囊性癌(adenoid cystic carcinoma,ACC)常发生于具有管状腺泡状结构的外分泌器官,最常见于涎腺,也可发生于泪腺、汗腺、支气管、乳腺等部位,而发生于宫颈者则非常罕见。宫颈ACC是一种罕见的特殊类型宫颈腺癌,发病率仅占宫颈腺癌的1%以下。发生于涎腺、乳腺、支气管等部位ACC具有相对较好的临床预后,而一旦发生于宫颈者,其恶性度高,甚至比宫颈同样临床分期的鳞状细胞癌(squamous cell carcinoma,SCC)恶性度更要高,因为其侵袭性高且预后较差,故早期诊断意义重大。自从1949年Paalman等描述了第一例宫颈ACC以来,多数为个案报道或小宗报道,其中Musa等曾于1985年研究总结17例宫颈ACC是迄今为止最大宗的病例报道。
2、流行病学
患者发病年龄从24-99岁不等,平均年龄为66岁,多数发生于绝经后妇女,临床症状主要为阴道流血,宫颈肿物多为外生性及息肉样浸润性生长,也可为溃疡型;宫颈ACC多合并其他常见类型肿瘤,以SCC为多见;肿瘤大体质地不脆且不易碎可与宫颈普通型SCC相鉴别;该肿瘤具有高度侵袭性,常局部复发或转移至远隔器官,易发生血道转移至肺,临床预后差。
3、病理形态学
宫颈ACC细胞学涂片检测示肿瘤细胞小,常呈簇状聚集呈三维立体状,形态较为规则,胞质稀少,核呈圆形或椭圆形,特征性透明物质是其细胞形态学特征。
宫颈ACC组织形态学与发生在其他部位ACC形态一致。生长方式多表现为筛状、小管状或实性型等3种结构,筛状结构是最具特征及典型结构,有两种类型,即假性腺腔和真性腺腔;肿瘤细胞形态为基底细胞样,细胞大小一致,圆形或卵圆形,胞质较少,核深染,偶可见核仁,核分裂象活跃,坏死常见;肿瘤细胞由管腔腺上皮细胞及周围的肌上皮细胞两种类型细胞构成;细胞巢周围及筛孔状腔隙内富含粉染基膜样物质;细胞巢周围缺乏癌性纤维间质反应。与涎腺ACC不同,发生在宫颈ACC肿瘤细胞核多形性更加明显,核分裂活性高,多有坏死和实性型报道。伴肉瘤成分者可见间质内梭形细胞肉瘤成分,肿瘤细胞异型性大,病理性核分裂象较为多见。
回顾文献发现宫颈ACC多与其他类型宫颈肿瘤合并发生,例如宫颈鳞状上皮内病变、普通型SCC、腺癌、基底细胞腺癌及小细胞癌或肉瘤等,其中以SCC为主,术前小活检取材较局限,可出现漏诊,因此诊断需要依靠子宫切除术后病理学检查确定,仅凭术前诊刮或细胞学检查来诊断可能会出现漏诊。但宫颈ACC与这些肿瘤的关系还不明确。
宫颈ACC具有特征性的免疫组化表达方式:癌巢中腺上皮细胞特异性表达CK7、CD117、Bcl-2等免疫标记物,肌上皮细胞可表达SMA、p63、p40、S-100等;CD117是ACC特征性抗体;筛孔状管腔内粉染物及周围粉染基质可表达CollagenV、Laminin等;文献记载宫颈ACC还可表达激素受体;p16及人乳头状瘤样病毒(HPV) 均阳性表达,提示与HPV感染有关。ACC可特征性发生t(6;9) (q22-23;p23-24)易位,产生MYB-NFIB融合基因,该融合基因可导致MYB蛋白过表达。因此在ACC中可通过荧光原位杂交及免疫组化方法检测C-MYB蛋白表达。
4、鉴别诊断
宫颈ACC的侵袭性高,患者预后差,形态学上应注意与以下宫颈恶性肿瘤区分。
①宫颈腺样基底细胞癌 ( adenoid basal carcinoma,ABC)是最主要鉴别诊断:两种肿瘤组织学形态类似,均好发于绝经后老年女性且常合并其他类型宫颈病变,但预后差异较大。ABC常见于绝经后女性,患者常无明显临床症状;小巢状基底细胞样细胞几乎总是位于CIN或微小浸润性鳞状细胞癌下方,肿瘤细胞体积小,胞质稀少,排列成条索和巢状,局灶有腺体形成或鳞状细胞分化。肿瘤细胞异型性较小,坏死少见,恶性度低,癌巢周围细胞常呈栅栏状排列,类似于皮肤基底细胞癌,无肌上皮分化及基底膜样物质。甚至有学者提倡将其命名为基底细胞肿瘤,以避免过度治疗;鳞状上皮表达p63而腺样成分不表达;而Bcl-2则在ABC中表达。而宫颈ACC侵袭性高,容易发生早期复发及远处转移。肿瘤细胞有典型筛状结构,多形性及异型性明显,核分裂数高,易出现坏死;此外肿瘤细胞巢周围及细胞腔隙内可产生基膜样物质(BMM),CollagenV或Laminin 蛋白免疫组化染色阳性,是鉴别诊断的免疫组化标记物;ACC中C-MYB蛋白特征性过表达。
②宫颈SCC:宫颈最常见类型恶性肿瘤,当宫颈ACC广泛鳞化时与鳞状细胞癌易混淆,SCC肿瘤多呈巢团状分布,肿瘤细胞较大,常呈多边形,可见癌巢和角化珠或细胞间桥结构,免疫组化标记物p40、p63、CK56等阳性表达。宫颈ACC鳞化细胞巢周边至少有一层基底样细胞包绕,呈栅栏状排列,与经典形态存在有过渡,癌巢周围间质一般不出现癌性促结缔组织反应。此外ACC可特征性表达MYB蛋白。
③宫颈基底样SCC:尤其是小活检标本主要与宫颈实性型ACC相鉴别困难,后者可能出现恶性鳞状细胞分化,鉴别要点为宫颈ACC基底样肿瘤细胞可产生基底膜样物质。
④实性型ACC易与宫颈神经内分泌肿瘤混淆,神经内分泌肿瘤肿瘤主要呈不规则巢团状、结节状、小梁状、器官样、腺样或弥漫片状排列,可见假菊形团样结构;肿瘤细胞呈短梭形或淋巴细胞样,胞质稀少,胞核深染,核分裂象多见,大细胞神经内分泌癌可能包含外围栅栏状的基底细胞构成小梁结构;免疫组化神经内分泌标记物CD56、Syn、S-100和CgA等阳性表达,而ACC神经内分泌标记物为阴性。
⑤宫颈腺鳞癌:一种罕见的恶性上皮源性肿瘤,肿瘤含有明确的腺癌和SCC成分,有助于鉴别诊断。
⑥宫颈黏液表皮样癌:该肿瘤罕见,大体为分界相对清楚包块,但多见含有黏液的囊性区。镜下主要有黏液细胞、中间细胞和鳞状细胞构成,而宫颈ACC合并高分化鳞状细胞,两种成分是相对独立的,且免疫组化标记物CD117特征性阳性。
5、发病机制
宫颈ACC的发生机制尚不明确,但多数学者支持宫颈储备细胞来源这一理论。储备细胞是一种未分化的多潜能细胞,位于宫颈黏膜表面和腺体柱状上皮细胞与基底膜间,可向多种方向分化,例如鳞状上皮、腺上皮,甚至肌上皮等。两种不同分化方向的肿瘤细胞同时发生于同一部位,可能为宫颈储备细胞受到致癌因素的刺激,潜伏积累后导致宿主细胞发生癌变,并向多方向分化,最终形成罕见和常见肿瘤合并存在的结局。目前有两种说法 ①宫颈储备细胞异常增生并向柱状细胞分化的结果。②宫颈储备细胞向不典型细胞方向增生的结果。事实上宫颈ACC免疫组化可显示鳞状或腺样分化,也表明其是从宫颈上皮的多能储备细胞层发展而来,但其具体的发病机制需要进一步的研究证实。
现已证明HPV感染是宫颈鳞状上皮内病变和侵袭性宫颈SCC的主要致病因素,宫颈腺癌的病因也有类似结论。HPV与宫颈ACC的关系尚不明确,Shi等证实高危型HPV在宫颈ACC和SCC中的整合,提示HPV可能在肿瘤的发病机制中发挥重要作用。
研究显示在乳腺ACC中CD117 与预后相关,而宫颈ACC尚无相关研究。CD117是一种分子量为145KD的酪氨酸激酶蛋白,通过与干细胞生长因子结合发挥生物学作用。
6、临床治疗和预后
宫颈ACC作为罕见肿瘤,目前尚无统一的治疗方法,但多数研究推荐彻底的手术治疗,术后辅助以放射治疗,晚期患者甚至辅以化学治疗。因此早期发现及治疗可以提高宫颈ACC患者的生存率,同时对于晚期患者应该给予积极的术后治疗及密切的随访。
临床分期与预后相关,资料显示临床Ⅰ期患者的 5 年生存率达56%,而临床Ⅲ期的平均生存时间为 27个月。宫颈ACC的浸润深度、淋巴结和远处转移情况对预后的影响也值得后续关注。文献认为宫颈ACC有高度侵袭性,预后较差,易发生淋巴结及远处转移,常发生淋巴结、腹腔、肺和脑转移。个别患者可获得长期生存原因可能:①无淋巴结转移及脉管侵犯;②肿瘤细胞分化好,病理分裂象少见;③肿瘤的生长方式主要为小管状或筛状结构。因此早期发现,早期治疗可以提高宫颈ACC患者的远期生存。影响宫颈ACC预后因素包括肿瘤大小、深部间质浸润及淋巴管或血管内癌栓。
7、小结
宫颈ACC主要通过手术治疗, 由于其恶性程度较高,术后常以放射治疗作为辅助手段。 目前宫颈 ACC 中是否存在C-KIT突变尚无报道, 对于手术难以切除的病例,C-KIT突变能否成为其治疗的新靶点是后续需进行的相关研究。
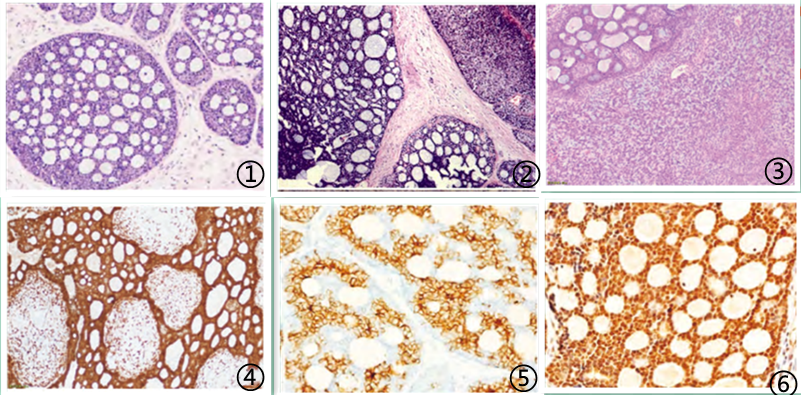
图1肿瘤细胞呈筛状生长方式;图2 ACC伴鳞状细胞癌成分;图3 ACC伴梭形细胞成分;图4肿瘤细胞p16弥漫强阳性;图5肿瘤细胞CK7弥漫阳性;图6肿瘤细胞MYB弥漫强阳性;图片来自于参考文献1,2,10,如有侵权,请联系删除。
参考文献:
[1]师晓华,武莎菲,凌庆,等. 宫颈腺样囊性癌临床病理特征及免疫组织化学表型[J]. 协和医学杂志,2015(03)197-201.
[2]马晓梅,房新志,赵峰,等. 宫颈腺样囊性癌合并鳞状细胞癌临床病理及免疫表型分析[J]. 临床与实验病理学杂志,2010,026(003)367-369.
[3]Musa A G , Hughes R R , Coleman S A . Adenoid cystic carcinoma of the cervix A report of 17 cases[J]. Gynecologic Oncology,1985,22(2)167-173.
[4]张小丽,贺荣芳,张慧明. 宫颈腺样囊性癌合并鳞状细胞癌1例[J]. 临床肿瘤学杂志,2019,v.24;No.212(08)100-101.
[5]梁云,陈晓端,张晓飞,等. 伴腺样囊性癌特征的子宫颈基底样鳞状细胞癌三例临床病理学分析[J]. 中华病理学杂志,2018,47(009)719-720.
[6]Smith L C , Lane N , Rankow R M . Cylindroma (adenoid cystic carcinoma). A report of fifty-eight cases[J]. American Journal of Surgery,1965,110(4)519-526.
[7]郑建云,李艳东,刘冰,等. 子宫颈腺样囊性癌合并子宫颈及子宫内膜鳞状细胞癌1例[J]. 临床与实验病理学杂志,2016(5)597-598.
[8]李宁宁,王泳超,孙文勇. 宫颈腺样囊性癌的病理特征分析[J]. 浙江实用医学,2020(1).
[9]王丽丽. 宫颈腺样囊性癌伴鳞状细胞癌的临床病理特点及文献复习[J]. 中外医学研究,2014(16)162-164.
[10]马亚琪,王利群,封琳,等. 宫颈腺样囊性癌2例临床病理观察[J]. 诊断病理学杂志,2019(10).
[11]梁云,陈晓端,张晓飞,等. 伴腺样囊性癌特征的子宫颈基底样鳞状细胞癌三例临床病理学分析[J]. 中华病理学杂志,2018,47(009)719-720.














共0条评论