1、概述
宫颈浸润性复层产黏液性癌(invasive stratified mucin-producing carcinoma,ISMC)是一类罕见的具有特殊组织形态学特征的宫颈浸润性癌,由于其组织形态学与WHO(2014)女性生殖系统肿瘤分类中新增加的复层产黏液上皮内病变(stratified mucin-producing intraepithelial lesion,SMILE) 相类似,均表现为肿瘤细胞呈实性巢团状,瘤巢中弥漫散分布产黏液细胞等特征,因此被认为是SMILE的浸润性生长形式。由于目前病例文献报道较少,对该肿瘤认识明显不足,故在病理诊断中易出现漏诊或误诊的情况。
WHO(2014)女性生殖系统肿瘤分类中关于宫颈腺癌前驱病变的临床分类中新增加一种宫颈原位腺癌(adenocarcinoma in situ,AIS)亚型,即SMILE,此亚型于2000年由Park等首次提出,属于AIS特殊变异型,是一种少见的宫颈癌前病变。ISMC由Lastra等于2016年首次报道并命名,2017年于丽丽等报道了国内首例,目前认为是一种少见的具有特征性组织学特征的宫颈浸润性腺癌亚型。2018年国际子宫颈腺癌分类标准中根据与病因学相关的形态学特征将其归为HPV感染相关的黏液型腺癌。
2、流行病学
ISMC被认为是SMILE 的浸润性形式,两者在发病年龄上符合宫颈原位腺癌发展为浸润性腺癌的进程。文献报道SMILE发病年龄为22-40岁,平均年龄29岁,而ISMC患者发病年龄为29-66岁,平均48岁,与原位腺癌发展至浸润性腺癌的平均发病年龄相差10-15年。多数病例表现为阴道出血或同房后出血,少量病例因常规体检发现细胞学异常就诊,个别病例表现为快速进展的腹水体征。有文献报道指出,SMILE、ISMC病变与高危型HPV感染密切相,多数表现为高危型HPV-18阳性患者。
3病理学特征
Lars-Christian等报道的3例ISMC呈息肉样和外生性生长,作为SMILE的浸润性形式,ISMC可单独存在,或与SMLIE、AIS或高级别鳞状上皮内病变(HSIL)并存,也可伴有其他类型的宫颈浸润性癌,如浸润性鳞癌、浸润性普通型腺癌、非特殊型黏液性癌等。ISMC具有与SMILE相似的结构,明显不同于鳞癌或普通型宫颈腺癌,但与SMILE位于宫颈柱状上皮内不同,ISMC的肿瘤细胞排列成巢团状或实性片状浸润于宫颈间质中,伴有促纤维组织反应、明确的结构破坏或浸润生长方式,复层柱状细胞巢团呈栅栏状,镶嵌式排列,多层叠瓦状,无明显腺样结构,形态类似浸润性鳞状细胞癌,但在肿瘤细胞巢中全层可见细胞胞质内黏液,黏液多寡不一,即使在同一病例中也存在黏液丰富区和黏液贫乏区。肿瘤细胞核大深染,胞核圆形或卵圆形,核仁不明显,核分裂及凋亡小体可见;细胞无角化及细胞间桥。多数病例中可见中性粒细胞浸润肿瘤细胞巢。
免疫表型方面ISMC与SMILE相似,文献报道肿瘤细胞P16和CK7弥漫强阳性,CAM5.2阳性,IMP3可呈局部阳性,P63、CK5/6、P40、ER及PR等为阴性。阿辛蓝染色(AB)细胞内黏液呈阳性。Onishi等曾对1例SMILE进行了电镜观察发现在细胞表面存在许多微绒毛,但纤毛并不明显;胞质中含有丰富的线粒体和粗面内质网,可见胞质内黏液空泡但缺乏张力微丝。ISMC也展现出同样特征,这些细胞有着细长不规则的细胞核,胞质中含有丰富的线粒体和粗面内质网,可见初级细胞连接,同样也缺乏张力微丝。部分ISMC细胞可见胞质内黏液空泡,这些特点有力支持ISMC为腺癌一种特殊亚型。
4鉴别诊断
①黏液表皮样癌:与原发于唾液腺的黏液表皮样癌类似,非常罕见。在新版 WHO(2014)女性生殖系统肿瘤分类中并未将其单独列出,而是包括在腺鳞癌中,且不再使用该名字,肿瘤中可见3种特征性细胞:表皮样/鳞状细胞、黏液细胞和中间细胞,该肿瘤具有鳞状分化,但无相应的上皮内病变,且病灶内无中性粒细胞浸润,细胞凋亡不显著。产黏液细胞常位于癌巢中央,为杯状细胞或印戒样细胞,PAS染色阳性,且CEA阳性,Vimentin阴性;基因检测具有t(11;19) (q21;p13)CRTC1-MAML2基因融合。
②毛玻璃细胞癌:WHO(2014)分类中已将其置于其他上皮性肿瘤中,成为新增病种。组织学特征表现为胞质边缘非常清晰,细胞界限明显,毛玻璃样嗜酸性胞质,细胞核大而圆形,核仁显著,间质内显著的嗜酸性粒细胞浸润,围绕肿瘤细胞巢分布,通常缺乏浸润前成分,分泌肠型黏液,免疫组化标记物MUC2阳性;PAS特殊染色胞质阴性,而胞膜阳性,这与ISMC明显不同。
③透明细胞腺鳞癌:一种罕见的腺鳞癌亚型。其伴HPV18阳性,且有侵袭性临床行为。组织学特征为肿瘤细胞黏合排列呈片状,胞界清楚,透明胞质含大量糖原。与ISMC不同的是肿瘤细胞被纤维组织分隔为小叶状,纤维组织间隔内明显的淋巴细胞浸润,可见灶性腺体形成,黏液卡红染色为阳性。
④黏液性癌-印戒细胞型:一种罕见类型腺癌。组织学特征为瘤细胞显示局灶或弥漫的印戒细胞样分化。肿瘤细胞富含黏液,异型性大,胞核偏位,P16可阳性;而ISMC中细胞内黏液量多少不一。
⑤腺鳞癌:形态学上具有明显腺癌成分(腺腔样分化特征)和鳞癌成分(细胞间桥和角化珠结构),分别可表达腺上皮和鳞状上皮免疫组化标记物,且每种肿瘤成分在10%以上。
⑥腺样基底细胞癌(ABC):临床罕见,一般大体无明显肿块,肿瘤由基底样细胞形成分化好的小而圆的细胞巢,周边肿瘤细胞栅栏状排列,但无黏液细胞,无促结缔组织增生,核分裂象罕见,80%以上病例伴有HSIL。免疫组化标记物P63、P40、P16、CD10等为阳性,肿瘤细胞增殖指数Ki6较低。
⑦腺样囊性癌(ACC):临床罕见,该肿瘤可形成腺样、筛状或小管状结构。免疫组化标记物CD117常阳性。
⑧伴有黏液的子宫颈良性腺体增生:当宫颈腺体受到物理、化学或生物因素刺激后,可以出现不同程度的增生,细胞可呈复层排列,并含有细胞内黏液,容易与之混淆,但前者无或仅有轻微异型性,核分裂象及凋亡小体罕见,P16呈斑驳状着色,此外宫颈良性腺体增生的增殖指数较低。
⑨伴少许黏液细胞的鳞状细胞癌:具有明显的鳞癌组织学特征及免疫表型,黏液细胞常局灶分布。
5 、治疗与预后
关于ISMC的临床治疗,文献报道与其他类型的宫颈癌相似,主要根据其肿瘤的病理分期,采用根治性子宫切除术,加或不加放化疗。Lastra等报道5例中有3例患者术后出现肺转移或死亡,故需密切随访。
6 、SMILE概述
宫颈癌的好发部位是鳞柱交界的移行带,储备细胞既能够分化为鳞状上皮,也能够分化为柱状上皮,在宫颈癌前病变中,既有鳞状细胞癌的前期病变-HSIL,也有腺癌前期病变-AIS,宫颈AIS与HSIL常共存,且可能是同源于同一型HPV感染。SMILE被认为是AIS的一种变异型,也有学者认为是原位腺鳞癌的一种表现形式,但SMILE的复层产黏液上皮并无明显鳞状上皮分化,SMILE主要是基于病理形态学的诊断。
临床症状主要为阴道出血、同房后出血及异常细胞学筛查伴高危HPV检测阳性,也有宫颈肿块等。Boyle等研究认为平均年龄31岁,检出率为0.6%; SMILE可单独存在,但常伴有其他类型上皮内病变和侵袭型癌。细胞学检测结果包括ASC-US、ASC-H、HSIL、AGC、AIS等,其表现包括三维细胞团、多数细胞团显示细胞分层现象,但缺乏AIS特征性改变,如不规则的细胞团、典型羽毛状边缘、菊型团、栅栏状核;多数核相对轻度不典型性,核异型性不显著,胞核拥挤,染色质细腻,可见核分裂象及凋亡小体,细胞质内空泡可见。
组织形态学特征包括:①宫颈表面不典型复层细胞上皮内病变,类似HSIL,有时可局灶累及宫颈管腺体,肿瘤细胞核圆形或卵圆形,可见核分裂象及凋亡小体。在黏液丰富区域,由于黏液挤压,胞核异型性可不显著。由于细胞内黏液存在,中下层细胞核间有明显间隙,有时上皮可见中性粒细胞浸润。②存在黏液丰富区及贫乏区。③宫颈上皮和间质交界处多呈现圆形或小叶状轮廓,类似腺上皮肿瘤特点,但并不形成明确腺体,缺乏AIS经典腺体结构。免疫组化Ki-67增殖指数高(平均约77%),且贯穿全层表达;P16弥散斑块状强阳性、弥漫强阳性或斑块状强阳性,该阳性模式与高危型HPV感染相关,也支持SMILE产黏液细胞是宫颈管腺上皮来源。免疫组化标记物CK14和CK5/6等为阴性,P63基底细胞局灶弱阳性,而黏液区域阴性,则提示SMILE无鳞状上皮的分化。Sano等用免疫组化黏液染色双标P16与Alcian blue、P40与Alcian blue也证实SMILE全层细胞(包含黏液细胞)P16呈强阳性,而黏液细胞P40呈阴性,也支持SMILE无鳞状上皮分化;此外还检出HPV16和HPV18为阳性,支持HPV感染相关。Onishi等电镜观察发现SMILE含丰富线粒体、细胞质内腔和表面微绒毛,缺乏张力微丝,该超微特征支持其腺上皮分化。
SMILE需与下列疾病进行鉴别诊断:
①HSIL:细胞呈复层排列分布,可累及腺体,但无细胞内黏液,具有鳞状上皮免疫组化表型。
②AIS:肿瘤细胞异型性明显,可见核分裂象和凋亡小体,表达腺上皮免疫标记物,但细胞内黏液明显减少,可形成明显腺腔结构。
③ISMC:类似的病理形态学及免疫表型特征,但呈浸润性生长方式,肿瘤细胞巢边缘不规则,可见促结缔组织增生性反应,细胞巢内可见中性粒细胞浸润,病变范围更加广泛。
④宫颈腺样基底细胞癌(ABC)。
⑤宫颈良性腺体增生。
目前还没有专门针对SMILE 的临床处理指南。当SMILE 伴随有AIS时按照AIS来处理;但当SMILE单独出现时,或只与CIN共存时,是按照HSIL处理,还是按AIS来处理,目前仍颇有争议。
7、小结
综上所述宫颈ISMC是新近报道的一种少见的具有特异组织学特征的宫颈浸润性癌,形态学上类似于SMILE,主要表现为肿瘤细胞呈实性巢团状和上皮内弥散分布的产黏液细胞,因此被认为是其浸润性癌,且有与宫颈腺癌相同的治疗和预后,多以手术切除辅助放化疗,规范临床管理途径有赖于更多的关注。
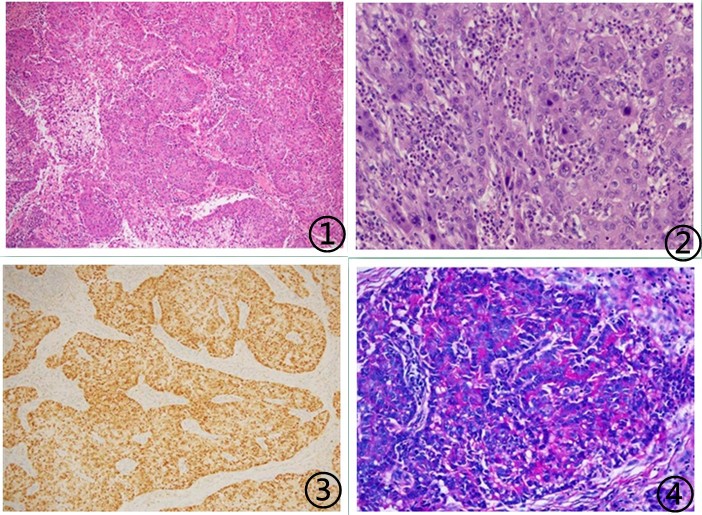
图1低倍镜下瘤细胞排列成巢团状或实性片状浸润生长,无明显腺样结构,肿瘤细胞巢中全层可见细胞胞质内黏液 图2高倍镜下肿瘤细胞核大深染,核圆形或卵圆形,核仁不明显,核分裂及凋亡小体可见,可见中性粒细胞浸润肿瘤细胞巢 图3肿瘤细胞P16弥漫强阳性 图4肿瘤细胞AB-PAS特染阳性;图片来源于参考文献1,6,8,如有侵权,请联系删除。
参考文献:
[1]孟苹, 徐佳佳, 王国庆,等. 宫颈复层产黏液性癌5例临床病理分析[J]. 诊断病理学杂志, 2020, v.27(06):18-21.
[2]Kurman R J, Carcangiu M L, Herrington C S, et al. WHO Classification of Tumours of Female Reproductive Organs. 2014.
[3]Lastra R R, Park K J, Schoolmeester J K.Invasive Stratified Mucin-producing Carcinoma and Stratified Mucin-producing Intraepithelial Lesion (SMILE): 15 Cases Presenting a Spectrum of Cervical Neoplasia With Description of a Distinctive Variant of Invasive Adenocarcinoma[J]. American Journal of Surgical Pathology, 2016, 40(2):262-269.
[4]Horn LC,Handzel R,Borte G,et al. Invasive stratified mucin producing carcinoma (i-SMILE) of the uterine cervix: report of a case series and review of the literature indicating poor prognostic subtype of cervical adenocarcinoma[J].J Cancer Res Clin Oncol,2019,145(10):2573-2582.
[5]胡佐鸿,赵春.复层产黏液上皮内病变研究进展[J]. 诊断病理学杂志, 2018,v.25 (06): 67-71.
[6]赵连花,马强,付萍,等.子宫颈浸润性复层产黏液性癌1例并文献复习[J].临床与实验病理学杂志,2019,v.35(09):81-83.
[7于丽丽, 赵明, 陈万远,等. 子宫颈浸润性复层产黏液的癌一例[J]. 中华病理学杂志, 2017, 046(011):795-796.
[8]邓茜,吴饶平,黄慧伟, et al. 子宫颈产黏液的复层上皮内病变14例临床病理分析[J]. 现代实用医学, 2020, v.32(03):95-97+150.
[9]张冬梅,魏建国,赵芳,等.子宫颈浸润性复层产黏液的癌1例[J]. 临床与实验病理学杂志, 2020, v.36(02):118-119.
[10]李海凤、林维真、周璐、张娜娜. 子宫颈浸润性复层产黏液性癌临床病理分析[J]. 新医学, 2020,v.51(11):50-55.
[11]王志强, 金玉兰, 何春燕. 宫颈产黏液的复层上皮内病变的临床病理学特征并文献复习[J]. 中国医刊, 2019, 054(005):551-554.
[12]黄幼玉、潘冰川、史连国. 宫颈浸润性复层产黏液性癌2例临床病理观察[J]. 诊断病理学杂志, 2020, v.27(11):46-49+53.














共0条评论