1 概述
肺纤毛黏液结节性乳头状肿瘤(Ciliated Muconodular Papillary Tumors,CMPT)是一类新定义的潜在恶性肿瘤,目前国内外报道均较少,既往文献报道病例未见复发和转移。CMPT是一种在全球范围都极为罕见的肺肿瘤,临床医生和病理科医师认识不足,影像学和镜下形态表现易误诊为肺部恶性肿瘤而导致过度治疗,术中冷冻诊断有一定难度,最终确诊需依赖于术后病理检查。2002年日本学者Ishikawa等首先描述CMPT,发生于外周肺组织的良性或低级别恶性乳头状肿瘤,由纤毛柱状细胞、杯状细胞及基底细胞组成,存在恶性变潜能,并由其形态学特征命名。2015年世界卫生组织(WHO)呼吸系统肿瘤分类中未对该肿瘤进行描述。
2 临床特征
临床多见于中老人,平均年龄72岁,发病人群在60岁-80岁,年轻者偶有报道,男女比例无明显差异,男性稍多,患者无明显症状,吸烟关系不大,患者多因体检或其它疾病偶然发现,少数可有咳嗽或胸闷不适等轻微症状。从地域上大多来自东亚,这可能与种族基因差异或易感性有关。CMPT多为单发,少数病例可伴发同侧或对侧肺腺癌,可能提示CMPT与肺腺癌在致病因素或发病机制等方面有一定的相关性。多位于肺的外周,各肺叶均可发生,右下肺野最为常见,一些病变靠近胸膜,位于周围肺组织内毛玻璃样或实性结节性病灶,实性或囊实性不规则结节,形态不规则,边界模糊,部分可伴有中央空洞,术前极易被误诊为肺腺癌。病灶平均大小约为11mm,大多数小于15mm,目前报道的最大病灶为45mm。
3 病理学特征
典型CMPT的组织病理学特征为周围肺组织单发的灰白或灰褐色黏液样结节,位于肺外周的小结节,直径0.2-2.0cm,平均0.5cm,边界清楚,无包膜,切面呈灰白、灰红色或灰黄色,质软,富于黏液。其组织学形态特征如下:①肿瘤组织主要排列成或腺管状乳头状结构,沿肺泡壁呈不连续地生长,取代正常肺泡上皮细胞,2种结构可混合存在,局部可呈贴壁状生长,也可形成微乳头状结构漂浮在黏液物质内,部分区域可见贴壁样及微乳头状结构。②肿瘤细胞包括基底细胞、纤毛柱状细胞及黏液细胞3种按不同比例混合组成,少数病例以黏液细胞增生为主,或以基底细胞增生为主。基底细胞位于基底层,呈单层排列或增生呈多层,起支架作用,部分区域可不连续,成簇的基底细胞甚至可以出现鳞状上皮化生;纤毛柱状细胞位于乳头及腺管的表面,呈单层或多层,两者混杂分布,比例不一;黏液细胞穿插分布于纤毛柱状细胞和基底细胞之间;3种肿瘤细胞形态温和,均无异型性,无核分裂象,无肿瘤性坏死;③肿瘤内及肿瘤周围肺泡腔内充满黏液,并形成黏液池,黏液池内可漂浮乳头状及微乳头状排列的肿瘤组织。④肿瘤间质纤维组织增生,常伴有淋巴浆细胞浸润,黏液内可见泡沫样组织细胞及多核巨细胞,少数病例间质炎症细胞浸润不明显。⑤肿瘤总是与细支气管动脉束相邻,或穿入不成对的中型动脉。
肺CMPT免疫表型和特殊具有特征性,3种肿瘤细胞免疫组化表达不一致。基底细胞表达P63及P40,部分表达TTF-1,不表达CK7、NapsinA及SP-A,部分基底细胞间可见少量表达Syn及CgA的神经内分泌细胞;纤毛柱状细胞及黏液细胞均表达CK7、CEA、CA125及MUC-1(部分区域MUC-1呈腔缘线状着色,少数细胞弱表达TTF-1、NapsinA、SP-A及P63,不表达P40;少量纤毛细胞弱表达MUC5AC,而黏液细胞不表达MUC5AC;3种细胞均不表达CK20、CDX-2、MUC-2及SATB2;3种细胞Ki-67均呈低表达(文献报道Ki-67一般不超过5%)。特殊染色结果:黏液细胞表达PAS和AB-PAS,弹力纤维染色可有肺泡原有的弹性框架结构破坏或缺失。
4 分子遗传学
CMPT内存在多项基因突变,Lau等研究发现CMPT中存在BRAF、EGFR、KRAS、ALK、LDH1、CTNNB1、AKT等基因突变,其中BRAF基因的V600E点突变频率相对较高。Kamata等报道10例中有8例发生突变,其中4例有BRAF-V600E基因突变,1例携带BRAF-G606R突变,3例检测出EGFR第19号外显子缺失;Liu等认为BRAF V600E有致癌特性且其在广泛的人类肿瘤驱动中具有重要作用,认为是约40%的CMPT中的重要驱动突变,并报道1例有BRAFV600E和AKT1-E17K突变;Udo等报道的4例CMPT中,2例检测到基因突变,1例为BRAF-V600E和AKT1-E17K突变,另1例首次检测到KRAS-G12D突变。这些遗传学改变进一步证实了CMPT的肿瘤本质,而非反应性增生或化生性病变。但目前这些突变基因与CMPT的发病机制及预后的关系尚不清楚,针对其基因突变的研究尚不足,关于该肿瘤的驱动基因尚不能完全明确,有待进一步研究。
CMPT究竟属于良性还是恶性病变仍存在争议。纤毛组织的存在一般认为良性;且CMPT无病理性核分裂象和坏死;某研究报道10例CMPT随访43个月无复发。这些都是良性病变的有力证据。但是CMPT具有驱动基因变异,有研究者比较经典型CMPT和非典型CMPT的驱动基因突变情况后发现,在11例经典CMPT中有8例驱动基因突变,驱动突变包括BRAF、EGFR、ALK,在非经典CMPT 病变中发现BRAF、EGFR和KRAS突变,提示它极有可能是一种肿瘤性病变。
5 发病机制
WHO(2015) 肺肿瘤分类中将肺腺瘤分为硬化性肺细胞瘤、肺泡腺瘤、乳头状腺瘤、黏液囊腺瘤、黏液腺腺瘤。肺腺瘤起源于自主支气管至周围肺泡的肺呼吸道上皮,而细支气管起源的腺瘤未曾描述。CMPT有较多相似之处,这些病变是相互独立的还是同一肿瘤处于不同阶段和部位的表现,亦或恶性病变的前驱改变,仍有待证实。2018年Chang等在25例CMPT的形态学观察、免疫表型及分子特征分析的基础上对CMPT的概念提出修改,称为细支气管腺瘤(bronchiolar adenoma,BA),将发生于周围细支气或肺泡、与CMPT形态学相似的良性乳头状肿瘤均归类为同一谱系,认为这些肿瘤性病变是同一肿瘤谱系在不同部位及不同分化阶段的结果。BA分为近端型和远端型,而经典型CMPT类似近端型形态,提出修订理由如下: 通过观察肿瘤周围肺组织内细支气管的形态学和免疫表型,认为肿瘤组织可能起源于细支气管;BA的分子特征和CMPT的分子特征无明显差异,最常见的是BRAF基因突变,EGFR19外显子的缺失和插入及K-RAS和H-RAS的突变。这一假设给我们提供了进一步研究CMPT的发病机制的思路。
关于CMPT的致病因素及发病机制尚未明确,目前有两种假说: ①有研究认为CMPT具有最常见的驱动基因突变,包括BRAFV600突变和EGFR第19号外显子的缺失。BRAF V600E驱动突变可以激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK) 途径从而促进肿瘤细胞增殖,而细胞外信号调节激酶(extracellular signalregulated kinase,ERK)是MAPK 途径的重要的组成部分,ERK的活化在各种肿瘤的发生发展中起着重要作用。研究发现在检测到BRAF V600E突变的CMPT中未见ERK蛋白的表达,反应了细胞增殖信号通路受限,表明可能有其他机制参与CMPT中MAPK途径的去活化,ERK的激活状态可以解释CMPT的良性行为。后续研究报道,CMPT伴有KRAS突变、ALK重排和AKT突变,从而证实了CMPT是肿瘤性的病变而非反应性病变。②Kashima等人通过组织学分析发现,正常细支气管到CMP的过渡区,几乎所有细胞均表达MUC1和MUC4,局灶表达MUC5。据研究报道MUC1和MUC4在中央支气管和外周细支气管上皮细胞中表达,而MUC5在直径<0.1mm的外周细支气管中不表达,并且定位于细支气管周围。另外NapsinA可于Ⅱ型肺泡上皮细胞中表达,而CMPT中不表达,这些提示CMPT来源于细支气管。多数研究认为CMPT具有纤毛细胞分化,这种通常提示为良性病变。因此以上假说表明了CMPT可能是起源于终末细支气管的良性肿瘤性病变。此外有研究表明CMPT病例中有不少伴有癌症病史,其中伴黏液腺癌者最为多见,此种现象可能提示CMPT是否具有某种致癌基因的改变和两者是否存在相关性,仍需收集更多的病例资料以待进一步验证。
6 鉴别诊断
CMPT须与多种肺良/恶性病变仔细鉴别,尤其是在术中冷冻病理诊断中。
①黏液腺癌:CMPT无包膜、肿瘤内部及周边肺泡腔内充满黏液、易形成黏液湖、沿肺泡壁呈不连续生长及形成乳头及腺管样结构、甚至微乳头结构等特点,极易与其混淆。需仔细观察肿瘤细胞的异型性、核分裂象、坏死及基底细胞的连续性等,尤其是黏液腺癌缺乏CMPT的3种细胞成分,尤其特有的纤毛细胞,在肺内病变中纤毛细胞被认为是良性病变较可靠的证据,术中冰冻时纤毛显示不清,纤毛细胞难以辨认,故CMPT易误诊为粘液性腺癌。因此当遇到肺外周型小结节,富含黏液,肿瘤有多种细胞成分,且细胞无明显异型性时,要考虑CMPT的可能性。此外基因表达方面亦可作为两者鉴别点,CMPT经常表达BRAF突变,但在肺腺癌中却很少有该突变。Udo等研究认为某些CMPT可能是侵袭性黏液腺癌的某种癌前病变,但该观点尚需要进一步研究证实。
②具有纤毛结构的乳头状腺癌:1992年Nakamura等首先报道,作为重要的鉴别诊断在文献中屡屡提及。一般而言具有纤毛结构被认为是良性的标志,但肿瘤的纤毛被覆上皮过于单一,且肿瘤细胞存在异型及核分裂象,而CMPT乳头状结构除被覆纤毛柱状细胞外,还有黏液细胞,基底部基底细胞,细胞无异型性及核分裂象,免疫组化中CMPT的基底细胞表达P63及P40,都可用于鉴别二者。
③高分化乳头状腺癌:有明显的乳头状/腺管结构,被覆细胞显著的异型性、核分裂象及坏死、明显的核仁,且缺乏纤毛柱状细胞,较CMPT温和的细胞形态易于鉴别。而CMPT乳头状结构除被覆纤毛柱状细胞外,还有黏液细胞,基底部有基底细胞。CMPT纤毛细胞和基底细胞分别对TTF-1和p40呈阳性表达,而粘液细胞缺乏HNF4α表达,可与之鉴别。
④肺低级别黏液表皮样癌:起源于支气管粘膜的腺体及其导管,虽组织形态学与CMPT有相似之处,该肿瘤由由黏液样细胞、表皮样细胞和中间细胞3种肿瘤细胞构成。但黏液表皮样癌好发于年轻人,且缺乏纤毛细胞,细胞有异型性,不表达TTF-1。
⑤乳头状瘤:WHO(2015)肺肿瘤分类将支气管乳头状瘤收录在良性肿瘤,包括鳞状细胞乳头状瘤,柱状细胞乳头状瘤和混合性鳞状细胞和柱状细胞乳头状瘤(混合性乳头状瘤),后两种尤其是混合性乳头状瘤与CMPT的组织结构及细胞成分非常相似,老年人多见,60%患者吸烟,临床表现为肺部阻塞性症状,常发生于支气管腔内,伴有散在的淋巴浆细胞浸润的纤维血管轴心的乳头,乳头被覆鳞状上皮和柱状上皮,两者相互移行,鳞状上皮可有轻度至重度不典型增生。柱状上皮包括纤毛柱状细胞、无纤毛柱状细胞和黏液柱状细胞,细胞无异型性及核分裂象,无坏死,背景中可见大量黏液,其组织结构及细胞成分均与CMPT非常相似。尽管发生部位与有差异,前者主要发生于大支气管腔内,而后者发生于肺周边部,但也有文献报认为两者很可能同一病变的不同谱系,其关系仍需进一步研究。
⑥肺外周型孤立纤毛腺性乳头状瘤(solitary peripheral ciliated glandular papillomas, SPCGP),Aida等首先描述3例SPCGP,是一种发生在细小支气管的腺型乳头状瘤,老年人多发,几乎均为不吸烟者。该病例在2015年被WHO归类为罕见的发生于肺外周的腺性乳头状瘤,通过对比两种肿瘤具有很相似的临床病理学特点,SPCGP是发生于肺外周的孤立性小结节且部分病例位于细支气管内,在镜下可见到乳头状及管状结构,被覆不同比例的纤毛细胞和黏液细胞,其下可见连续的基底细胞,与CMPT同样不具有细胞和结构的不典型性、核分裂象和坏死罕见。有文献报道黏液细胞表达Muc-5AC,纤毛柱状细胞不表达Muc-5AC,这与CMPT相反。部分学者认为CMPT与SPCGP是同一类肿瘤,因此乳头状瘤与CMPT究竟是不同病变还是同一病变的不同谱系,目前还存在一定的争议。
⑦细支气管鳞状上皮化生,该病变细胞成分与CMPT类似,多为镜下观察到的病变,多发于间质性肺疾病等炎性病变的基础上,呈多结节性分布,组织结构较为单一,与细支气管有延续性,通常化生与未化生区域混合存在,一般不形成明确肿块。化生的鳞状上皮与CMPT外层的基底细胞形态相似,而未化生区域则表现为与CMPT类似的纤毛细胞和黏液细胞双层结构,但是细支气管鳞状上皮化生组织结构比较紊乱,乳头状结构少见,杯状细胞Muc-5A阳性,影像学无特异性表现。而CMPT多为影像学及肉眼可见的单发结节,组织结构较为复杂,形成乳头状或腺管状结构。再者该病变的免疫组化MUC5AC呈阳性表达,而CMPT的黏液细胞多不表达。
⑧当患者有癌症病史,尤其是肠源性黏液腺癌的病史,病理诊断时和转移性腺癌的鉴别尤为重要。
7 临床治疗及预后
CMPT通常呈良性过程,目前未见复发和转移病例,个别病例有浸润性生长和基底细胞恶性转化倾向。迄今为止,国外文献报道的CMPT病例均采用手术切除,预后良好,未见局部复发及远处转移。临床治疗上尚未建立统一的治疗规范,文献中多采用肺组织楔形切除术,也有少数病例由于影像学和术中冰冻与腺癌鉴别困难,行肺叶切除术,系统性淋巴结清扫的意义并不大,所以目前该肿瘤合理的诊断和治疗方式仍在探索中,其治疗规范的建立有待对其生物学行为的进一步研究。
根据CMPT较为温和的组织学表现及对已有病例的随访和观察,目前认为CMPT是良性或具有低度恶性潜能的肿瘤,鉴于已报道的病例数较少及缺乏长期随访,对CMPT确切生物学行为的定性,仍有待于更多的病例研究和长期观察。
8 非经典型CMPT
但有CMPT也呈现出一定的恶性潜能特点,不完全符合CMPT的诊断标准,乳头状结构不明显,黏液细胞或纤毛柱状细胞缺如,但仍然有连续的基底细胞形成双层上皮结构,被称作所谓的非经典型CMPT,与腺癌具有较高相似性,所以极易诊断为腺癌,Chang等在2017年USCAP(the United States &Canadian Academy of Pathology)会上提出。目前非经典型CMPT的诊断标准尚未完全统一,其组织学形态特征如下:①肿瘤周边肺泡结构破坏,出现间质纤维化;②肿瘤细胞沿肺泡壁贴壁样生长;③出现微乳头样生长方式;④肿瘤呈不连续跳跃性生长方式;⑤无包膜、境界不清等。Miyai等人报道一例浸润性的CMPT病例,在经典的CMPT形态学背景中可见有浸润间质的梭形细胞成分,与基底细胞成分相延续,细胞核大而不规则,认为是CMPT中基底细胞的恶性转化,由此可见对于CMPT的生物学行为仍需探索。
与CMPT的临床特点和影像学对比发现,非经典型CMPT无明显区别。肺非经典型CMPT相对单一的组织学结构与高分化腺癌的区别非常重要,鉴别难度可能更大,因为纤毛的出现见于良性肿瘤,而非经典型CMPT通常缺乏纤毛,在大部分为黏液细胞成分为主的病例中会增加误诊为黏液腺癌的风险。关键在于仔细观察并识别连续的基底细胞,尤其在快速冰冻诊断中,另外非经典型CMPT瘤细胞温和,缺乏坏死与核分裂象也是鉴别要点,同时还缺乏肿瘤性促间质反应。非经典型CMPT常见的BRAF,EGFR,KRAS基因突变类型,但突变频谱无统计学差异。综上所述非经典型CMPT在临床经过、组织学表现及分子检测结果上与CMPT相近,它更多可能是组织形态学分化上重现细支气管至末端肺泡黏膜结构。因此非经典型CMPT与CMPT属于一类病变家族,它的出现极大地扩展了CMPT的形态学谱系。然而基于CMPT命名要求,有研究建议使用“so-called non-classic ciliated muconodular papillary tumors”命名来弥补这样的不足,同时也有研究推荐使用“细支气管肺泡上皮腺瘤”来囊括这一谱系病变。
9 小结
CMPT作为一种新近发现的肺部肿瘤,由于其发病罕见,国内外报道的病例数并不多。CMPT为发生在外周肺纤毛柱状上皮细胞来源的良性或具有低度恶性潜能肿瘤。虽然我们对CMPT的临床病理学特征、分子生物学特点及预后有了一定了解,但对于CMPT 的发病机制及预后转归仍有待于更多样本的深入研究。希望胸外科医师及病理科医师可提高对该疾病的认识,尽可能避免在临床工作中出现误诊。
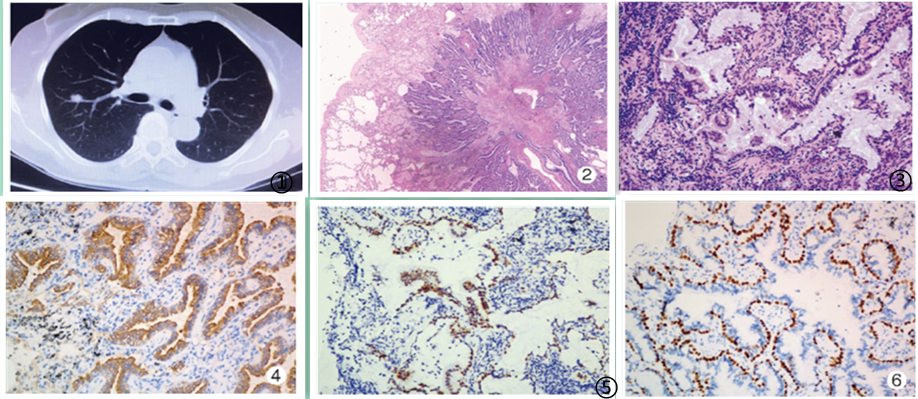 图1 影像学,肿瘤位于外周小结节,图2 低倍镜下肿瘤组织主要排列成腺管状或乳头状结构,沿肺泡壁呈不连续地生长,图3 高倍镜下肿瘤细胞包括基底细胞、纤毛柱状细胞及黏液细胞,这3种肿瘤按不同比例混合组成;图4 纤毛柱状细胞CK7强阳性,图5 纤毛柱状细胞TTF1弱阳性,图6 基底细胞P63核阳性。
图1 影像学,肿瘤位于外周小结节,图2 低倍镜下肿瘤组织主要排列成腺管状或乳头状结构,沿肺泡壁呈不连续地生长,图3 高倍镜下肿瘤细胞包括基底细胞、纤毛柱状细胞及黏液细胞,这3种肿瘤按不同比例混合组成;图4 纤毛柱状细胞CK7强阳性,图5 纤毛柱状细胞TTF1弱阳性,图6 基底细胞P63核阳性。
参考文献略,图片来源于网络,如有侵权,联系删除。














共0条评论