【摘要】
SWI/SNF染色质重塑复合物是一个大的多亚基蛋白质组件,以ATP依赖的方式协调染色质压缩和基因转录的可及性。作为一种关键的表观遗传调节因子,SWI/SNF复合物协调基因表达、细胞增殖和分化,其生物学功能在一定程度上拮抗多梳蛋白抑制复合物2(polycomb repressive complex 2)。哺乳动物SWI/SNF复合物由29个基因编码的15个亚单位组成,其中一些在人类癌症胚系或散发性背景(germline or sporadic setting)中重现性突变。大多数SWI/SNF缺陷肿瘤具有“横纹肌样”细胞形态。SMARCB1 (INI1)是软组织肿瘤中最常见的失活亚单位。具体来说,SMARCB1缺乏是几乎所有恶性横纹肌样肿瘤以及大多数上皮样肉瘤和低分化脊索瘤的遗传标志。此外,部分肌上皮癌(10-40%)、骨外粘液样软骨肉瘤(20%)、上皮样神经鞘瘤(40%)和上皮样恶性外周神经鞘瘤(70%)显示SMARCB1丢失。编码SS18亚单位的基因参与SS18-SSX重排,该重排是滑膜肉瘤的病理特征并间接使SMARCB1失活。最后,未分化的SMARC4缺陷型胸腔肉瘤由SMARC4亚单位失活定义,导致SMARC 4和SMARCA2丢失。很少替代的但生物学上等价的关键调节因子的失活可以替代典型的亚单位缺乏,例如SMARCB1保留上皮样肉瘤中的SMARCA4失活。这篇综述简要强调了SWI/SNF复合物的生物学功能及其在人类癌症中的作用,并详细介绍了与典型SWI/SNF复合物缺陷相关的软组织肿瘤的最新进展,包括形态学、基因组学和免疫组织化学的发现。
【SWI/SNF染色质重塑复合物及其在癌症中的作用】
ATP依赖的染色质修饰最初是在酵母中发现的,随后的研究揭示了果蝇、脊椎动物和包括人类在内的哺乳动物的类似机制。哺乳动物SWI/SNF染色质重塑复合物是一个大的多单位蛋白质组件,分子量约为2MDa,由29个基因编码的15个高度保守的亚单位组成。SWI/SNF复合物作为一种关键的表观遗传修饰物发挥作用,并协调染色质的压缩和分解,以实现DNA复制和选择性基因转录、DNA修复和重组的可及性。SWI/SNF复合物的催化活性促进与活性转录相关的开放染色质状态,并在生物学上对抗在多种癌症中具有不同作用的多梳蛋白抑制复合物2(PRC2),例如恶性外周神经鞘瘤。超过20%的儿童和成人实体瘤和恶性血液病的特征是SWI/SNF综合征缺乏。针对某些亚单位的基因组突变可以是杂合的,也可以是纯合的,发生在体细胞或种胚系背景中,包括缺失、点突变和易位。癌症中的SWI/SNF复合物功能障碍可导致肿瘤抑制因子的功能丧失或致癌机制的功能增加。
【SWI/SNF复合物缺陷性软组织肿瘤】
选择几种SWI/SNF复合物缺陷性软组织肿瘤在这里详细讨论。这些肿瘤大多由具有典型横纹肌样细胞形态和间变性大细胞或小圆细胞特征的单一形态未分化上皮样细胞组成。鉴于其在协调细胞分化和增殖中的作用,SWI/SNF复合物的失活通常导致未分化的细胞状态,这可能是大多数SWI/SNF复合物缺陷性肿瘤中普遍单一的未分化细胞形态的原因。因为横纹肌样形态是SWI/SNF复合物缺陷性肿瘤的特征,所以结合SWI/SNF亚单位缺陷的免疫组织化学检测,其识别有助于未分化上皮样(和上皮)肿瘤的诊断。SWI/SNF复合物缺陷性软组织肿瘤的细胞形态包括横纹肌样、间变性大细胞、小细胞、黏液软骨样和异源性分化(Heterogeneous differentiated)。
(一)SMARCB1缺陷性软组织肿瘤
SMARCB1亚单位是软组织肿瘤中基因组失活最常见的靶点。在几乎所有恶性横纹肌样瘤以及大多数上皮样肉瘤和低分化脊索瘤的病例中,SMARCB1缺乏都被视为遗传标志(表1)。此外,部分肌上皮癌、骨外黏液样软骨肉瘤和上皮样外周神经鞘瘤存在SMARCB1失表达(表1)。虽然这里没有详细讨论,但SS18-SSX癌蛋白标志已被证明间接灭活滑膜肉瘤中的SMARCB1,在滑膜肉瘤中,它导致SSX获得SS18,并与野生型SS18竞争组装,形成缺乏SMARCB1肿瘤抑制因子的改变的复合物。因此,滑膜肉瘤代表了另一种肉瘤,其特征是SWI/SNF异常和SMARCB1功能因亚单位装配受损而丧失。SMARCB1基因组扰动不仅作为癌症中的体细胞事件发生,而且在胚系背景中也发生:SMARCB1突变已在几个遗传性SWI/SNF缺陷综合征中被鉴定,这些综合征倾向于发展为恶性横纹肌样瘤、家族性神经鞘瘤病或SWI/SNF相关脑膜瘤,这些将不在此进一步讨论。
表1:伴SWI/SNF复合物缺陷性的间叶性肿瘤概述
(1)恶性横纹肌样瘤
临床特征:恶性横纹肌样瘤比较少见,主要发生于婴幼儿和低龄儿童,少数为先天性或具有家族史,成人罕见。发病部位为椎旁、颈部、腹膜后、会阴、盆腹腔、肝脏、胃肠道、膀胱、胸腺、心脏、偶尔也可发生于皮肤等。值得注意的是,发生于皮肤的横纹肌样瘤(图1),临床容易误诊为血管瘤,患者可表现为血管瘤样肿块伴溃疡形成。横纹肌样瘤预后极差,5年生存率小于50%。
组织学特征:典型的横纹肌样瘤镜下表现为肿瘤侵袭性生长,边界不清,由不相黏附的巢状或实性片状的大圆形或多边形横纹肌样细胞组成,其特点是瘤细胞核大,圆形、卵圆形或肾形,偏位,染色质呈空泡状,内含明显的大核仁(图2),核分裂象易见。胞质丰富,嗜伊红色,内含PAS染色阳性的球形毛玻璃样包涵体。肿瘤内常见坏死。偶见假乳头状形态,其他瘤细胞形态学改变包括胞质透明或瘤细胞呈上皮样或梭形等,可见黏液样基质,破骨细胞样巨细胞。部分病例表现为未分化小圆细胞形态,只有少数横纹肌样细胞簇状或单个散在分布于整个肿瘤内,造成小标本活检诊断的困难。
图1:儿童皮肤横纹肌样瘤,临床诊断为血管瘤(图片来自作者)
 图2:肿瘤细胞呈空泡状,核仁明显,胞质丰富嗜酸性,部分可见包涵体(图片来自作者)
图2:肿瘤细胞呈空泡状,核仁明显,胞质丰富嗜酸性,部分可见包涵体(图片来自作者)
特殊染色:细胞质内含抗淀粉酶的PAS染色阳性物。
免疫表型:肿瘤细胞表达CK(大部分是表达低分子角蛋白CK8和CK18)、EMA、Vimentin,50%左右的病例表达CD99和syn,偶尔表达SALL4或局灶表达S-100,特征性但不特异的是瘤细胞核缺乏INI1的表达(内对照:血管内皮细胞和淋巴细胞INI1核阳性)(图3),肿瘤细胞不表达desmin、HMB-45、MART-1、CD31、CD34和myogenin。
 图3:软组织横纹肌样瘤,肿瘤细胞INI1阴性表达,间质细胞核阳性表达(图片来自作者)
图3:软组织横纹肌样瘤,肿瘤细胞INI1阴性表达,间质细胞核阳性表达(图片来自作者)
分子遗传学特征:染色体22q11.2单倍体或缺失,一例患者染色体核型为46,X,t(X;22;11) (q13;q11.2;q14.2)。
超微结构:瘤细胞多为分化较为原始的细胞,胞质内细胞器稀少。瘤细胞核旁胞质内的细胞器被直径为8~10nm的中间丝所代替,中间丝排列成旋涡状或束状结构,与光镜的包涵体一致,还见中等量的粗面内质网,少量线粒体、溶酶体和游离核糖体。
鉴别诊断:INI1蛋白表达缺失是肾外横纹肌样瘤的特征性标志物,然而INI1的缺失也可以发生在上皮样肉瘤等,而且具有横纹肌样细胞形态的肿瘤较多,主要与以下肿瘤进行鉴别:
(1)横纹肌肉瘤:瘤细胞形态多种多样,当瘤细胞逐渐向成熟方向分化时,胞质增多,因肌原纤维聚集而呈嗜伊红色。肿瘤细胞表达结蛋白等肌源性标志物。
(2)近端型上皮样肉瘤:瘤细胞也可呈横纹肌样,但近端型上皮样肉瘤多见于中青年,肿瘤镜下呈多结节性的生长方式,由大圆形的上皮样细胞组成,瘤细胞表达β-catenin和CD34。
(3)透明细胞肉瘤:当横纹肌样瘤出现胞质透明的肿瘤细胞时应与透明细胞肉瘤鉴别。后者是一种具有色素细胞分化的软组织肿瘤,多见于20~40岁青年人,好发于四肢末端。肿瘤细胞表达S-100蛋白和HMB45可与肾外横纹肌样瘤鉴别。
(4)肌上皮癌:肿瘤细胞可以表现为横纹肌样细胞形态,但瘤细胞表达肌上皮标记物S100、SMA、GFAP和calponin。50%病例存在EWSR1基因断裂重排。
(5)上皮样恶性外周神经鞘瘤:可表现为横纹肌样细胞形态,并具有突出核仁。大部分病例上皮样恶性外周神经鞘瘤S-100阳性和CK阴性表达。
(6)促结缔组织增生性小圆细胞肿瘤:多见于儿童和青少年,少数病例可出现横纹肌样肿瘤细胞,但肿瘤细胞INI1 阳性和t(11;22)(p13;q12)基因易位可与横纹肌样瘤鉴别。
(7)滑膜肉瘤:极少数发生于肾脏或软组织的滑膜肉瘤可有横纹肌样细胞形态并INI1弱表达或表达缺失;此外,滑膜肉瘤弥漫强表达TLE1,极少数横纹肌样瘤可弥漫表达TLE1,但强弱不等(图4)。
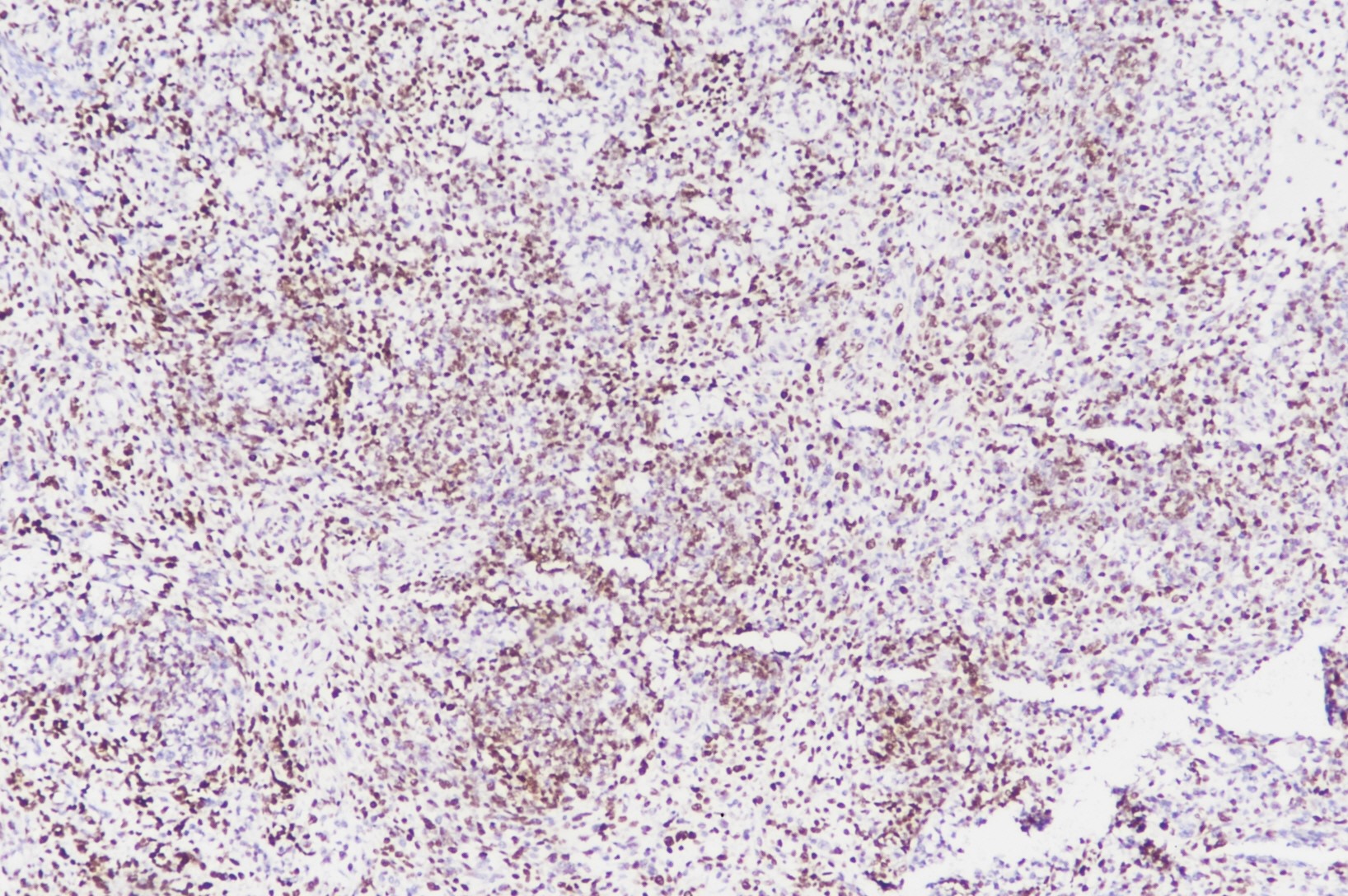 图4:儿童肾脏横纹肌样瘤,TLE1弥漫强弱不等阳性(图片来自作者)
图4:儿童肾脏横纹肌样瘤,TLE1弥漫强弱不等阳性(图片来自作者)
【主要参考文献】
[1] SWI/SNF complex-deficient soft tissue neoplasms: An update. Seminars in Diagnostic Pathology,2020. https://doi.org/10.1053/j.semdp.2020.05.005.


















共0条评论