【摘要】儿童胶质瘤在生物学上与成人胶质瘤不同。尽管最近的文献发现了新的基因改变,
但这些发现对预后的影响仍不清楚。美国哈佛医学院贝斯以色列女执事医疗中心病理系Ahrendsen J教授和哈佛医学院波士顿儿童医院病理科Alexandrescu S教授于2020年在《Surgical pathology clinics》杂志发表了题为《An Update on Pediatric Gliomas》的综述性文章,本文综述了关于儿童胶质瘤的组织学和分子特征的最新进展,这些特征与预后和/或治疗的关系。
【概述】脑肿瘤是目前儿童癌症相关死亡的主要原因。其中,低级别胶质瘤是最常见的(约占所有脑肿瘤的30%),并且与显著的发病率相关,而高级别胶质瘤是罕见的,但目前可用的治疗方法无法治愈。低级别和高级别的儿童胶质瘤在临床和生物学上都不同于成人胶质瘤,关于其组织学分级、具体分类和预后,目前还没有足够的公开指南。这篇文章包括最近低级别和高级别儿童胶质瘤的诊断,遗传学和预后发现。出于实用目的,大多数被世界卫生组织(WHO)归类为I级或II级的肿瘤为低级别胶质瘤,而WHO组织学级别为III或IV的肿瘤通常为高级别胶质瘤。本文先学习儿童低级别胶质瘤,主要内容翻译如下:
(一)儿童低级别胶质瘤
儿童低级别胶质瘤(Pediatric low-grade gliomas,PLGGs)是儿童最常见的脑肿瘤,占中枢神经系统肿瘤的30%。尽管死亡率较低,但由于其高发病率和多次复发,它们是一个重大挑战。PLGGs在临床和生物学上都不同于成人低级别胶质瘤。成人弥漫性胶质瘤以IDH突变为特征,但这些突变在儿童中很少见;几乎所有的PLGGs都是由影响有丝分裂原激活蛋白激酶(MAPK)信号通路的基因改变驱动的,其中BRAF改变最为常见。本文综述了毛细胞型星形细胞瘤、毛细胞黏液样星形细胞瘤、血管中心性胶质瘤、多形性黄色瘤型星形细胞瘤以及具有独特组织学和分子结果的新兴实体。
(1)毛细胞型星形细胞瘤
在PLGGs中,毛细胞型星形细胞瘤(pilocytic astrocytoma,PA)是最常见的,占所有儿童和成人胶质瘤的5.4%。它可以发生在神经轴的任何地方,但有一个倾向于后颅窝,更具体地说是小脑。放射学上,PA表现为界限清楚的实性和囊性肿瘤,增强扫描。组织学上,PAs是由双极的,轻度非典型的细胞组成,细胞核卵圆形(图1A)。它们通常是双相肿瘤,有富细胞区与细胞较少且有黏液样背景的病灶交替出现。局灶性少突胶质细胞样形态很常见(图1B)。Rosenthal纤维和嗜酸性颗粒体通常存在,以线性微血管增生为边界的假性囊肿是常见的;在PA背景下,微血管增生不应引起对高级别胶质瘤的关注。偶尔,PAs有轻度或中度高的核分裂象和增殖指数,这是公认的特征,与更高级别的病变无关。 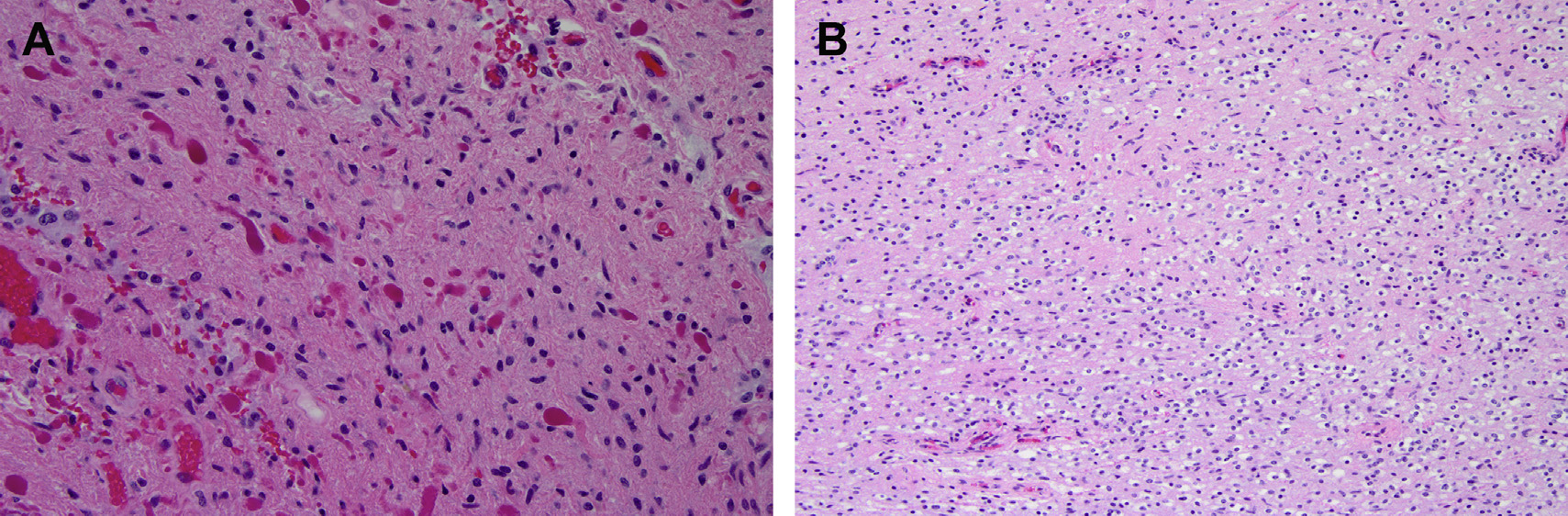 图1 PA.(A)PAs由圆形至卵圆形的轻度非典型细胞核和具毛状突起的细胞组成。Rosenthal纤维很常见。(B)PAs有时表现为少突胶质细胞瘤样特征。
图1 PA.(A)PAs由圆形至卵圆形的轻度非典型细胞核和具毛状突起的细胞组成。Rosenthal纤维很常见。(B)PAs有时表现为少突胶质细胞瘤样特征。
大多数PAs通过许多改变激活MAPK信号,其中最常见的是7q34处的串联重复,导致KIAA1549-BRAF融合,98%的后颅窝病例都有这种现象。BRAF的重复可以通过荧光原位杂交、阵列比较基因组杂交或融合分析来观察。尽管BRAF串联重复仍然是最常见的独立于位置的事件,但最近的研究描述了许多其他导致MAPK通路激活的基因改变:BRAF V600E突变、BRAF基因内缺失和插入、NTRK融合、FGFR1和KRAS点突变。PA是神经纤维瘤病1型(NF1)最常见的中枢神经系统肿瘤;在这种背景下,最常见的部位是视神经通路。虽然NF1是以常染色体显性遗传,但大约三分之二的NF1病例是由编码神经纤维蛋白的NF1基因的散发性突变引起的。NF1患者只有1个功能性NF1基因。与NF1综合征相关的PAs中的第二次打击是通过点突变或杂合性丢失发生的。很少情况下,PA可能是Noonan综合征的症状,这是由MAPK通路基因的胚系突变引起的,最常见的是PTPN11。PA预后良好,95%以上患者术后存活5~10年。组织学分级通常保持不变,只有极少数病例发展为间变性组织学,通常是在放疗或化疗后。肿瘤的位置和切除能力是影响预后的关键因素。
(2)毛细胞黏液样星形细胞瘤
毛细胞黏液样星形细胞瘤(Pilomyxoid astrocytoma,PMA)好发于婴幼儿,中位年龄10个月。最常见的位置是下丘脑/视神经通路,尽管PMA可以在神经轴的任何地方出现。该肿瘤先前被认为是一个组织学上属于WHO II级的独特实体,因为其预后可能不如PA好。最近的研究表明,PMA和PA具有相似的生物学背景;因此,2016年WHO对CNS肿瘤的分类将其描述为PA的一种组织学变异型,没有指定等级。在组织学上,PMA有明显的黏液样背景,细胞排列成星状,血管中心型。与PA不同,PMA缺乏Rosenthal纤维和嗜酸性颗粒体。文献推测,他们更具攻击性的行为是由年轻的表现和肿瘤位置引起的,这往往使完全切除成为不可能。
(3)多形性黄色瘤型星形细胞瘤
多形性黄色瘤型星形细胞瘤(Pleomorphic xanthoastrocytoma,PXA)是发生于儿童和年轻成人的一种实性、非浸润性、致癫痫的肿瘤。它通常发生在颞叶浅部,累及皮质、浅表白质,有时还发生于软脑膜;然而,它也可能发生在中枢神经系统的任何地方。在组织学上,PXA由纺锤形胶质细胞和奇异的,有时是多核的细胞混合而成(图2A,B)。黄色瘤样改变和散在的嗜酸性颗粒体是常见的(图2C),肿瘤在单个细胞周围形成了一个特征性的富含网织蛋白的网络(reticulin-rich network)(未显示)。虽然PXA被认为是WHOⅡ级肿瘤,在完全手术切除后预后良好,但偶尔会出现核分裂象(每10个高倍视野中有4个或更多)和坏死,提示将PXA分为WHO Ⅲ级。有时间变性PXAs有时具有上皮样细胞形态,使其与上皮样胶质母细胞瘤难以区分(图2D)。在这种情况下,典型PXA的局部特征包括嗜酸性颗粒体,表明是间变性PXA。
大约50%到78%的PXAs有BRAF点突变,临床实践中最常见的是免疫组化检测BRAF V600E用作特定突变的替代物(图2E)。PXA另一个常见的改变是50%的病例存在9号染色体的丢失。60%的PXAs存在CDKN2A/2B纯合性缺失。Phillips和他的同事最近的一项研究显示15例间变性PXA中有7例发生了TERT改变(热点突变和扩增)。
PXA的诊断具有挑战性,尤其是当组织学为间变性或肿瘤没有BRAF V600E突变时。在这种情况下,为了将这些病例与其他胶质瘤特别是胶质母细胞瘤区分开,需要全面的分子鉴定。Phillips及其同事描述了2例无BRAF V600E的间变性PXA存在ATG7-RAF1和NRF1-BRAF基因融合。
间变性上皮样PXA和上皮样胶质母细胞瘤的鉴别是实践中的一个挑战;这些肿瘤的影像学特征、组织学和分子背景通常难以区分。两种肿瘤都是由胞质丰富的大细胞和核仁明显的细胞核组成的实体瘤。与PXA一样,上皮样胶质母细胞瘤往往位于浅表,并累及软脑膜。有趣的是,它们都有BRAF V600E突变和局灶/片状EMA免疫阳性(图2F)。
Korshunov和他的同事最近的一项研究表明,根据甲基化分析,上皮样胶质母细胞瘤分层为已建立的诊断类别,其中一部分儿童胶质母细胞瘤与PXAs为一类,预后良好(A recent study by Korshunov and colleagues showed that epithelioid glioblastomas stratify into established diagnostic categories on clustering methylome analysis, with a subset of pediatric glioblastomas clustering with PXAs and having a good prognosis.)。 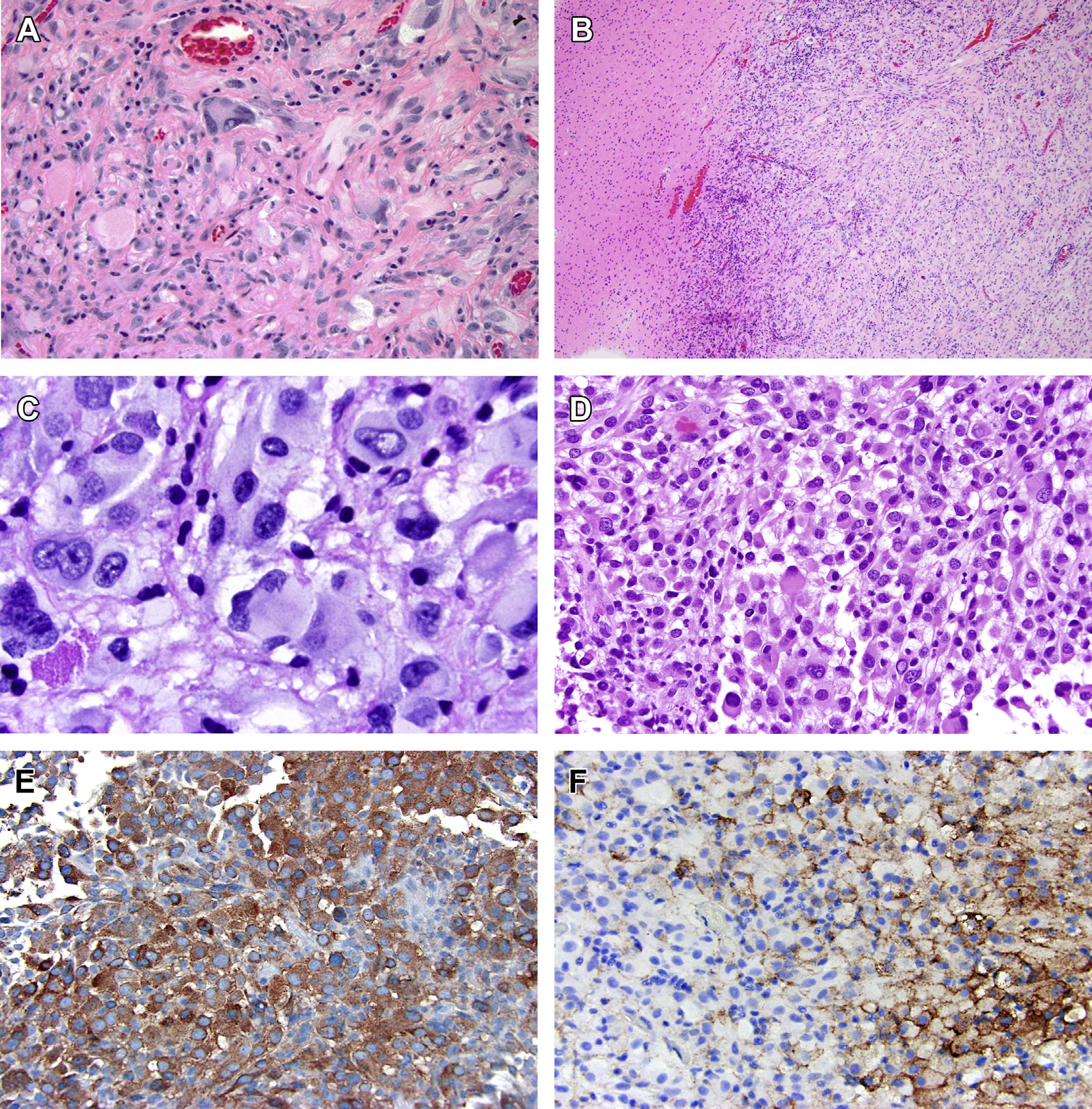 图2 PXA:(A)PXA由纺锤形和奇异的细胞组成,其中一些细胞的细胞质呈脂状。淋巴细胞可以出现在血管周围并与肿瘤混合。(B)通常PXA和周围的大脑之间有一个明显的界限。(C)嗜酸性颗粒体在PXA中是一种常见的表现,而PAS特殊染色可使其更加明显。(D)上皮样PXA由丰富嗜酸性细胞质、偏心核、核仁明显,细胞边界明显的瘤细胞组成。(E)大多数PXAs免疫组化检测BRAF V600E呈阳性表达。(F)上皮样PXAs中上皮膜抗原(EMA)呈片状阳性表达。
图2 PXA:(A)PXA由纺锤形和奇异的细胞组成,其中一些细胞的细胞质呈脂状。淋巴细胞可以出现在血管周围并与肿瘤混合。(B)通常PXA和周围的大脑之间有一个明显的界限。(C)嗜酸性颗粒体在PXA中是一种常见的表现,而PAS特殊染色可使其更加明显。(D)上皮样PXA由丰富嗜酸性细胞质、偏心核、核仁明显,细胞边界明显的瘤细胞组成。(E)大多数PXAs免疫组化检测BRAF V600E呈阳性表达。(F)上皮样PXAs中上皮膜抗原(EMA)呈片状阳性表达。
(4)血管中心性胶质瘤
血管中心性胶质瘤于2005年被王和他的同事首次描述为一种浸润性低级别致癫痫性脑胶质瘤,MRI显示T2高信号。肿瘤是由双极细胞组成的,双极细胞具有细长的细胞核,浸润到脑组织中,显示出血管中心性(图3)。胶质免疫标记物阳性。核分裂象不易发现,坏死和微血管增生通常不常见。在王和他同事的研究中,除了1例患者外,所有患者在手术切除后都无病生存,随访时间从几天到62个月不等。最近,MYB-QKI基因融合被认为是大多数血管中心性胶质瘤的决定性基因改变。2016年世卫组织对血管中心性胶质瘤的定义是一级脑肿瘤;然而,2017年,3篇几乎同时发表的文章描述了发生在脑干的血管中心性胶质瘤,挑战了世界卫生组织的定义。
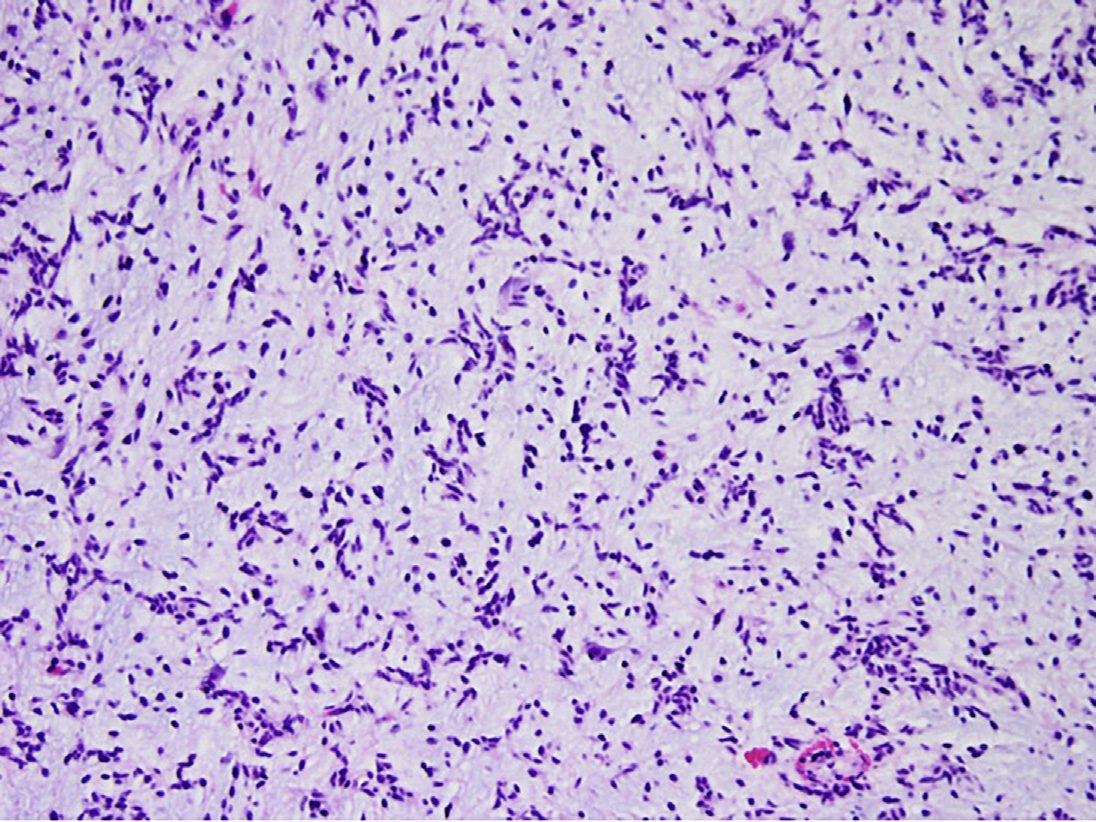 Fig. 3. Angiocentric glioma. Angiocentric glioma is an infiltrative low grade epileptogenic neoplasm with elongated, mildly atypical cells that display angiocentric arrangement in a myxoid background stroma.
Fig. 3. Angiocentric glioma. Angiocentric glioma is an infiltrative low grade epileptogenic neoplasm with elongated, mildly atypical cells that display angiocentric arrangement in a myxoid background stroma.
图3 血管中心性胶质瘤:血管中心性胶质瘤是一种浸润性低级别致癫痫性肿瘤,细胞细长,轻度非典型,在黏液样基质中呈血管中心排列。
(5)儿童低级别胶质瘤新发现的分子改变
儿童人群中的弥漫性低级别胶质瘤很难在一个特定的类别中进行分类;它们挑战了主要适用于成人弥漫性胶质瘤的WHO分级系统。儿童弥漫性低级别胶质瘤通常无IDH、ATRX和p53突变,而且通常没有1p/19q全臂共缺失。综合临床分子研究的应用导致了弥漫性低级别胶质瘤的FGFR点突变和融合、NTRK融合,以及更罕见的涉及意想不到的基因融合,如EWSR1和BCOR。
除了具有FGFR点突变的PA(主要是p.N546K和p.K656E),FGFR1点突变和FGFR融合可以出现在儿童弥漫性胶质瘤的神经轴的任何位置。最常见的融合基因是FGFR1-TACC1、FGFR2-CTTNA3和FGFR3-TACC3融合。另一种常见的儿童胶质瘤FGFR改变是 FGFR1 TKD。根据作者的一个经验(S.A.),FGFR1-TACC1和FGFR3-TACC3基因融合在低级别和高级别的儿童弥漫性胶质瘤中都可以看到(图4A,B)。
根据作者的经验,FGFR2-CTTNA3基因融合的胶质瘤具有共同的临床、放射学、组织学和分子生物学特征。患者通常表现为癫痫发作和半球肿块(hemispheric mass)(图4C);显微镜检查显示浸润性胶质瘤,细胞带有斑点状染色质和核周透亮(oligolike features,少突样特征)、丰富的精细血管网和散在的钙化(图4D)。肿瘤细胞对胶质标记物呈弥漫性阳性(图4E),有时可显示弥漫性CD34免疫阳性(图4F),类似于Huse和同事所描述的发生于年轻人多形性低级别神经上皮肿瘤(polymorphous low-grade neuroepithelial tumor,PLNTY)。在这项研究中,10例肿瘤被诊断为PLNTY,随访时间从12个月到89个月,一个病人在全切除36个月后有新的癫痫发作和进展;其余的病人在手术治疗后没有疾病迹象,类似于世卫组织I级胶质瘤的临床病程。没有FGFR2-CTNNA3基因融合的肿瘤具有BRAF V600E突变,或FGFR2-KIAA1549基因融合;它们都有相似的生物学行为。
原肌球蛋白相关激酶(TRK)基因的改变主要见于成人和婴儿胶质母细胞瘤。作者在工作中遇到了各种级别的NTRK基因重排的儿童弥漫性胶质瘤;其组织学似乎因病例而异,组织学与特定的NTRK基因或融合伙伴之间似乎没有相关性,尽管需要对大量NTRK基因重排胶质瘤进行具体研究才能得出有意义的结论。为了显示NTRK重排胶质瘤的组织学特征范围,图5显示了2例,1例为低级别,1例为高级别。目前,尚无明确的研究描述NTRK基因融合胶质瘤患者的预后。尽管pan-TRK抗体在间叶性肿瘤中的应用越来越广泛,但其在神经病理学实践中的应用需要考虑到正常大脑表达TRK蛋白,并且在正常情况下是阳性的,因此免疫反应不是胶质瘤发生基因重排的客观指标。
随着分子模式的增加,在软组织肿瘤中EWSR1和新伴侣之间的融合已被描述。直到2019年,Siegfried和他的同事报告了一例脑室内胶质瘤,并伴有EWSR1-PATZ1基因融合(EWSR1的第8外显子和PATZ1的外显子1),EWSR1的改变才在胶质瘤中得到描述。肿瘤的组织学表现为低级别,具有细胞增多,多形性,玻璃样变血管网丰富区域。肿瘤细胞OLIG2阳性,胶质纤维酸性蛋白(GFAP)和突触素呈局灶性阳性。甲基化分析表明,该肿瘤不同于所有其他描述良好的实体。此外,3项针对儿童和成人胶质瘤的大规模测序研究包含3个经EWSR1-PATZ1基因融合的胶质瘤,其中1个被描述为高级别。然而,这些研究不评论组织学和结果,也不推测这些肿瘤是否代表一个新的实体。本文的资深作者(S.A.)遇到的一例脑室内胶质瘤具有EWSR1-PATZ1基因融合(图6)。组织学与Siegfried及其同事在病例1中描述的相似:肿瘤富于细胞并多形性增加,血管网丰富,但缺乏微血管增生,核分裂象罕见,无坏死,提示诊断为低级别胶质瘤。与Siegfried及其同事的病例不同,这个病例没有神经元特征(neuronal features)。
 图4 (A,B)一例伴有FGFR3-TACC3基因重排的弥漫性儿童胶质瘤:由少突胶质细胞样细胞组成,细胞核呈圆形和卵圆形,核周透亮,偶见纤细血管(H&E)。(C-F)一例17岁患者中一例多形性低级别神经上皮肿瘤伴有FGFR2-CTNNB1基因重排。(C)T2液体衰减反转恢复MRI显示左额叶浸润性浅表肿瘤。(D)胶质瘤由轻到中度核异型性的细胞组成,偶尔有微囊和纤细的血管腔(H&E)。(E)OLIG2免疫染色呈弥漫性表达,(F)肿瘤细胞呈EMA免疫阳性。无核分裂象、微血管增生和坏死。
图4 (A,B)一例伴有FGFR3-TACC3基因重排的弥漫性儿童胶质瘤:由少突胶质细胞样细胞组成,细胞核呈圆形和卵圆形,核周透亮,偶见纤细血管(H&E)。(C-F)一例17岁患者中一例多形性低级别神经上皮肿瘤伴有FGFR2-CTNNB1基因重排。(C)T2液体衰减反转恢复MRI显示左额叶浸润性浅表肿瘤。(D)胶质瘤由轻到中度核异型性的细胞组成,偶尔有微囊和纤细的血管腔(H&E)。(E)OLIG2免疫染色呈弥漫性表达,(F)肿瘤细胞呈EMA免疫阳性。无核分裂象、微血管增生和坏死。  图5 NTRK基因重排胶质瘤:(A-D)一名21岁患者脑岛NTRK基因重排低级别胶质瘤。(A)浸润性胶质瘤呈富细胞巢状排列,与低细胞区混合。(B)细胞具有少突胶质细胞样特征和轻度的核异型性。未见核分裂象、坏死或微血管增生。(C)OLIG2免疫染色呈弥漫性阳性,Ki67增指数为1%~2%。(E-H)一名4岁患者顶叶NTRK基因重排高级胶质瘤。(E,F)表现为致密细胞肿瘤,由卵圆形、中度非典型细胞核的细胞组成。偶见核分裂象,可见微血管增生灶。
图5 NTRK基因重排胶质瘤:(A-D)一名21岁患者脑岛NTRK基因重排低级别胶质瘤。(A)浸润性胶质瘤呈富细胞巢状排列,与低细胞区混合。(B)细胞具有少突胶质细胞样特征和轻度的核异型性。未见核分裂象、坏死或微血管增生。(C)OLIG2免疫染色呈弥漫性阳性,Ki67增指数为1%~2%。(E-H)一名4岁患者顶叶NTRK基因重排高级胶质瘤。(E,F)表现为致密细胞肿瘤,由卵圆形、中度非典型细胞核的细胞组成。偶见核分裂象,可见微血管增生灶。 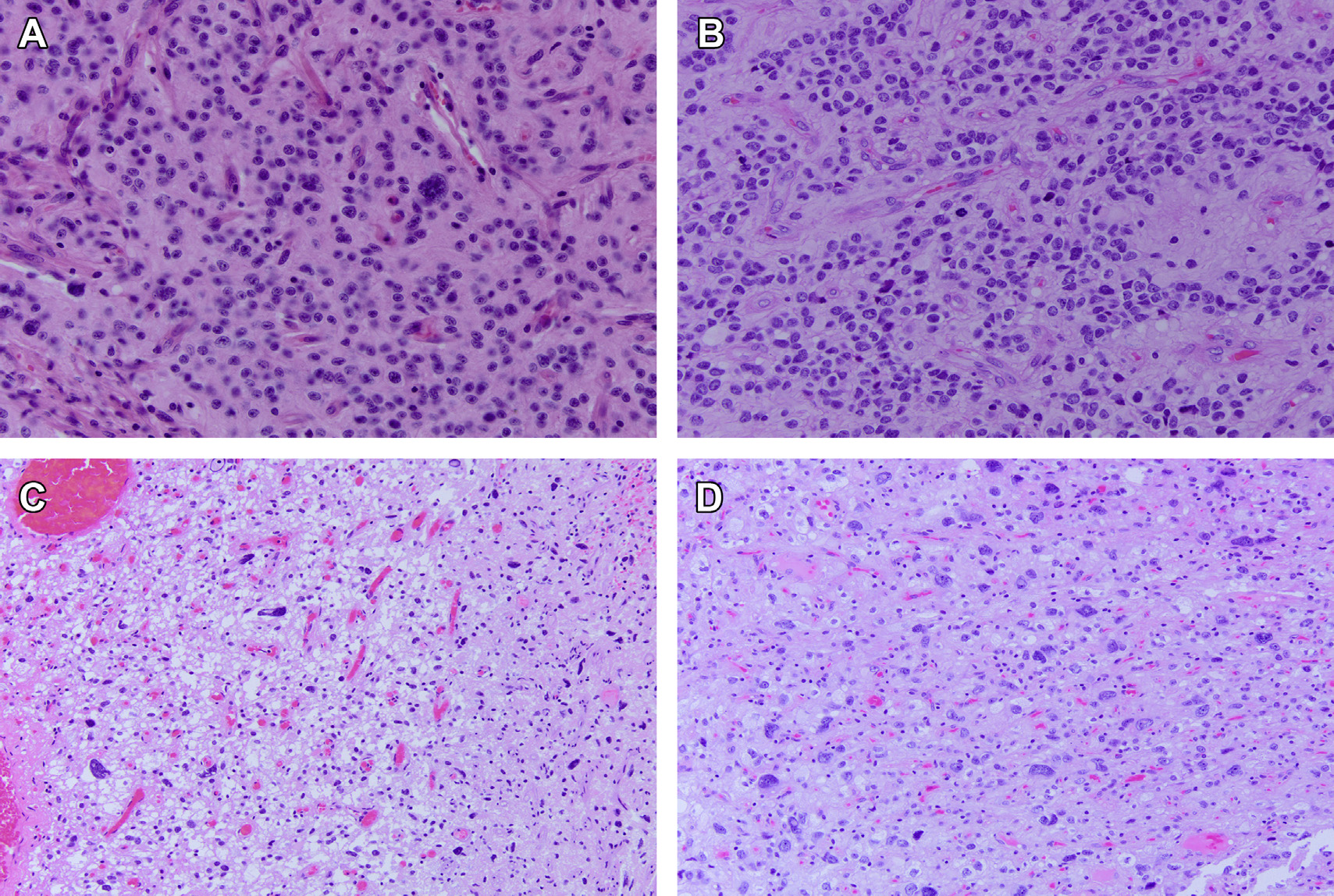 图6 伴有EWSR1-PATZ1基因重排的胶质瘤:这个病例的组织学变化很大,少突胶质细胞样区域和丰富的纤细血管网(A)与细胞单一且有模糊假菊形团的区域混合(B)。一些病灶类似于低级别胶质瘤,具有黏液样基质背景,细胞呈梭形,有些具有核异型性(C)和散在的神经节样细胞(D)。
图6 伴有EWSR1-PATZ1基因重排的胶质瘤:这个病例的组织学变化很大,少突胶质细胞样区域和丰富的纤细血管网(A)与细胞单一且有模糊假菊形团的区域混合(B)。一些病灶类似于低级别胶质瘤,具有黏液样基质背景,细胞呈梭形,有些具有核异型性(C)和散在的神经节样细胞(D)。
(6)伴异柠檬酸脱氢酶突变的儿童胶质瘤
世界卫生组织根据是否存在异柠檬酸脱氢酶(IDH)突变对弥漫性浸润性胶质瘤进行分组,对弥漫性星形细胞瘤(具有同时发生的TP53和ATRX突变)或少突胶质瘤(由存在IDH突变和1p/19q全臂共缺失)分类。实际上,弥漫性浸润性胶质瘤的诊断工作包括(1)免疫组化检测IDH1 R132H、p53和ATRX;(2)通过荧光原位杂交、阵列比较基因组杂交或聚合酶链反应分析1p/19q状态;以及,如果可行,(3)有针对性的下一代测序以识别分子致癌驱动突变和融合。
成人低级别浸润性胶质瘤几乎普遍由IDH1或IDH2突变引起,而IDH突变在儿童低级别胶质瘤中极为少见。一项具有里程碑意义的研究中,对149名患者的151例低级别胶质瘤进行了全基因组测序,在一名15岁患者中仅发现一个IDH突变肿瘤。Ferris和他的同事描述了3例年轻(9岁,9岁和7岁)弥漫性星形细胞瘤患者存在IDH突变。研究显示10岁以下儿童可能存在IDH突变;有趣的是,在这组病例中,有2名患者ATRX表达完整,缺乏ATRX和TERT启动子突变,这表明一些IDH突变的儿童胶质瘤可能与成人胶质瘤不同。
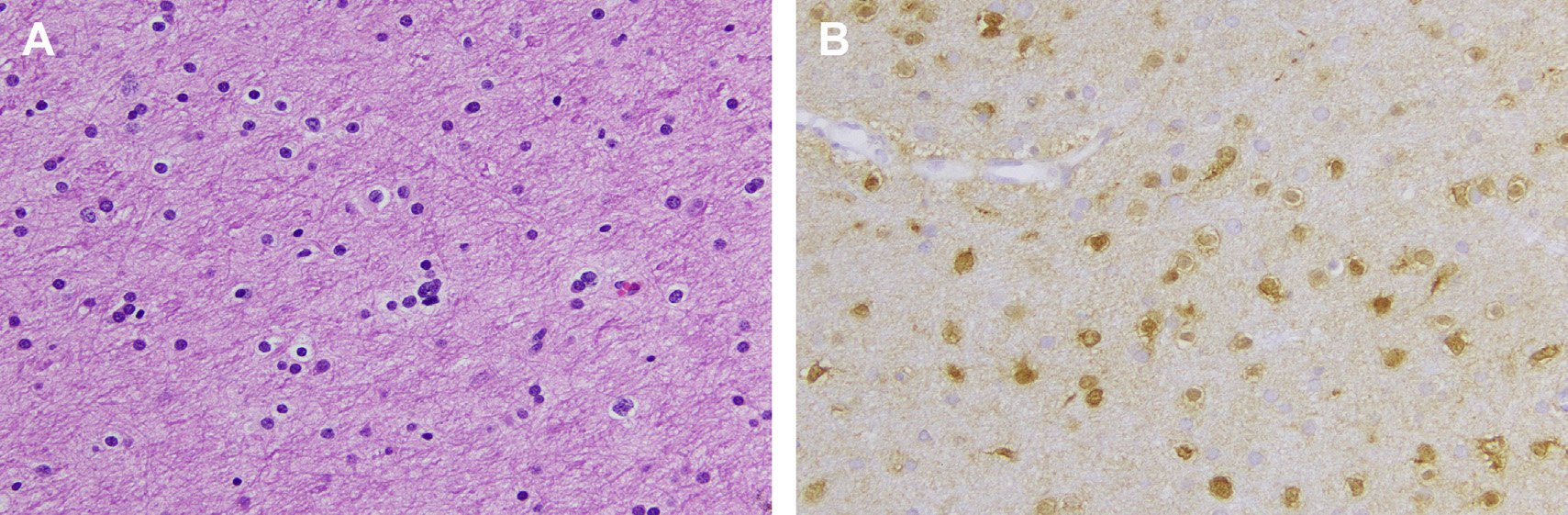 Fig. 7. Diffuse glioma, IDH1 (R132H) mutant. (A) A section of the white matter shows occasional minimally atypical nuclei; overall the histology is similar to that of a mildly reactive white matter. (B) An IDH1 immunostain highlights all the mutant cells.
Fig. 7. Diffuse glioma, IDH1 (R132H) mutant. (A) A section of the white matter shows occasional minimally atypical nuclei; overall the histology is similar to that of a mildly reactive white matter. (B) An IDH1 immunostain highlights all the mutant cells.
图7 伴IDH1(R132H)突变的弥漫性胶质瘤:(A)白质的一个部分偶尔显示出极不典型的细胞核;总的来说,组织学与轻度反应性白质相似。(B)所有突变细胞显示IDH1染色阳性。
【参考文献】
[1] An Update on Pediatric Gliomas. Surgical pathology clinics.2020,13(2): 217-233.doi:10.1016/j.path.2020.02.005.




















共0条评论