【摘要】儿童胶质瘤在生物学上与成人胶质瘤不同。尽管最近的文献发现了新的基因改变,
但这些发现对预后的影响仍不清楚。美国哈佛医学院贝斯以色列女执事医疗中心病理系Ahrendsen J教授和哈佛医学院波士顿儿童医院病理科Alexandrescu S教授于2020年在《Surgical pathology clinics》杂志发表了题为《An Update on Pediatric Gliomas》的综述性文章,本文综述了关于儿童胶质瘤的组织学和分子特征的最新进展,这些特征与预后和/或治疗的关系。儿童高级别胶质瘤的主要内容翻译如下:
(二)儿童高级别胶质瘤
儿童高级别胶质瘤的组织学特征与成人相似,但在生物学上却有所不同。近年来,在儿童高级别胶质瘤的基因谱方面取得了重大进展,这使得一些实体从组织学上相似的成人和儿童脑胶质瘤中分离出来。大多数儿童高级别胶质瘤是原发性的,儿童从低级别胶质瘤向高级别胶质瘤的转化率估计不到10%。
(1)先天性和婴儿高级别胶质瘤
在儿童高级别胶质瘤中,先天性和婴儿期胶质母细胞瘤有时在生物学上与这个年龄以后发生的不同。先天性高级别胶质瘤通常在产前超声检查中被发现为一个回声源性的,通常是半球的大肿块,产生中线移位和脑积水。从遗传学上讲,这些肿瘤与儿童期和成年期的高级别胶质瘤不同,它们往往有更好的预后;尽管它们可以携带PTEN缺失和TP53的突变,但EGFR扩增、IDH和组蛋白突变尚未被描述。最近发表的论文和临床观察表明,在一组先天性和婴儿高级别胶质瘤中,MET/ALK/ROS1/NTRK发生了改变。这一发现对治疗特别重要,因为ALK1抑制剂在一些成人恶性肿瘤中被使用,而且也有对胶质母细胞瘤株的实验研究。图8A,B显示ALK基因重排的先天性胶质母细胞瘤。在婴儿期之后,组蛋白H3(最常见的H3F3A、HIST1H3B和G34V/R)、BRAF、NTRK和BCOR的改变是儿童弥漫性高级别胶质瘤的致癌因素。
(2)组蛋白H3突变胶质瘤
起源于中线结构的弥漫性浸润性肿瘤,常有H3K27M突变,这类肿瘤与侵袭性生物学行为和不良临床结局有关。该组包括大多数弥漫性内生性脑桥胶质瘤(diffuse intrinsic pontine gliomas,DIPGs),许多中线胶质母细胞瘤,以及一小部分位于中线结构的低级别弥漫性星形细胞瘤。因此,2016年,这些肿瘤无论其组织学形态如何,均被现行WHO指南(弥漫性中线胶质瘤,K3K27M突变,WHO IV级)认定为独特的IV级实体。典型的弥漫性中线胶质瘤H3K27M突变病例和H3K27M抗体的表达模式如图8C-F所示。
儿童中线胶质瘤携带以下两个相互排斥的突变基因中的一个:组蛋白H3.3基因H3F3A或H3.1 HIST1H3B。H3K27M突变主要存在于脑干、脊髓和丘脑的中线胶质瘤,尽管张和同事观察到1例位于大脑半球的低级别弥漫性星形细胞瘤存在H3K27M突变。H3.3K27M和H3.1K27M脑干肿瘤具有独特的组织学特征和临床预后差异,H3.3K27M组预后较差。
相比之下,H3F3A的G34V/R突变几乎只发生在大脑半球的高级别胶质瘤中,患者的总体生存率更高。再次,K27M和G34R/V突变在临床和分子特征上存在显著差异,这表明这些肿瘤具有独特的致癌来源,可能代表不同的疾病。
H3K27M突变并非弥漫性胶质瘤特有的,也存在于后颅窝室管膜瘤、毛细胞型星形细胞瘤(PA)和神经节胶质瘤中。作者发现在1例7岁患者的颈椎神经节胶质瘤病例中存在BRAF V600E和H3K27M突变,该患者表现为狂暴症和不对称前臂肌肉体积(excoriation disorder and asymmetric forearm muscle bulk)(图9)。Pages和他的同事报告了5例类似的WHO I级儿童中线神经节胶质瘤(丘脑2例,桥脑、脊髓和小脑脚各1例)存在BRAF V600E和H3K27M共突变。在所报告的5例患者中,4例进行了随访,其中3例在9个月、1年和7年时病情稳定,1例死于8岁时复发性疾病。这一系列研究表明,并非所有H3K27M突变的胶质瘤都应被归为WHO IV。H3K27M突变也可与FGFR1点突变同时发生;然而,这种关联的结果意义尚未完全描述。
鉴于现有的短系列和病例报告,告知中枢神经系统肿瘤分类学分子和实用方法联合会第三工作委员会发布了明确的诊断标准,建议诊断H3K27M突变的弥漫性中线胶质瘤,WHO IV级应保留给那些在中线位置扩散性浸润并具有H3K27M突变的胶质瘤(Given the existent short series and case reports on such cases, the Consortium to Inform Molecular and Practical Approaches to CNS Tumor Taxonomy Now Working Committee 3 released clarifying diagnostic criteria suggesting that the diagnosis of diffuse midline glioma, H3K27M mutant, WHO grade IV should be reserved for those gliomas that are diffusely infiltrating, in a midline location, and harboring an H3K27M mutation.)。考虑到许多PAs和神经节胶质瘤显示浸润区域,并且可能发生在中线位置,这些指南可能仍然允许诊断上的挑战。在具有挑战性的诊断中,分析H3K27M突变型胶质瘤的共同发生的遗传事件是有用的,因为WHO IV级胶质瘤通常具有PDGFRA、ACVR1、ATRX和TP53的改变。
具有H3K27M突变的真正弥漫性中线胶质瘤的2年总生存率低于10%。与生存期延长相关的因素包括年龄越小,症状潜伏期越长,MRI上无环强化。一项对1000多例经影像学证实的DIPG患者的大型研究显示了更多的预后信息,包括 H3.1 K27M比H3.3 K27M具有更长的生存期。
具有实际意义的是,尽管突变特异性H3K27M抗体的可用性有助于诊断,但应注意局限性。首先,H3K27M抗体检测的突变不仅仅与单个基因有关。根据我们的经验,核深染更多地与H3F3A突变相关,而较浅、斑点状染色模式与HIST1H3B突变相关。此外,只有在肿瘤细胞核(不是细胞质表达)和适当的阳性和阴性对照(见图8)中观察到染色时,才应解释为阳性。此外,虽然H3K27M突变肿瘤与H3K27me3表达缺失相关,但后者对H3K27M突变并不特异,不应作为突变特异性抗体的替代物。
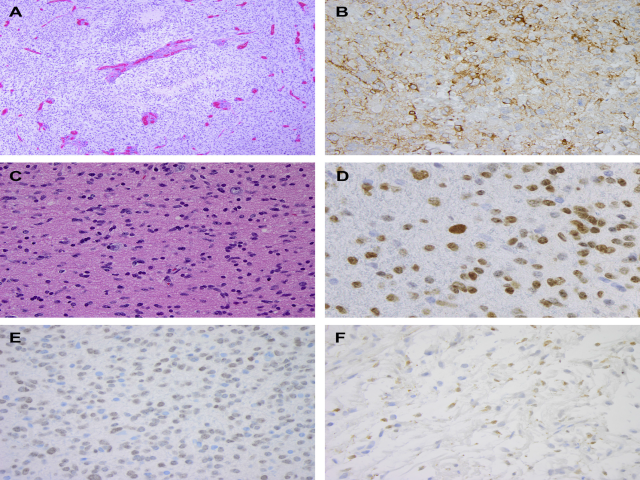
图8 高级别胶质瘤:(A)伴ALK1基因重排的先天性胶质母细胞瘤:细胞增多,微血管增生和坏死。(B)ALK1免疫组化染色呈显著阳性。(C)典型的弥漫性中线胶质瘤偶尔可见核分裂象。(D)H3K27M免疫染色显示大多数肿瘤细胞有清晰的核染色,与H3K27M突变一致;该患者被证实H3F3A突变。(E)在弥漫性中线胶质瘤中观察到细胞核H3K27M淡染,证实有HIST1H3B突变。(F)在中线胶质瘤的一些细胞中,细胞质颗粒状染色证实组蛋白H3突变阴性。
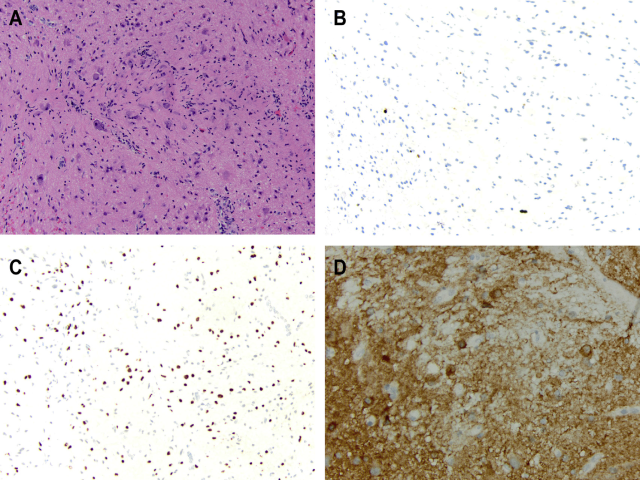
图9 一例BRAF V600E和H3K27M突变的脊髓神经节胶质瘤:(A)组织学检查显示细胞轻度增生,由非典型胶质细胞和具有发育异常特征的大而杂乱的神经元簇混合而成。(B)Ki67免疫组化染色显示增殖指数约为1%。(C)免疫组化显示H3K27M在胶质成分中呈阳性,(D)BRAF V600E在胶质和神经元成分中均呈阳性。
(3)伴BRAF V600E突变的高级别胶质瘤
在高级别胶质瘤中最常见的BRAF改变是BRAF V600E。Mistry及其同事在一项对886例儿童低级别胶质瘤患者的研究中,分析了26例进展为继发性高级别胶质瘤的病例。继发性高级别胶质瘤最常见的改变是BRAF V600E和CDKN2A丢失,所有有这些改变的高级别胶质瘤都可以追溯到低级别胶质瘤,尽管这种转变持续时间很长。BRAF V600E突变的高级别胶质瘤倾向于也有TP53突变。结论是BRAFV600E突变和CDKN2A缺失是高级别胶质瘤的一种临床上不同的亚型。在这组来自儿童医院的高级别胶质瘤中,没有一个是KIAA1549-BRAF基因融合的。考虑到临床试验中可用的靶向治疗方案,确定胶质瘤是否存在BRAF改变和改变类型是很重要的。临床试验通常包括BRAF V600E突变型肿瘤和没有BRAF V600E突变型肿瘤的分层,因为BRAF V600E抑制剂可以通过ERK信号在BRAF基因融合的胶质瘤中激活MAPK通路。BRAF V600E免疫组化染色是筛选突变的一个很好的工具;但是,它的解释可能是不确定的,通过数字滴滴PCR或包含BRAF基因的靶向测序进行分子确认更为敏感。
(4)伴NTRK基因重排的高级别胶质瘤
NTRK基因融合在低级别和高级别胶质瘤中均可见,且其形态各异。在我们的临床经验中,很难给NTRK基因重排的胶质瘤指定一个组织学分级,因为它们的组织学并不完全适合任何常规实体。在实践中遇到的一个病例显示了这一点(图10):一例3岁儿童出现短暂的头痛病史,影像学显示第三脑室清晰的肿瘤,在中脑有一个浸润性区域。活检显示一个微小的浸润性肿瘤,由背靠背的单一形态细胞组成,细胞核圆形至卵圆形,胞质丰富嗜酸性。偶尔可见核分裂象,但未见微血管增生或坏死。不存在嗜酸性颗粒体和Rosenthal纤维。肿瘤细胞GFAP和OLIG2呈弥漫性阳性,突触素表达呈斑片状。Ki67局部增加到7%。考虑到在一个小的活检组织中偶尔有核分裂象,根据WHO分级方案,有人担心是Ⅲ级肿瘤;然而,肿瘤表现为单一形态且大多为非浸润性。因此,对脑胶质瘤作出了诊断,并对其进行了低级别胶质瘤治疗。分子检测显示NTRK3-ETV6基因融合。诊断一年多后,肿瘤长约3毫米,这对于高级别恶性胶质瘤来说是不典型的,病人接受了靶向治疗。
伴NTRK基因融合的高级别胶质瘤具有胶质母细胞瘤的所有组织学特征。鉴于靶向治疗的新进展,揭示儿童胶质瘤中NTRK基因重排对病人的治疗具有重要意义。由于TRK蛋白在正常大脑中表达,panTRK免疫染色对胶质瘤不是一种好的免疫反应,因此当怀疑有NTRK基
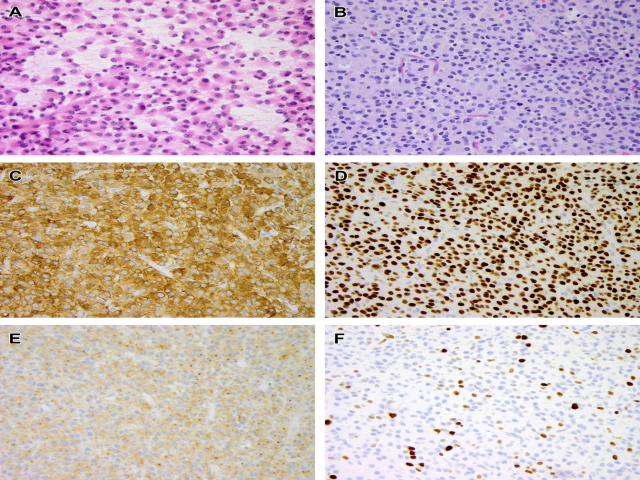
图10 一例NTRK3-ETV6基因重排胶质瘤:(A)术中涂片呈单一形态细胞群,细胞核偏心,胞质丰富嗜酸性。没有看到明确的界限。(B)石蜡包埋的H&E切片显示肿瘤由单一形态的上皮样细胞组成,呈片状生长,偶尔也有乳头状结构。(C)GFAP和(D)OLIG2免疫组化染色呈弥漫性阳性,与胶质瘤一致。(E)突触素呈胞质点状阳性表达。(F)Ki67免疫组化染色显示中度增生的区域。无坏死和微血管增生。
(5)新的高级别胶质瘤实体
2016年,Sturm和他同事在多个合作机构对323个被诊断为原发性CNS-PNET的肿瘤进行了全面的基因组和甲基化鉴定。研究表明,大多数肿瘤聚集在已知实体上,有4个新实体具有独特的组织学和生物学:伴FOXR2活化的中枢神经系统神经母细胞瘤(CNS NB-FOXR2)、伴CIC改变的CNS尤文肉瘤家族肿瘤(CNS EFT-CIC)、伴MN1改变的CNS高级别神经上皮肿瘤(CNS-HGNET-MN1),伴BCOR改变的CNS-HGNET(CNS-HGNET- BCOR)。其中,来自CNS HGNETMN1和CNS HGNET-BCOR的肿瘤表达GFAP,而神经元免疫标记物仅局灶阳性或阴性。大多数CNS-HGNET-MN1肿瘤边界清楚,级别高,包含实性和假乳头状混合模式,有些类似于星形母细胞瘤。由于大多数肿瘤的组织学诊断为星形母细胞瘤属于这一类,因此认为除了本研究发现的MN1改变的肿瘤外,不太可能存在真正的星形母细胞瘤实体。
CNS HGNET-BCOR由相对界限清楚的肿瘤组成,其胶质特征是由位于血管周围的假菊形团中的梭形细胞和卵圆形细胞组成。在这些肿瘤中发现的BCOR改变是第15外显子的一个串联重复,与肾脏透明细胞肉瘤中描述的相同。图11显示了我们在临床实践中遇到的这种病例的组织学。最近,Torre和他同事描述了3例BCOR-EP300基因融合和独特形态的胶质瘤,它们相似并与其他实体不同,包括CNS HGNET-BCOR,表明它们代表一个特定的实体。这一发现还表明需要一个更具体的CNS HGNET-BCOR命名法。这项研究中的3例肿瘤都是巨大的幕上胶质瘤,间质黏液样/微囊样背景;这项研究中的3例肿瘤都是巨大的幕上胶质瘤,间质黏液样/微囊样背景;钙化常见(包括沙粒体)以及明显的鸡笼样/鸡爪样血管。(chicken-wire vessels)。所有3例患者均有低级别形态,其中2例也有间变性区域,提示从低级别病变向高级别病变发展。图12显示了这种情况的代表性照片。BCOR免疫组化染色是胶质瘤中BCOR基因改变的可靠替代物,在HGNET-BCOR ITD ex15和BCOR-EP300胶质瘤中均呈阳性(见图12)。
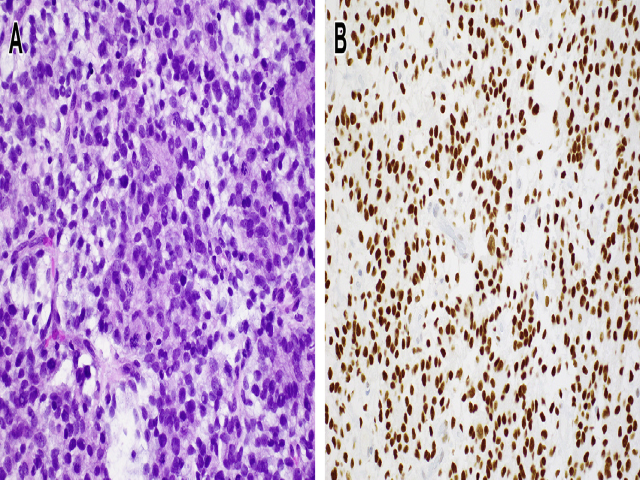
图11 HGNET-BCOR ITDex15(A)胶质瘤由圆形至卵圆形细胞组成,细胞核非典型,围绕模糊的纤细血管周围排列。核分裂象和凋亡易见。(B)所有肿瘤细胞均表达BCOR。
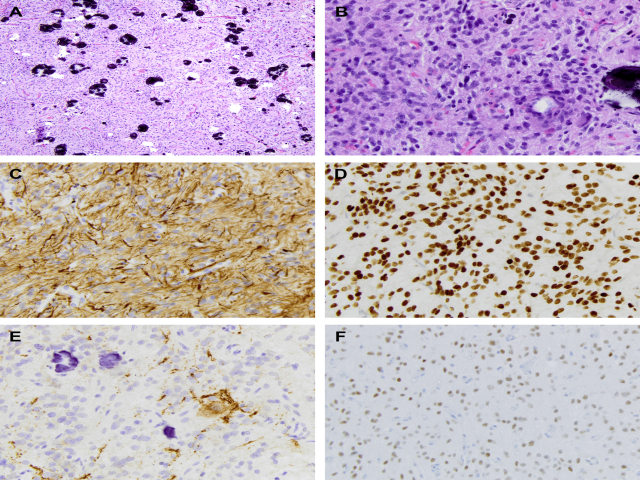
图12 伴BCOR-EP300基因融合的胶质瘤显示(A)低级别组织学区域,伴有大量砂粒状钙化;细胞密度中等;轻度异型性;纤细的血管呈网。(B)为细胞增多,偶尔核分裂象区域。免疫组化染色GFAP(C)和OLIG2(D)呈弥漫阳性,突触素(E)呈阴性;阳性显示被截留的轴突和神经元。(F)肿瘤细胞BCOR核染色呈阳性。
【参考文献】
[1] An Update on Pediatric Gliomas.Surgical pathology clinics.2020,13(2): 217-233.doi:10.1016/j.path.2020.02.005.


















共0条评论