[导读] 【引用本文】张 鹏,李承果,贾 杰,陈 鑫,孙 雄,童 昕,刘炜圳,王 征,王国斌,陶凯雄. 胃神经内分泌肿瘤96例临床病理特征及预后分析[J]. 中国实用外科杂志,2020,40(7):824-829.
摘要
目的探讨胃神经内分泌肿瘤(g-NENs)的临床病理特征及预后影响因素。方法回顾性分析2010年3月至2019年6月华中科技大学同济医学院附属协和医院胃肠外科收治的96例原发g-NENs病人的临床资料。根据2010年版WHO消化系统肿瘤分类标准对g-NENs进行病理学分类。采用Kaplan-Meier法绘制生存曲线并计算存活率,Log-rank检验进行单因素生存分析,Cox比例风险回归模型进行多因素分析。结果96例病人中83例行手术治疗,其中80例行完整切除手术,3例行姑息手术。随访42(2~84)个月,行完整切除手术病人预后优于未行完整切除手术者,差异有统计学意义(P<0.001)。80例行完整切除手术病人中,G1级胃神经内分泌瘤(g-NET)8例,G2级g-NET 6例,胃神经内分泌癌(g-NEC)43例,胃混合性腺神经内分泌癌(g-MANEC)23例。g-NET病人预后优于g-NEC(P=0.009)和g-MANEC(P=0.035),而g-NEC与g-MANEC病人预后差异无统计学意义(P=0.551)。对66例g-NEC和g-MANEC病例进行单因素生存分析显示,TNM分期、中性粒细胞-淋巴细胞比值(NLR)以及预后营养指数(PNI)是影响病人总体生存时间(OS)的危险因素;多因素分析显示,TNM分期Ⅲ/Ⅳ期(HR=8.411,95%CI 1.140~62.052,P=0.037)与NLR>1.93(HR=4.011,95%CI 1.386~11.612,P=0.010)是影响OS的独立危险因素。结论 g-NET病人预后优于g-NEC和g-MANEC,而g-NEC与g-MANEC病人预后差异无统计学意义。TNM分期Ⅲ/Ⅳ期、术前NLR>1.93的g-NEC和g-MANEC病人的预后相对较差。
胃神经内分泌肿瘤(gastric neuroendocrine neoplasms,g-NENs)较少见,约占所有神经内分泌肿瘤(NENS)的6%,发病率约为3/100万[1-2]。其可分为胃神经内分泌瘤(gastric neuroendocrine tumor,g-NET)、胃神经内分泌癌(gastric neuroendocrine carcnoma,g-NEC)以及胃混合性腺神经内分泌癌(gastric mixed adenoneuroendocrine carcinoma,g-MANEC)[3]。其中,g-NET肿瘤细胞分化程度较高,而g-NEC与g-MANEC分化程度较差。由于不同病理学类型g-NENs生物学特征表现各异且目前研究相对较少,临床医生对其认识仍十分有限[1,4]。本研究通过回顾g-NENs病人的临床资料,探讨不同病理学分类的g-NENs病人的临床病理特征及预后影响因素。
1资料与方法
1.1一般资料回顾性分析2010年3月至2019年6月华中科技大学同济医学院附属协和医院收治的原发g-NENs病人的临床资料。纳入标准:(1)病理学检查证实为g-NENs。(2)临床资料完整。排除标准:(1)术前合并感染或血液系统疾病等可能影响炎性指标的病人。(2)肝肾功能不全的病人。(3)合并其他恶性肿瘤的病人。所有病人及家属均签署知情同意书。
1.2病理学分析参照2010版世界卫生组织(WHO)消化系统肿瘤分类标准将g-NENs分为g-NET、g-NEC、g-MANEC[3]。采用核分裂相及Ki-67标记率对其进行病理学分级。(1)G1级NET:核分裂相数<2个/10高倍视野(HPF)或Ki-67指数≤2%。(2)G2级NET:核分裂相数(2~20)个/10 HPF或Ki-67指数>2%~20%。(3)G3级NEC及MANEC:核分裂相数>20个/10 HPF或Ki-67指数>20%。二者不一致时采用较高分级的结果。按照美国癌症联合委员会(AJCC)第8版癌症分期系统对g-NENs进行TNM分期[5]。
1.3炎性指标及营养免疫指标检测选取病人术前1周内血常规及肝功能检测结果。(1)中性粒细胞-淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)定义为血中性粒细胞绝对值与血淋巴细胞绝对值的比值。(2)术前血小板-淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)定义为血小板绝对值与血淋巴细胞绝对值的比值。(3)预后营养指数(prognostic nutritional index,PNI)定义为血清白蛋白(g/L)与5倍外周血淋巴细胞总数(×109/L)之和。
1.4复查及随访通过门诊复查以及电话、短信及网络等方式进行定期随访,记录病人生存情况。随访内容包括生化指标、影像学检查以及内镜检查等。对于完整切除术后g-NET病人,建议每3~6个月复查CT或MRI,至少每2年复查1次胃镜;g-NEC及g-MANEC病人参照胃腺癌的原则进行复查。末次随访时间为2020年1月。主要终点观察指标为总体生存时间(overall survival,OS),其定义为病理确诊至病人死亡或末次随访的时间。
1.5统计学处理应用SPSS 19.0软件进行统计分析,计数资料用频数表示,采用χ2检验。对计量资料进行正态分布检验,正态分布数据以均数±标准差表示,采用t检验或方差分析进行组间比较;非正态分布数据以中位数(四分位数)表示,多组间比较采用Kruskal-Wallis秩和检验。应用受试者工作(receiver operating characteristic,ROC)曲线确定NLR、PLR及PNI最佳截断值。采用Kaplan-Meier法绘制生存曲线及计算存活率,并用Log-rank检验进行单因素分析。采用Cox比例风险模型进行多因素分析。P<0.05为差异有统计学意义。
2结果
2.1临床病理特征共纳入96例g-NENs病人,其中男性72例(75.0%),女性24例(25.0%),病人中位年龄61(32~79)岁。首发临床症状包括:上腹部隐痛46例(47.9%),右上腹胀18例(18.8%),进食梗阻9例(9.4%),黑便9例(9.4%),呕血6例(6.3%),恶心呕吐2例(2.1%),消瘦乏力2例(2.1%),体检偶然发现11例(11.5%)。均未出现激素相关临床症状。
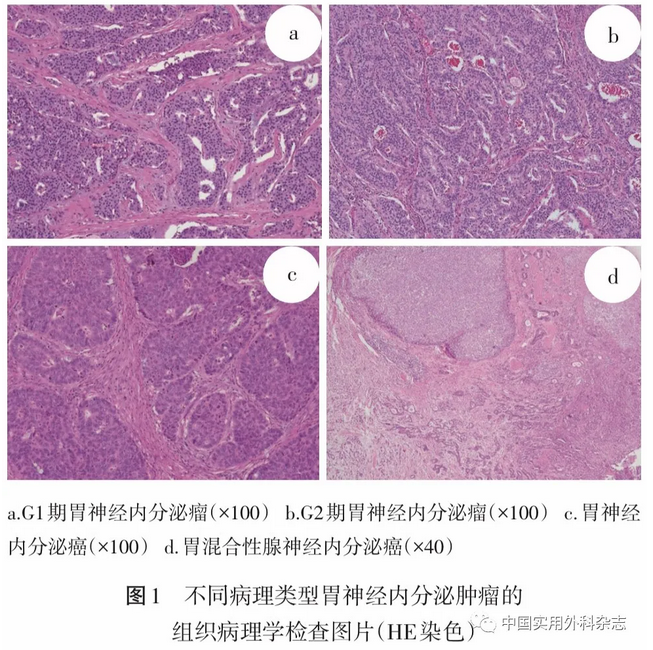
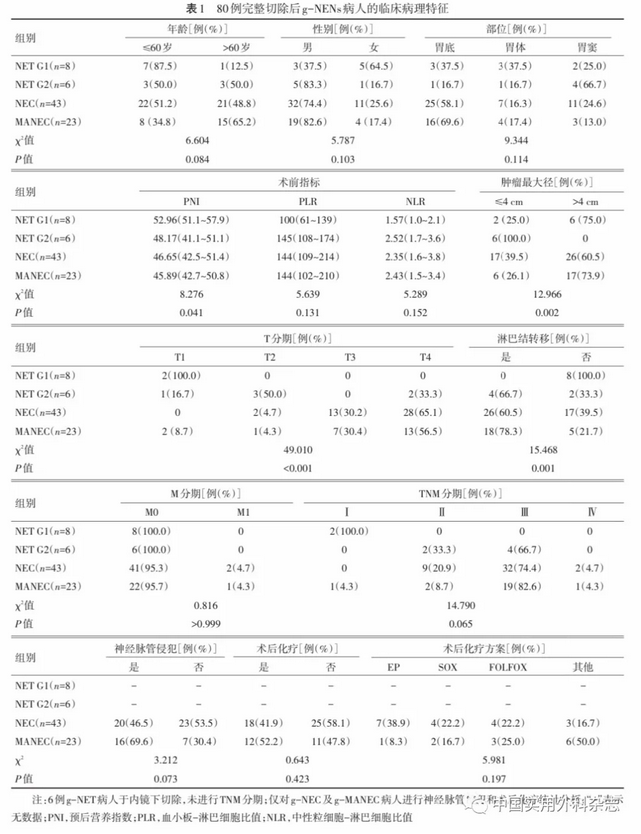
96例病人中80例(83.3%)行完整切除手术,3例(3.1%)行姑息手术,13例(13.5%)未行手术。行完整切除手术病人中33例行全胃切除,28例行近端胃切除,9例行远端胃切除,4例行局部切除,6例于内镜下切除;G1级g-NET 8例,G2级g-NET 6例,g-NEC 43例,g-MANEC 23例(图1)。80例行完整切除手术病人的临床病理特征见表1,PNI、肿瘤大小、T分期及淋巴结转移与病人术后病理学分类相关(P<0.05),而性别、年龄、部位、NLR及PLR等与其无关。行完整切除手术的g-NEC和g-MANEC病人中神经脉管侵犯、术后化疗及化疗方案差异无统计学意义(P>0.05)。3例姑息手术病人病理学分类包括g-NEC 2例、g-MANEC 1例;13例未行手术切除病人包括g-NEC 11例、g-MANEC 2例。
80例行完整切除手术的病人中30例(37.5%)接受术后化疗,其中8例使用依托泊苷+奥沙利铂(EP方案)化疗,7例使用5-氟尿嘧啶+奥沙利铂(FOLFOX方案)化疗,6例使用奥沙利铂+替吉奥(SOX方案)化疗,3例使用表柔比星+顺铂+氟尿嘧啶化疗,3例使用卡培他滨+替莫唑胺化疗,3例使用替吉奥化疗。3例行姑息手术的病人术后接受EP方案化疗。13例未行手术病人中,6例使用EP方案化疗,5例使用FOLFOX方案化疗,2例未行化疗。
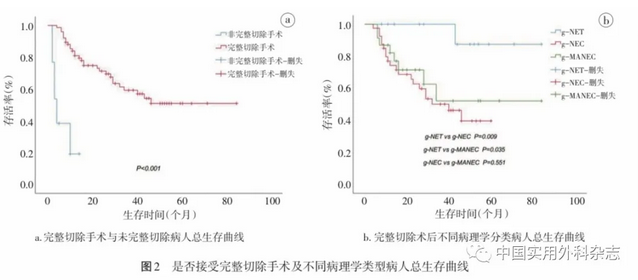
2.2预后因素分析截至末次随访,96例病人中7例失访,随访率为92.7%,随访时间2~84个月,中位随访时间42个月,40例病人死亡,其中29例g-NEC及10例g-MANEC病人因肿瘤进展死亡,1例g-NET病人因脑血管疾病死亡。所有病人1、3、5年OS分别为72.1%、52.8%、45.4%,行完整切除手术病人预后优于未行完整切除手术的病人,差异有统计学意义(P<0.001)。见图2a。
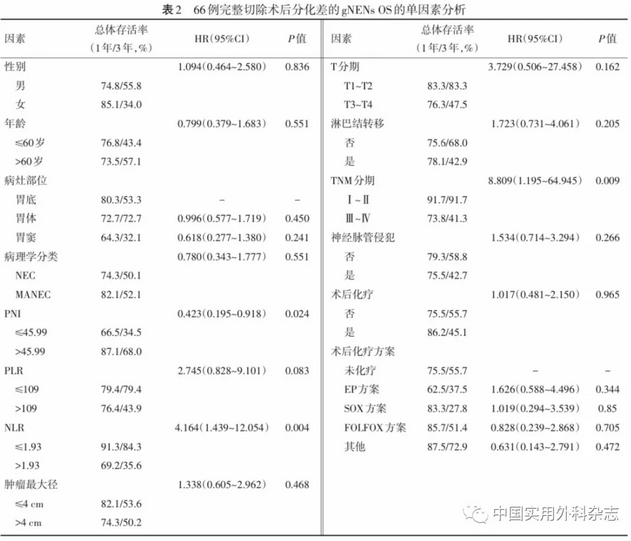
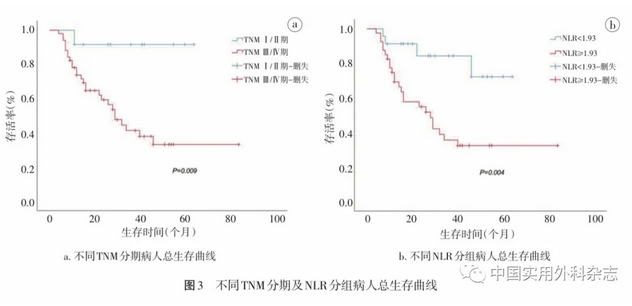
完整切除的g-NET、g-NEC、g-MANEC病人术后5年OS分别为87.5%、39.6%、52.1%。生存分析结果显示,g-NET病人预后优于g-NEC(P=0.009)及g-MANEC(P=0.035)病人,但g-NEC与g-MANEC病人预后差异无统计学意义(P=0.551)。见图2b。对g-NET病人进行亚组分析,结果提示G1级与G2级NET病人预后差异无统计学意义(P=0.197)。进一步分析影响g-NEC、g-MANEC病人预后的因素,ROC曲线显示NLR、PLR及PNI对预后的最佳截断值分别为1.93、109及45.99。将单因素分析中有统计学意义的变量纳入多因素分析,TNM分期(OR=8.411,95%CI 1.140~62.052,P=0.037)与NLR(OR=4.011,95%CI 1.386~11.612,P=0.010)是影响g-NEC及g-MANEC病人OS的独立预后因素(表2)。TNM分期Ⅰ、Ⅱ期的病人5年OS优于Ⅲ、Ⅳ期病人,差异有统计学意义(91.7% vs. 33.2%,P=0.009);NLR≤1.93病人与NLR>1.93病人5年OS分别为72.2%、32.4%,差异有统计学意义(P=0.004)。见图3。
3讨论
g-NENs是一类从惰性生长、低度恶性到明显恶性的高异质性肿瘤,好发于中老年男性[2,4]。本研究96例g-NENs病人中位年龄为61(32~79)岁,男女比例为3∶1,与既往报道相符[2,4]。根据胚胎组织分化,中肠来源的NENs常发生类癌综合征,g-NENs属于前肠NENs,类癌综合征较少见[1]。本研究中96例病人临床表现以腹痛、腹胀等非特异性症状为主,部分病人出现黑便及贫血症状,所有病人均未出现类癌综合征。由于g-NENs临床表现多样且缺乏特异性,也因此增加了早期诊断的难度。
目前,手术完整切除是局限性g-NENs首选的治疗方式,对于g-NET病人可选择内镜下切除或外科手术切除;而对于分化差的g-NENs则推荐按照胃腺癌的处理模式行手术治疗[6]。中山大学肿瘤防治中心牵头的多中心回顾性研究显示,接受手术治疗的g-NENs病人5年OS显著高于未接受手术治疗的病人(54.6% vs. 10.9%)。本研究中接受完整切除手术的80例g-NENs病人5年OS为51.3%,而未能完整切除肿瘤的16例晚期g-NENs病人1年OS仅为19.2%,同样也在一定程度上说明完整手术切除在g-NENs治疗中的作用。本研究对80例行完整切除的g-NENs病人生存情况进行分析,结果显示g-NET (G1、G2)病人5年OS显著优于g-NEC及g-MANEC病人,而g-NEC与g-MANEC病人预后无差异。进一步分析显示,g-NET(G1、G2)肿瘤分化程度较高,淋巴结转移及远处转移少见,确诊时通常分期较早;而g-NEC及g-MANEC肿瘤分化程度较差,确诊时多数伴局部淋巴结转移或远处转移。因此,不同病理类型g-NENs具有不同的生物学行为,预后也有所差异。
g-NEC及g-MANEC侵袭性强且生长迅速,通常不能分泌激素或发生激素综合征,所以对于此类病人不常规推荐应用生长抑素类似物(somatostatin analogue,SSA)。本研究中病人均未出现激素相关临床症状,故均未接受SSA治疗。此外,由于g-NEC及g-MANEC病理学特征与小细胞肺癌(small cell lung cancer,SCLC)相似,其化疗多采用与SCLC标准相一致的含铂化疗方案,其中EP方案较常用[7]。但既往研究表明,g-NEC及g-MANEC病人对含铂化疗方案的反应率及预后均差于SCLC病人[8]。目前,对于g-NEC及g-MANEC病人,术后辅助化疗方案能否改善病人预后仍然存在争议。本研究中66例g-NEC与g-MANEC病人行完整切除手术,其中30例病人术后接受化疗,生存分析结果显示,包括EP方案在内的多种化疗方案均未能使病人术后生存获益。化疗方案疗效的差异一方面可能是由于地区及人种差异所致,另一方面由于本研究为回顾性研究且接受辅助化疗的病人较少,可能造成偏倚。此外,有研究报道,晚期g-NENs病人对EP方案等含铂化疗方案的反应率与Ki-67指数相关[9]。Ki-67指数>55%的病人对含铂化疗方案有效率显著高于Ki-67指数<55%的病人,因而仅推荐Ki-67指数>55%的病人使用含铂化疗方案,其中首选EP方案[9];另一项研究则建议,对于低Ki-67指数的病人可考虑以替莫唑胺为主的化疗方案[10]。因此,对于g-NEC及g-MANEC病人,如何筛选对化疗敏感的病人及术后辅助化疗方案还需要进一步前瞻性研究。
积极探索g-NENs病人预后相关指标对肿瘤防治意义重大。近年来,多项研究表明,包括NLR、PLR及PNI在内的多种术前指标与SCLC、乳腺癌及肝癌等恶性肿瘤的预后密切相关,但与g-NENs相关的研究较少[11-13]。本研究对NLR、PLR及PNI等因素进行预后分析,结果显示,NLR是影响g-NEC及g-MANEC病人预后的独立危险因素。NLR为中性粒细胞-淋巴细胞比值,中性粒细胞可刺激机体产生一系列细胞因子而促进肿瘤细胞增殖及肿瘤血管形成,而淋巴细胞在抗肿瘤免疫中发挥重要作用。因此,NLR在反映机体炎性反应状态的同时,也关系到肿瘤的发展及预后,并且NLR升高往往与肿瘤预后不良相关[11]。本研究结果表明,对于g-NEC及g-MANEC病人,NLR≤1.93的病人5年OS显著优于NLR>1.93的病人,故对术前NLR水平较高的病人,术后可能需要更加密切地随访。作为一种常用的炎性标记物,NLR具有简便快捷、低成本、可重复等优点,适宜推广。此外,本研究也显示,TNM分期Ⅲ、Ⅳ期是影响g-NEC及g-MANEC病人预后的独立危险因素,与国内外研究相符,表明TNM分期对于判断g-NENs病人预后具有较好的预测价值[2]。
综上所述,手术完整切除是g-NENs的主要治疗方式。g-NET病人的预后显著优于分化差的g-NEC及g-MANEC病人,而g-NEC与g-MANEC病人预后无差异。对于g-NEC与g-MANEC病人,TNM分期Ⅲ、Ⅳ期及术前NLR>1.93者预后较差,此类病人术后辅助化疗方案仍需进一步研究。
参考文献
[1] Cives M,Strosberg JR. Gastroenteropancreatic neuroendocrine tumors[J]. CA Cancer J Clin,2018,68(6):471-487.
[2]Yao JC,Hassan M,Phan A,et al. One hundred years after "carcinoid": epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States[J]. J Clin Oncol,2008,26(18):3063-3072.
[3]Rindi G,Arnold R,Bosman F,et al. WHO classification of tumours of the digestive system[M]. 4th ed. Lyon:International Agency for Research on Cancer (LARC),2010:13-14.
[4]唐承薇,郭林杰. 我国胃肠胰神经内分泌肿瘤临床现状分析[J]. 中国实用外科杂志,2014,34(6):490-492.
[5]Amin MB,Edge S,Greene F,et al. AJCC Cancer Staging Manual[M]. 8th ed. New York:Springer,2016:203-220.
[6]徐建明,梁后杰,秦叔逵,等. 中国胃肠胰神经内分泌肿瘤专家共识(2016年版)[J]. 临床肿瘤学杂志,2016,21(10):927-946.
[7]Garcia-Carbonero R,Sorbye H,Baudin E,et al. ENETS consensus guidelines for high-grade gastroenteropancreatic neuroendocrine tumors and neuroendocrine carcinomas[J]. Neuroendocrinology,2016,103(2):186-194.
[8]Terashima T,Morizane C,Hiraoka N,et al. Comparison of chemotherapeutic treatment outcomes of advanced extrapulmonary neuroendocrine carcinomas and advanced small-cell lung carcinoma[J]. Neuroendocrinology,2012,96(4):324-332.
[9]Sorbye H,Welin S,Langer SW,et al. Predictive and prognostic factors for treatment and survival in 305 patients with advanced gastrointestinal neuroendocrine carcinoma (WHO G3):the NORDIC NEC study[J]. Ann Oncol,2013,24(1):152-160.
[10]Olsen IH,Sørensen JB,Federspiel B,et al. Temozolomide as second or third line treatment of patients with neuroendocrine carcinomas[J]. Sci World J,2012,2012:170496.
[11]Amaral SR,Casal MM,Carvalho J,et al. Prognostic significance of neutrophil-to-lymphocyte ratio (NLR) and platelet-to-lymphocyte ratio (PLR) in non-small cell lung cancer (NSCLC) treated with immune checkpoint inhibitors[J]. Ann Oncol,2019,30(suppl 1):i3.
[12]Hua X,Long ZQ,Huang X,et al. The value of prognostic nutritional index (PNI) in predicting survival and guiding radiotherapy of patients with T1-2N1 breast cancer[J]. Front Oncol,2019,9:1562.
[13]张劲夫,范正军,梁润威,等. 术前SIRI和PLR对肝癌切除术后病人生存预测价值分析[J]. 中国实用外科杂志,2018,38(2):210-218.


















共0条评论