随着人民群众健康意识的不断提高,以及临床诊疗手段的不断进步,胃癌筛查正逐步增多。毫无疑问,病理诊断对于胃癌的确诊至关重要。不过,有些胃腺癌在组织学表现方面会有特殊之处,比如细胞核级别低、结构异型性轻微。
胃的极高分化腺癌(extremely well-differentiated adenocarcinoma,EWDA)是指肿瘤性上皮表现为高分化,细胞核具有轻度异型性,类似正常胃粘膜或肠化生的黏膜,但却具有侵袭胃壁的能力。也正是因为其形态学的特殊性,因此术前活检通常很难做出胃癌诊断。
近日,日本自治医科大学(Jichi Medical University)专家在《Int J Surg Case Rep》杂志报道了一例胃的极高分化腺癌病例,其具体诊断过程值得我们临床及病理同仁借鉴。因此我们将该文要点编译介绍如下。
病例展示
患者男性,70岁,因常规胃镜检查发现胃体上部后壁凹陷型病变3月就诊。患者67岁时曾进行过幽门螺旋杆菌根治性治疗,且治疗3月后证实为阴性。首次常规胃镜检查,胃体近端后壁的表面可见一处中央凹陷的病灶,但病灶整体突出、类似黏膜下肿瘤。蓝光放大检查,表面呈不规则、微血管样结构。
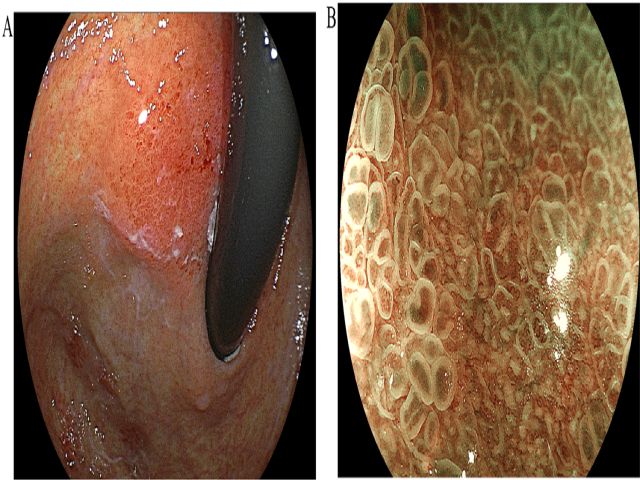
图1. 内镜检查,胃体近端后壁可见一处黏膜下表现的病灶,蓝光放大检查,表面结构不规则、微血管样。
病灶处胃黏膜活检,可见肠型腺体,结构轻度异常。构成腺体者为嗜酸性柱状上皮,散在个别杯状细胞,细胞核具有轻度异型性。免疫组化p53呈正常表达模式。
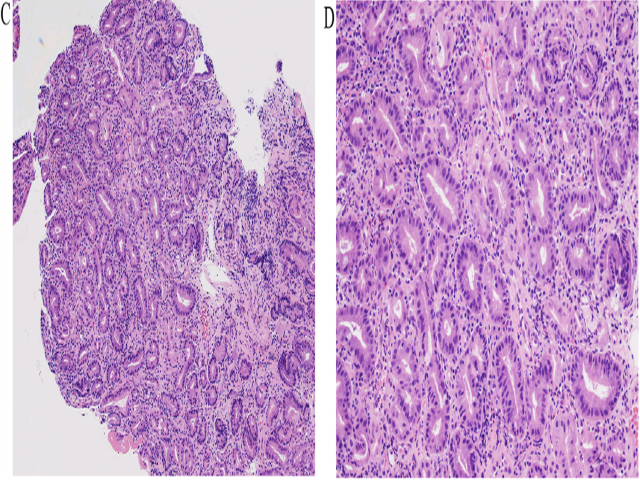
图2. 胃部病变活检,可见结构轻度异常的非典型腺体,但结构和细胞学方面并无显著异型性。
上述组织学表现,考虑有极高分化腺癌可能,但也不能排除反应性肠上皮化生。超声内镜检查可见低回声肿瘤,且侵及胃壁的第四层结构(即浆膜层)。CT扫描胃壁未见肿瘤,未见转移性证据。
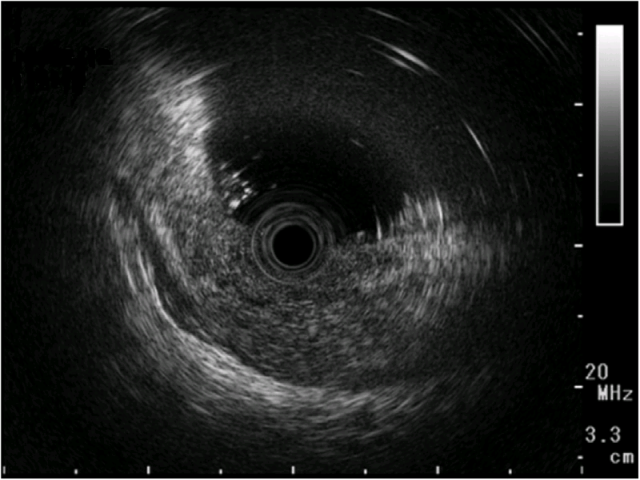
图3. 超声内镜检查,可见一处低回声肿瘤、侵及胃壁第四层(即浆膜层)。
尽管结合内镜表现,考虑胃极高分化腺癌可能,但术前重复活检、包括深挖洞活检都未能明确诊断为胃癌。原作者认为这可能是无法获取包括较深黏膜下层结构在内的足量标本所致。因此,为获取足量的病变深部组织,行内镜黏膜下切除以明确诊断。术后组织学表现为肠型腺体在黏膜下生长,病理明确诊断为腺癌。相比黏膜内成分来说,浸润性腺体为薄层上皮、扩张腺腔,具体结构不一。侧切缘及垂直切缘均有肿瘤累及,提示病灶并未完全切除。
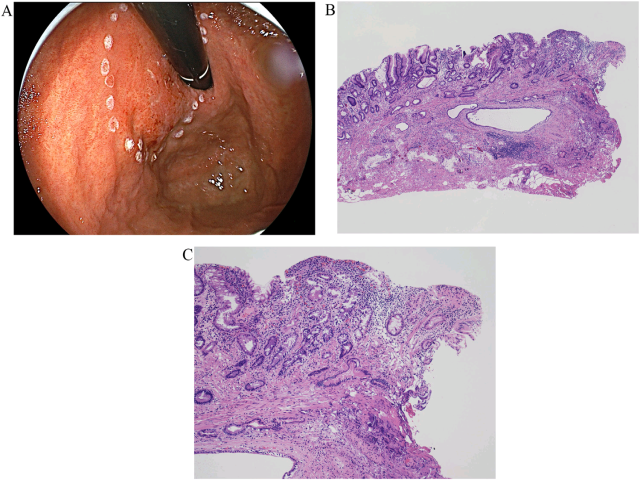
图4. 对病变进行内镜黏膜下切除,组织学检查可见嗜酸性、柱状表现的癌细胞,细胞具有轻至中度的核异型性,且浸润深度超过黏膜下层。侧方切缘及深部切缘均为阳性。
后续患者行开腹胃全切及淋巴结清扫。切除标本病理检查,肿瘤侵及浆膜下,并有血管受累。近端切缘及远端切缘未见肿瘤累及;清出淋巴结未见肿瘤转移。最终确定该肿瘤分期为IIA期(T3N0M0)。术后12个月,随访未见复发证据。
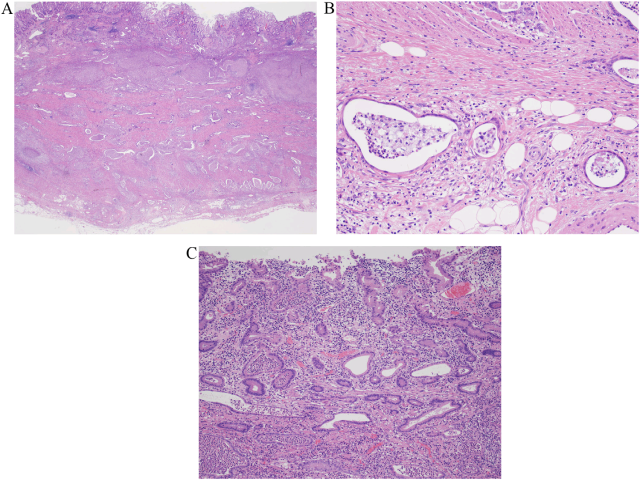
图5. 开腹全胃切除手术后,病理检查可见具有轻至中等程度异型性的嗜酸性、柱状癌细胞,病变自黏膜层一直侵至浆膜下。
小结
对于胃极高分化的腺癌来说,已有报道提出了诊断的标准,如相互交织的腺体、尖刺状腺体、扩张腺体、失黏附的细胞、流产的腺体、腺体分枝状等,均提示肠型极高分化胃腺癌。其实肠型免疫表型可能意味着生物学行为的侵袭性弱一些,Ki-67增殖指数低、无p53或HER2的过表达也支持这一点。
尽管有各种关于胃极高分化腺癌的相关文献,但术前病理诊断该肿瘤还是极为困难的。由本文病例也可以看出,胃镜、超声内镜检查等对于防止漏诊非常重要。结合相关文献,也可以明确:必要时内镜下切除对于明确癌的诊断非常关键。
点击下载英文文献
参考文献
Suenaga K, Matsumoto S, Lefor AK, et al. Preoperative diagnosis of a gastric extremely well-differentiated adenocarcinoma: A case report. Int J Surg Case Rep. 2020;73:319-323.
doi:10.1016/j.ijscr.2020.07.050


















共0条评论