病例10 卵巢Krukenberg瘤
(Krukenberg Tumor of the Ovary)
【病例介绍】
患者,女,46岁;患者因“腹疼14天”入院,发现左侧卵巢肿块;患者于2012-12-26因“B超发现右侧附件区包块”至我市另一医院妇产科住院治疗,于2012-12-28在腰硬联合麻醉下行“右侧附件切除术”,与现在左侧卵巢手术相隔5月。本次术中见左侧卵巢肿瘤约10cm大小,与周围组织粘连,腹水约1000ml。
【病理变化】
(1)巨检 灰红色结节1枚12.0X11.0X9.0cm,一侧附输卵管长6.0cm,直径0.5cm,结节表面光滑,切面囊实性,实性区直径7.0cm,灰白、质嫩,囊性区直径3.0cm,内含淡黄色液体。
(2)镜检 肿瘤组织主要由细胞密集区和细胞稀疏淡染区交替分布组成,图1-A至图1-J为肿瘤组织中不同的三个区域的低倍到高倍图像。
图1-A至图1-C所示区域:低倍镜示该区域主要由实性、密集细胞组成,局部区域呈舌状浸润,右下方见一厚壁血管,背景中可见散在的炎细胞浸润。高倍镜示肿瘤细胞界限不清,排列紊乱,有腺样排列趋势,胞浆嗜伊红染,可见胞浆内空泡的印戒样细胞;细胞核大小不一,核膜增厚、不规则,染色质呈空泡状,核仁明显;可见核分裂象。
图1-D至图1-G所示区域:细胞丰富深染区与细胞稀疏淡染区交替分布,肿瘤细胞呈浸润性生长,右侧可见成簇的厚壁血管;细胞密集区与淡染区交界处边界不清、呈浸润性生长,可见淡染区的水肿及散在的含有铁黄素的巨噬细胞;高倍镜示实性区域特点同前。
图1-H至图1-J所示区域:细胞丰富深染区与细胞稀疏淡染区交替分布且以淡染区为主,淡染区内可见浸润性肿瘤细胞条索、细胞巢;高倍镜示肿瘤细胞特点同前。
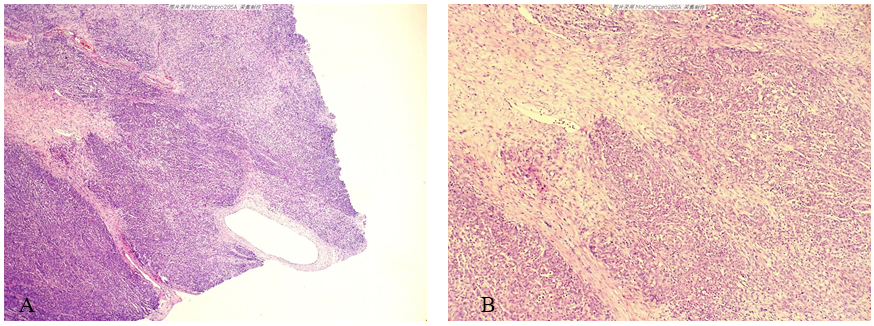
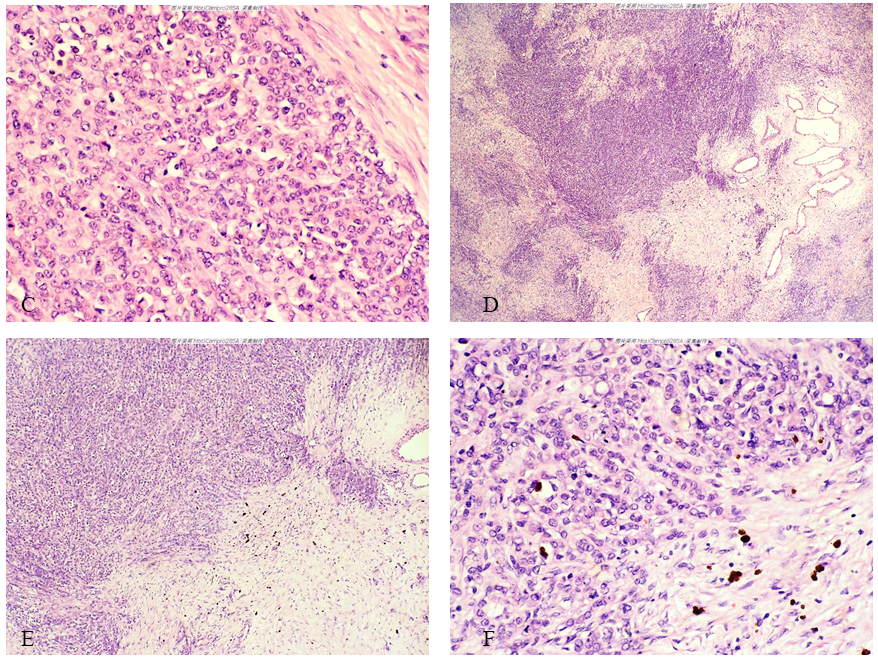
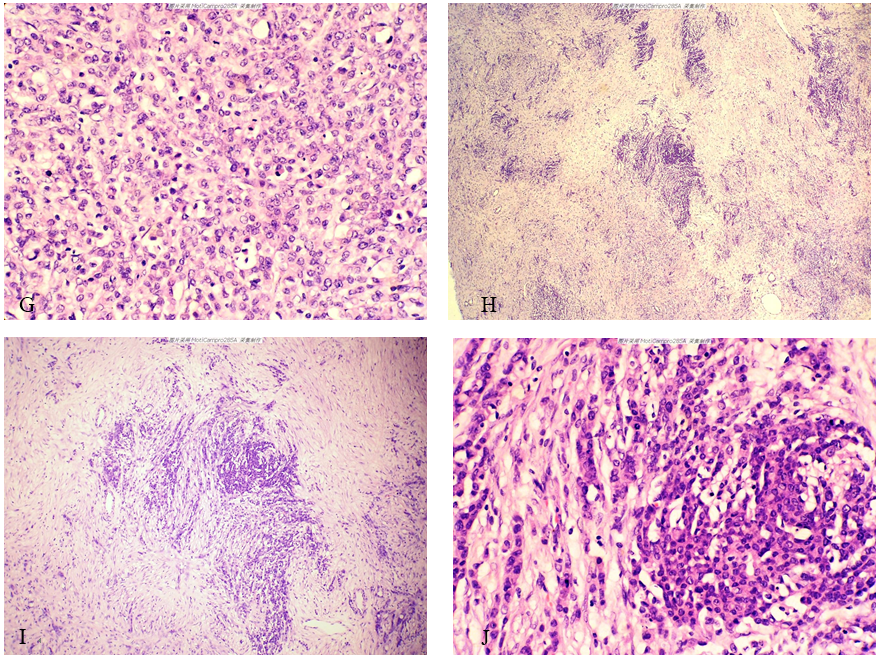
图1 左侧卵巢Krukenberg瘤。
(3)免疫组化 CA125(-),CDX-2(+),CEA(+),CK7(+),CK20(-),EGFR(+),EMA(+),ER(-),PR(-),ki-67(+),P53(+),Villin(+),Vimentin(-),WT-1(-)。
(4)特殊染色 AB(+),PAS(+)。
(5)右侧附件肿物(2012-12-28切除)图像:
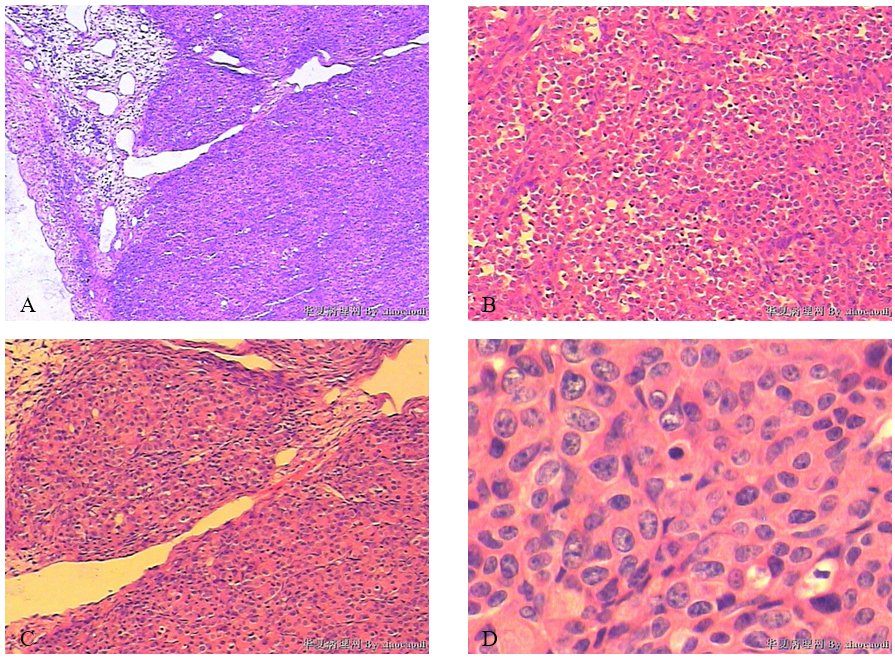 图2右侧卵巢Krukenberg瘤。
图2右侧卵巢Krukenberg瘤。
【讨论】
卵巢的转移性肿瘤又称为继发性肿瘤,是指从卵巢外的部位播散到卵巢的肿瘤。卵巢为女性生殖系统中发生转移性肿瘤最多的器官,2014年WHO女性生殖器官肿瘤分类将其来源分为肠道、胃、胰胆系统(包括胰腺、胆囊、肝内或肝外胆管)、阑尾、乳腺以及其他(包括相对常见的宫颈和子宫内膜来源的腺癌,相对少见的肺、膀胱、肾等来源的癌,以及恶性黑色素瘤、类癌、各种非妇科学的肉瘤、子宫内膜间质肿瘤、恶性间皮瘤等)[1]。在卵巢癌中,转移癌占17%~21%,其中近2/3来自于胃肠道和乳腺[2]。
Krukenberg瘤(Krukenberg tumor,KT)最早由德国妇科病理学家Friedrick Krukenberg于1896年报道,是指具有独特组织学形态的卵巢转移性腺癌,以充满粘液的多形性印戒细胞为明显组织学特征,常伴有卵巢间质肉瘤样增生。KT占卵巢转移癌的3%~8%,其中来源于胃癌的占40%~95%,来自结(直)肠癌的少于20%,卵巢的绝大多数转移性胃癌是Krukenberg型,罕见的来源有胆囊、乏特壶腹、小肠、阑尾,乳腺癌、子宫颈癌和膀胱癌有时也形成Krukenberg型转移癌[2]。
KT的发病年龄为13~84岁(平均45岁),其中43%的患者年龄小于40岁,是年轻妇女中最常见的卵巢转移性肿瘤[3]。原发肿瘤常常很小,缺乏相应的症状和体征,而卵巢转移瘤较大,常引起腹痛、腹部增大和腹水,少数可有胸水,偶可因肿瘤扭转或破裂导致急腹症。由于转移癌可引起间质黄素化,少数病人临床有雌激素性或雄激素性内分泌表现,如月经紊乱、子宫内膜增生及男性化等,后者多出现于妊娠妇女[5]。Rawasia WF等[6]报道1例48岁的KT患者主要表现为呼吸困难。胃癌通常在术前、卵巢切除时或术后几个月内发现,但是小的原发性肿瘤可能隐匿到卵巢切除后5年或更长时间。非常小的原发性肿瘤需要充分取材,特别是胃癌和乳腺肿瘤[5]。
约80%的病例肿瘤为双侧性,双侧卵巢不对称增大,其中一侧最大直径常大于10cm,有时可达到30cm。肿瘤通常为实性,圆形或分叶状,切面白色或淡黄色,可有褐色或紫色区,质硬韧。包膜表面一般无粘连。有些肿瘤切面可呈胶冻状、海绵状或水肿样。较大的肿瘤常有囊性变,偶尔肿瘤可含有数个大的薄壁囊肿,其内充满黏液样或水样液体,其间有少量实性组织将之分隔开。明显的坏死一般不常见[5]。
肿瘤由多形性印戒细胞和呈现肉瘤样外观的肥胖梭形间质细胞密切混合组成,整体呈细胞密集区与淡染水肿区交替分布。上皮成分主要由单个或成簇的印戒细胞构成,印戒细胞与胃癌中的印戒细胞形态相同,具有含空泡的胞质以及偏位、深染的细胞核,但是也可以呈颗粒状嗜酸性胞质,特别是位于小管内时。细胞主要分泌中性粘液,PAS染色或粘液卡红染色阳性。上皮性标志物免疫组织化学染色(角蛋白、EMA)阳性。间质成分数量差异大,由成束的梭形细胞组成,表面部分可以胶原化或呈编织状结构,类似于纤维瘤,而更深层的间质细胞较肥胖。常有局部的水肿,尤其是在髓质,有时弥漫呈重度水肿或形成假囊的程度,罕见情况下可出现间质黏液湖。有些Krukenberg瘤呈现突出的管状结构且被分为“管状Krukenberg瘤”,其不同于经典型的Krukenberg瘤,占Krukenberg瘤的20%,可能是某种程度上分化较好的肿瘤,排列成小腺管状,间质中黄素化间质细胞较多。Krukenberg瘤中难以识别的形态是在印戒细胞少而间质反应广泛时,在这些病例中常规切片中,间质的结节性可以提供唯一的线索。
本例免疫组织化学染色支持胃肠道来源。
Krukenberg瘤主要与纤维瘤、seitoli-leydig细胞瘤、印戒细胞间质瘤等鉴别,细胞学特征及免疫组织化学可以帮助诊断。
手术联合化疗为首选治疗方式。Krukenberg瘤恶性程度较高,发现时多为晚期,预后较差,常在1年内死亡,但是Jeung YJ等[4]研究156例胃和结(直)肠来源的卵巢KT显示,其总的平均存活时间为22.7个月;按来源分为胃和结(直)肠两组,其各自的平均存活时间分别为19.2个月和27.3个月,结(直)肠来源的卵巢KT的预后好于胃来源;按绝经前后分为两组,其各自的平均存活时间分别为32.5个月和19.0个月。发生于妊娠期的Krukenberg瘤预后更差。
【回帖精选】
1、linfangfang(3楼)回复:
诊 断:考虑性索-间质肿瘤,seitoli-leydig细胞瘤,中分化。
诊断依据:
低倍镜下见肿瘤细胞呈片状,分叶状生长,高倍见细胞核圆形,卵圆形,胞浆较少,分布于水肿样间质。
鉴别诊断:
1)Sertoli-like 的子宫内膜腺癌:子宫内膜腺癌CK和EMA阳性, Inhibinα和Calretinin阴性,而Sertoli-Leydig细胞瘤相反;
2)颗粒细胞瘤:本病例镜下未见Call-Exner小体和明显核沟。;
3)管状克鲁根勃氏瘤:常累及双侧卵巢,瘤细胞具有明显的异型性,有时呈印戒细胞样;
4)类癌:瘤细胞常排列成条索或丝带样,免疫组化synaptophysin和chromagranin常阳性
5)卵巢肉瘤:低分化Sertoli-Leydig细胞瘤需要与卵巢肉瘤相鉴别,这时需多取材以发现分化较好的Sertoli-Leydig细胞瘤部位。
2、96298(5楼)回复:
诊 断:不大好诊断的肿瘤,需要标记,先考虑转移性低分化癌(乳腺、胃肠等)。
诊断依据:
低倍镜下见肿瘤细胞呈片状,分叶状生长,高倍见细胞核圆形,卵圆形,胞浆较少,分布于水肿纤维性间质中,局部高倍有印戒样细胞,局部促纤维增生明显。
鉴别诊断:
1)、原发低分化/未分化癌,虽然单侧,这种形态和临床我还是先除外转移。
2)、生殖细胞肿瘤:无性细胞瘤,低倍可以,高倍见细胞核特点不大支持,但还是要鉴别的。
3)、性索-间质肿瘤:颗粒细胞瘤与seitoli-leydig细胞瘤,有些细胞有些黄素化,令人迷惑,需结合IHC。
4)、淋巴造血肿瘤:高倍见细胞核有些像淋巴细胞,有些细胞单行排列,结节状结构也可以,如大B,需要鉴别。
5)、促纤维增生性小圆(DSRCT):罕见。
有这样的病史,转移首先考虑,根据所提供的最后图片,核仁明显,胞浆丰富红染,鉴别要加上恶黑了。
3、巴特尔(51楼)回复:
根据免疫组化及特染,组织学结构,并先后双侧卵巢出现肿瘤,虽然临床目前没找到原发灶,根据文献报道,转移灶切除后数月至数年后仍未找到原发灶,本例依然首先考虑转移性腺癌,来自胃肠道,根据多形性印戒细胞为明显组织学类型,应定为克鲁根勃瘤。
【提供者单位及姓名】安徽省宣城市人民医院病理科 陈海玲(xiaocaodi)
【专家点评-董颖老师】
我还是首先考虑为卵巢转移癌,免疫组化染色支持其为胃肠道来源。
讨 论
一部分卵巢肿瘤为转移性,报道比例从5%-25%不等。一半以上来源于胃、大肠、乳腺、阑尾等脏器肿瘤转移,另不到一半来源于女性mullerian系统,如子宫内膜、宫颈、输卵管肿瘤转移,转移性卵巢肿瘤大体上通常具有一些提示性特点:
(1)转移性卵巢肿瘤通常累及双侧卵巢;特别是表面性多结节性肿瘤。而原发卵巢肿瘤通常为单侧发生(除浆液性癌有较高比例的双侧发生外,但浆液性肿瘤大体特征不同于转移性肿瘤,如囊性,乳头等生长方式)。
(2)转移性卵巢肿瘤切面通常均一,实性,很少有囊性结构,而卵巢上皮性肿瘤常常为囊性或囊实性。
(3)原发性卵巢黏液性肿瘤通常(20-30cm)比转移性卵巢黏液性肿瘤(小于10cm)体积大。
(4)大肠癌卵巢转移时,转移瘤通常体积较大,明显出血坏死,且单侧卵巢受累不少见。
胃癌卵巢转移时,组织形态最常表现为印戒细胞癌,即Krukenberg tumor。Krukenberg tumor也可来自肠道(包括阑尾)、乳腺、胰腺、胆道肿瘤转移。多数表现为盆腔包块,而原发瘤隐匿,无明显临床症状。实际上,只有约35%卵巢Krukenberg tumor,其胃肠原发瘤先于卵巢转移瘤被发现与诊断。大体上双卵巢肿大,切片实性,光滑润泽或黏液感。镜下见印戒样肿瘤细胞,胞浆内有黏液,肿瘤细胞可散在分布,或管状、腺样分布。间质可增生,从而富于梭形间质细胞。因而需要与卵巢性索-间质肿瘤,如黄素化的卵泡膜细胞瘤,硬化性间质瘤相鉴别。另外,血管癌栓,促纤维反应,广泛的不常见的卵巢外播散,肿瘤病史都支持卵巢肿瘤为转移性。
另外,从本例的组织形态,也应除外乳腺癌转移,但CDX-2+, villin+,CEA+都更支持胃肠来源,但乳腺癌CEA,CDX-2也可阳性,但villin一定不表达于乳腺癌。另外,本例提到输卵管有癌浸润,应对输卵管肿瘤给予更详细的描述,以除外原发瘤为输卵管来源。因为villin 可以表达于卵巢黏液性肿瘤。对患者胃肠道进行更仔细的检查,无疑是必要的。
最后,也应补充inhibin染色,除外分化差的性索-间质肿瘤,如卵巢粒层细胞肿瘤,低分化的Sertoli-stromal tumor。但这类肿瘤,一般EMA阴性,但AE1/3可以阳性。
感谢安徽省宣城市人民医院病理科陈海玲老师提供病例,个人查阅文献整理相关内容,仅供参考学习!不当之处敬请批评指正!
【参考文献】
[1]Robert J. Kurma, Maria Luisa Carcangiu, C. Simon Herrington, et al. WHO Classification of Tumours of Female Reproductive Organs [M]. Lyon: IARCC, 2014: 83-86.
[2]陈乐真. 妇产科诊断病理学. 北京: 人民军医出版社, 2010年: 404-422.
[3]Kiyokawa T, Young RH, Scully RE. Krukenberg tumors of the ovary: a clinicopathologic analysis of 120 cases with emphasis on their variable pathologic manifestations [J]. Am J Surg Pathol, 2006, 30(3):277-299.
[4]Jeung YJ, Ok HJ, Kim WG, et al. Krukenberg tumors of gastric origin versus colorectal origin [J]. Obstet Gynecol Sci, 2015, 58(1):32-39.
[5]郑文新, 沈丹华, 郭东辉. 妇产科病理学. 北京: 科学出版社, 2013年: 688-692.
[6]Rawasia WF, Chaddha U, El-Kersh K, et al. Dyspnoea and the ovaries: a rare presentation of Krukenberg tumour. BMJ Case Rep, 2013, 1; 2013.








 图2右侧卵巢Krukenberg瘤。
图2右侧卵巢Krukenberg瘤。







共0条评论