胰腺癌长期生存病人临床病理特征及生存质量研究
摘要
目的 通过分析长期生存胰腺癌病人(>5年)的临床病理特征,评价长期生存病人的健康相关生活质量。方法回顾性分析2005年1月至2014年9月于海军军医大学附属长海医院肝胆胰脾外科行手术切除的胰腺癌病人资料,选取有完整临床病理信息、随访>5年并存活的病人112例,对其生活质量进行评估,使用卡方检验进行组间资料比较,Mann-Whitney U检验及Kruskal-Wallis检验进行生存质量分析,探讨长期生存病人生存质量的影响因素。结果长期生存病人中,男性73例(65.2%),女性39例(34.8%),男女比例约为1.87∶1;年龄31~81岁,中位年龄61岁;行胰十二指肠切除术81例(77.3%),远端胰腺切除术31例(27.7%);肿瘤大小范围为0.5~7.0 cm(中位值3.0 cm);高分化4例(3.6%),中分化74例(66.1%),低分化34例(30.4%);淋巴结阳性23例(20.6%),胰周神经侵犯56例(50%)。ⅠA期病人23例(20.5%),ⅠB期病人47例(42.0%),ⅡA期病人16例(14.3%),ⅡB期病人15例(13.4%),Ⅲ期病人8例(7.1%),Ⅳ期病人3例(2.7%)。获得完整生存质量量表的病人58例,功能量表得分四分位间距80~100分,症状量表得分以疲倦、疼痛、腹泻为主,总体健康状况(QOL)中位数为71.7分,四分位间距66.7~77.0分。女性病人疼痛得分高(P<0.05),术中输血的病人角色得分较高(P<0.05),无淋巴结转移(N0)的病人角色功能得分高且气促症状较轻(P<0.05);AB血型病人角色功能得分差(P<0.05)。肿瘤位置、手术方式、T分期、生存时间(年)、术后辅助化疗对生存质量的影响差异无统计学意义。行标准胰十二指肠切除术病人角色功能优于保留幽门的胰十二指肠切除病人(P=0.031)。结论胰腺癌长期生存病人临床病理因素差异巨大,术后长期生存病人拥有较高的生存质量。
基金项目:上海市重中之重项目(No.2017ZZ01009);海军军医大学第一附属医院“234学科攀登计划”项目 (No.2019YXK033)
作者单位:海军军医大学附属长海医院肝胆胰脾外科,上海 200433
通信作者:金钢,E-mail:jingang@sohu.com
胰腺癌发病率和致死率逐年上升。在最新的流行病学统计中,胰腺癌致死人数占全部恶性肿瘤的第4位,胰腺癌5年总体存活率最低仅为9%[1],预计到2030年,胰腺癌很可能成为导致癌症死亡的第二大原因[2]。外科技术的进步和综合治疗的发展提高了肿瘤局部控制率和总存活率,根治性手术后胰腺癌病人5年存活率可达到21%[3-6],但对这部分长期生存病人分析发现,TMN分期、切缘状态和分化程度等常规预后的预测因素并不能有效判断病人能否获得5年以上长期生存[6-7]。部分原发灶和转移灶姑息切除的晚期胰腺癌病人仍能获得5年以上长期生存[8-9]。因此,有必要对生存期>5年的胰腺癌病人临床病理因素进行再分析。同时,生存质量(QOL)和生存时间存在一定联系, QOL是反映胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)病人预后的重要指标[10],目前缺少有关5年以上长期生存PDAC病人QOL的研究。本研究通过回顾性分析经病理学检查证实的PDAC手术切除后存活>5年病人的临床病理特征和QOL资料,探讨长期生存病人的临床病理特征分布及其与QOL的关系,为提高胰腺癌病人长期存活率和QOL提供理论依据。报告如下。
1资料与方法
1.1一般资料回顾性分析2005年1月至2014年9月在海军军医大学附属长海医院行手术切除并且存活时间>5年的PDAC病人资料,对胰头部肿瘤病人采用胰十二指肠切除术(pancreaticoduodenectomy,PD)联合淋巴结清扫,胰体尾部肿瘤采用根治性顺行模块化胰腺切除术[11],所有手术均由高年资副教授以上医师完成;并由两名专业病理科医生对其病理学诊断进行了复核,确认病理学诊断为PDAC(或腺鳞癌),不包括任何其他种类的胰腺肿瘤(如腺泡细胞癌,神经内分泌肿瘤或黏液性癌等)。收集病人的临床病理信息包括性别、年龄、总胆红素(TBIL)、白蛋白(ALB)、肿瘤标记物、手术日期、手术方式、术中输血、手术时间、病理学类型、分化、肿瘤最大直径、淋巴结情况、美国癌症联合委员会(AJCC)第8版分期等,并进行随访资料收集。其中112例病人截至2019-09-30证实存活,58例病人返回了完整的QOL量表信息。QOL评估采用EORTC QLQ-C30调查问卷,包含30项问题,可测量QOL评分,功能评分(身体,角色,认知,情感和社交),症状评分(疲劳,疼痛,恶心和呕吐),以及一些评估癌症病人通常报告的其他症状(例如呼吸困难,食欲不振,失眠,便秘和腹泻)的单一项目[12]。EORTC量表经过线性变换得到0~100的评分范围,以标准化原始评分[13]。为保证资料的收集和数据质量,同时采用门诊复诊和电话方式进行QOL问卷的调查回访,两名独立的记录员将结果数字化,然后对差异进行审查和纠正,直到达成完全一致,由专门人员进行问卷回收和数据录入。
1.2统计学方法采用SPSS24.0软件进行统计分析。PD的病人进行亚组分析,分为标准PD(常规组)和保留幽门的PD(pylorus-preserving pancreatoduodenectomy,PPPD)(保留幽门组),对非正态分布的数据采用Mann-Whitney U检验进行组间比较,评估亚组之间的评分差异。P<0.05为差异有统计学意义。
2结果
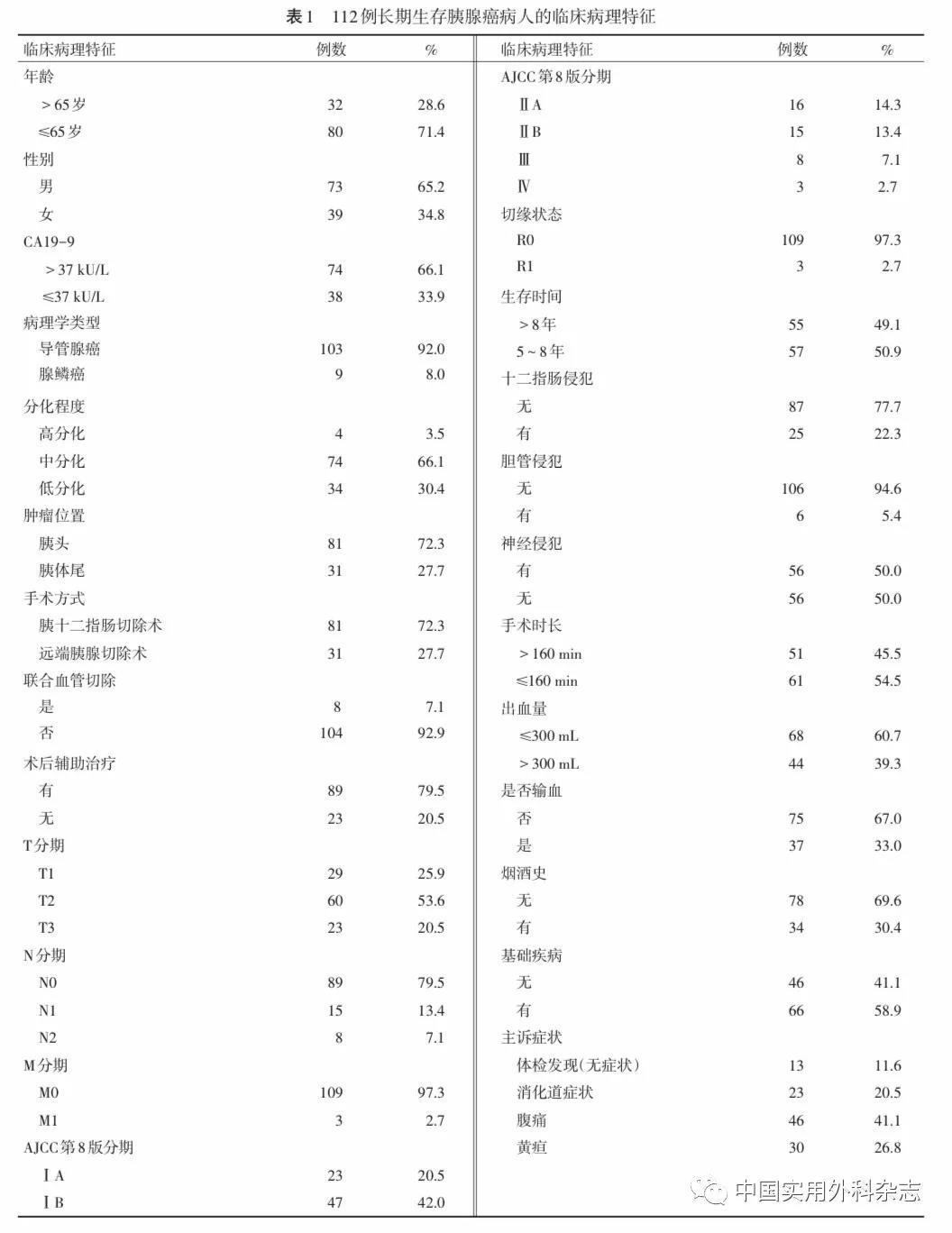
长期生存病人中,男性73例(65.2%),女性39例(34.8%),男女比例约为1.87∶1;年龄31~81岁,中位年龄61岁;81例(72.3%)病人的肿瘤位于胰头部,31例(27.7%)肿瘤位于胰体尾;81例(77.3%)接受了胰十二指肠切除术,31例(27.7%)行远端胰腺切除术;8例(7.1)术中联合血管切除重建,104例(92.9%)未行血管切除重建;术中输血37例(33.0%),未输血75例(67.0%),3例(2.7%)为R1切除。74例(66.1%)病人术前CA19-9水平升高>37 kU/L。术后病理学诊断中肿瘤直径范围为0.5~7.0 cm(中位3.0 cm);高分化4例(3.6%),中分化74例(66.1%),低分化34例(30.4%);发生淋巴结转移23例(20.6%),胰周神经侵犯56例(50%)。ⅠA期病人23例(20.5%),ⅠB期47例(42.0%),ⅡA期16例(14.3%),ⅡB期15例(13.4%),Ⅲ期8例(7.1%),Ⅳ期3例(2.7%)。有89例(79.5%)病人经过术后辅助治疗。病人生存期为60~159个月(中位随访时间107个月)(见表1)。胰腺癌长期生存病人中临床病理学参数存在较大的差异,部分长期生存病人存在明显预后不良的因素。
EORTC QLQ-C30中文版的信度和效度已在之前的研究中得到了证明[14],可在我国人群中使用。本组病人问卷信度系数为0.732,>0.7,因而说明研究数据信度质量很良好,可用于进一步分析。
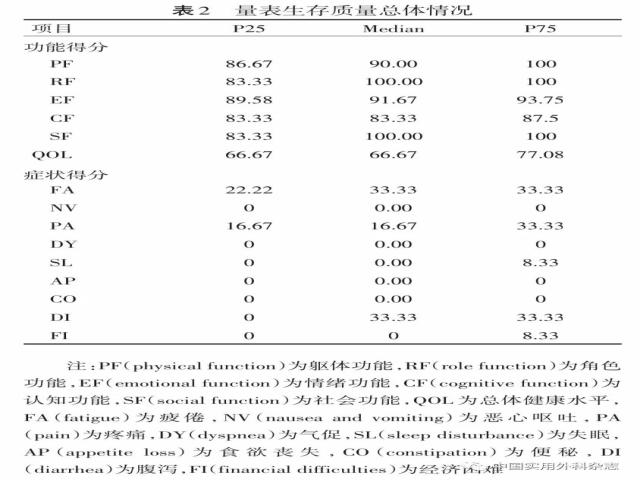
通过问卷调查算出QOL量表各项目评分,得出本组所有病人的功能评分均较高,四分位间距达80~100分;而症状量表评分除疲倦、疼痛腹泻外其他均较低,总体QOL中位数为71.7分,四分位间距66.7~77分(见表2)。
对其QOL进行评估后,按照临床病理因素进行各个亚组分析,采用Mann-Whitney U检验及Kruskal-Wallis检验进比较发现在各项临床病理因素中,无淋巴结转移(N0)比淋巴结阳性病人(N1、N2)角色功能(RF)更佳,气促(DY)症状较轻(P<0.05)。女性病人疼痛(PA)评分较男性病人高(P<0.05),发生术中输血的病人较未输血病人角色评分较高(P<0.05),经济困难(FI)程度较低(P<0.05)。AB血型病人RF评分差,经济困难(FI)程度高(P<0.05)。肿瘤位置,手术方式,T分期、生存时间(单位)、术后辅助化疗对QOL的影响差异无统计学意义。
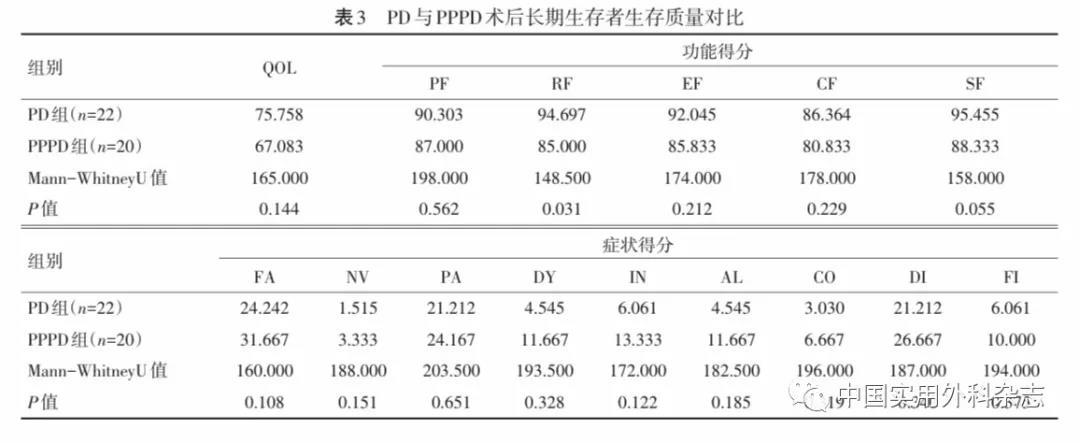
进一步对病人亚组分析结果显示,对于长期生存病人,常规组RF优于保留幽门组(P=0.031),躯体、角色、情绪、社会功能均未见明显差异(表3)。
3讨论
PDAC以局部侵袭性强、转移早、临床预后差而著称,只有小部分病人能从治疗中获益。此外,即使手术切除成功,病人的5年存活率也很低。既往研究已经确定了一些影响手术切除后长期生存的预后因素,如肿瘤大小及位置、病理分化、淋巴结转移状态、神经浸润状态等[6,15-26]。然而,这些因素并不能很好地预测>5年的长期生存。这可能与纳入研究的长期生存病人数量不足有关。因此,笔者回顾性分析了海军军医大学附属长海医院胰腺外科中心长期存活者的临床病理特征,试图与既往其他研究中确定的预后因素进行比较。
早期研究确认肿瘤大小是胰腺癌切除后长期生存的预后因素。Pantalone等[27]在2001年的研究中发现,肿瘤直径<2 cm的胰腺癌病人有更长的中位生存期和更高的5年存活率,18例长期生存的PDAC病人中有9例肿瘤直径<2 cm。Michelakos等[28]发现PDAC肿瘤直径>2.5 cm是总体存活率下降的独立预测因子(HR=1.7,P=0.03)。然而本研究中83例病人术后病理提示肿瘤直径>2 cm,甚至有23例病人达到T3分期,肿瘤直径>4 cm。越来越多的研究表明,胰腺癌病人的淋巴结状况与长期生存之间有直接关联[29-30]。Konstantinidis等[31]发现淋巴结转移是不良预后的重要预测因子,及与淋巴结有转移的病人相比,N0病人的生存期明显延长(N0 30.8个月vs. N1 16.4个月;P<0.01)。Katz等[32]在多变量分析中发现淋巴结阴性(HR=1.92,P=0.02)与5年存活率显著相关。Robinson等[33]调查了134例接受PD治疗PDAC的病人,其中78%肿瘤为T3期。T3N0期病人的5年存活率为71%,而T3N1期病人的5年存活率为11.5%(P<0.05)。本研究中23例病人有淋巴结转移,甚至8例病人达到N2;有3例病人同时肿瘤>4 cm并伴有淋巴结转移和神经浸润存活5年以上,甚至2例病人术后病理学检查提示肝转移,行转移灶切除后获得长期生存。该2例转移病人术后病理学检查证实分别为T3N0M1(中分化)和T1N0M1(低分化),术后均行辅助化疗;既往研究证实CA19-9与胰腺癌的肿瘤负荷、临床分期相关。Kimura等[34]发现术前CA19-9<40 kU/L与更高的5年存活率相关。然而本研究中74例病人术前CA19-9大于正常值,其中15例术前CA19-9>200 kU/L,14例>1000 kU/L。
胰腺癌的扩大手术联合腹膜后淋巴结清扫及血管切除尚未被可靠地证实能给胰腺癌病人长期生存带来益处。Leach等[35]研究发现行PD联合门静脉肠系膜上静脉切除重建的病人与行标准PD的病人生存时间差异无统计学意义。一项系统回顾性研究显示,标准手术和扩大手术的5年存活率差异无统计学意义,但扩大手术病人的并发症明显增多[36]。Farnell等[37]的研究显示,扩大手术与病人生存获益无关,但增加了术后并发症。本研究中8例病人行血管切除重建,包括联合门静脉或肠系膜静脉切除的病人5例,联合动脉切除3例,其中有1例行扩大胰体癌根治术联合门静脉、肝动脉切除重建的病人也存活5年以上。切缘阴性(R0)是胰腺癌切除后与长期生存相关的预后因素之一[38-40]。Howard等[38]发现切缘阴性的R0切除(HR=1.39,P<0.03)与存活率提高有关。Ferrone等[39]对长期生存病人的研究也发现R0切除与长期生存显著相关[41]。本研究中有3例病人术后病理学检查提示R1切除,无R2切除。同时被认为恶性程度更高的腺鳞癌亚型[42]也有9例长期生存病人。目前所有的临床研究都证实胰腺癌是一种系统的全身性疾病,临床指南普遍推荐对所有的胰腺癌病人行术后辅助治疗,对部分病人行新辅助治疗。目前PRODIGE 24试验术后胰腺癌病人采用改良FOLFIRINOX辅助治疗术后胰腺癌病人中位生存期为54.4个月[43],为目前胰腺癌临床试验最长存活期,但纳入的PDAC病人标准严格,要求R0或R1切除、PS评分≤1、一般功能良好且术后CA19-9水平<180 kU/L。最近的一项基于NCDB的倾向性评分匹配分析显示,是否早期化疗与长期存活率有显著相关性,66 d内接受化疗的病人5年存活率为20%,未在66 d内接受化疗的病人5年存活率为18%(P=0.0266)[44]。术后辅助治疗是胰腺癌病人取得长期生存的关键因素,然而在本研究中有23例病人术后未行辅助放化疗却获得长期生存。
以上因素均为既往研究证实的与胰腺癌长期生存的相关因素,根据其建立的模型可预测PDAC的长期生存,但具体到某例病人是否能长期生存(>5年),受影响因素较多[7],随着对免疫状态、肿瘤微环境、肠道菌群等在胰腺癌发生发展过程中作用机制研究的深入,可能需要考虑将更多指标纳入模型。Riquelme等[45]的研究发现了胰腺癌病人肠道菌群状态和免疫系统在影响长期生存中的作用,并确定了胰腺癌相关的菌群特征。
目前胰腺癌术后QOL研究受到随访时间短和应答率不理想的限制,结果存在很多不一致性。Pezzilli等[46]最近的一项研究评估了197例行PD 2年后病人的QOL,与年龄和性别相匹配的对照组相比,该组病人的整体健康评分较低。Cloyd等[47]对217例接受PD治疗的病人进行了QOL分析,中位随访时间为4.5年,总体具有较好的QOL。目前对PD后随访时间>5年的病人进行的最大的QOL比较研究中,Huang等[48]比较了行PD病人(n=192)及行腹腔镜胆囊切除术病人(n=37)与健康对照(n=31)的QOL评分,未见明显差异。在本研究中,胰腺癌长期生存者症状量表评分以疲倦、疼痛、腹泻为主,总体表现出较高的总体QOL评分(中位数为71.7分,四分位间距66.7~77.0分)。由于长期生存的病人中女性病人的疼痛评分更高,可考虑在长期随访中更加关注其疼痛治疗;同时对于有淋巴结转移的病人角色评分较低,在随访的同时建议给予更多人文关怀。胰十二指肠切除手术对于幽门处理方法有两种,即PPPD或PD[49]。有研究认为保留幽门会导致胃排空延迟(DGE)发生率增加,主要原因是术后幽门血供和神经支配的变化而引起的术后痉挛。一些关于是否保留幽门的研究和临床试验均未显示PPPD具有优越性[50-53]。最近的一篇Meta分析提示对于术后DGE、胰瘘、病死率、出血、手术时长和住院时间,PPPD均不优于PD[54]。但是,有关 PPPD和PD的长期数据目前尚少,因此,关于是否保留幽门仍存争议。既往关于PD后长期随访(中位随访时间34.3个月)研究提示病人QOL差异无统计学意义[55],本研究结果显示,在行PD的长期生存者中,行保留幽门手术的病人远期RF更低(P=0.031)。
由于健康状况不佳或疾病进展的病人参加临床研究的依从性差,而健康状况良好的病人更乐于参加临床研究,因此,本研究结果可能存在选择偏倚,可能会高估长期生存PDAC病人的QOL。另外,本研究数据仅来自一家医院,不足以代表目前国内胰腺癌诊治情况,临床尚需进行多中心前瞻性研究以进一步证实。
参考文献
[1]Siegel RL,Miller KD,Jemal A. Cancer statistics,2020 [J].CA Cancer J Clin,2020,70(1):7-30.
[2]Rahib L,Smith BD,Aizenberg R,et al.Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States[J].Cancer Res,2014,74(11):2913-2921.
[3]Schnelldorfer T,Ware AL,Sarr MG,et al.Long-term survival after pancreatoduodenectomy for pancreatic adenocarcinoma: is cure possible?[J].Ann Surg,2008,247(3):456-462.
[4]Woo SM,Ryu JK,Lee SH,et al.Survival and prognosis of invasive intraductal papillary mucinous neoplasms of the pancreas: comparison with pancreatic ductal adenocarcinoma[J].Pancreas,2008,36(1):50-55.
[5]Murakami Y,Uemura K,Sudo T,et al.Invasive intraductal papillary-mucinous neoplasm of the pancreas: comparison with pancreatic ductal adenocarcinoma[J].J Surg Oncol,2009,100(1):13-18.
[6]Shimada K,Sakamoto Y,Nara S,et al.Analysis of 5-year survivors after a macroscopic curative pancreatectomy for invasive ductal adenocarcinoma[J].World J Surg,2010,34(8):1908-1915.
[7]Shin SH,Kim SC,Hong SM,et al.Can statistically determined prognostic factors predict the long-term survival of patients with pancreatic ductal adenocarcinoma following surgical resection?[J].Pancreas,2014,43(4):571-577.
[8]徐燕立,高嵩,刘鲁明,等.晚期胰腺癌长期生存患者20例临床分析[J].中华中医药杂志,2014,29(8): 2679-2681.
[9]Oh SY,Edwards A,Mandelson MT,et al.Rare long-term survivors of pancreatic adenocarcinoma without curative resection[J].World J Gastroenterol,2015,21(48):13574-13581.
[10]Deng Y,Tu H,Pierzynski JA,et al.Determinants and prognostic value of quality of life in patients with pancreatic ductal adenocarcinoma[J]. Eur J Cancer,2018,92:20-32.
[11]金钢,郑楷炼. 胰腺癌手术质量控制[J]. 中国实用外科杂志, 2016, 36(1):19-21.
[12]Aaronson NK,Ahmedzai S,Bergman B,et al. The European organization for research and treatment of cancer QLQ-C30: A quality-of-life instrument for use in international clinical trials in oncology[J]. J Natl Cancer Inst,1993,85(5): 365-376.
[13]Fayers pman BK,Groenvold M. The Eortc QLQ-C30 scoring manual[M]. 3rd ed .EORTC,Brussels,2001.
[14]万崇华,陈明清,张灿珍,等.癌症患者生命质量测定量表EORTC QLQ-C30中文版评介 [J].实用肿瘤杂志,2005,20(4): 353-355.
[15]Bakkevold KE, Kambestad B.Long-term survival following radical and palliative treatment of patients with carcinoma of the pancreas and papilla of Vater--the prognostic factors influencing the long-term results. A prospective multicentre study[J].Eur J Surg Oncol,1993,19(2):147-161.
[16]Kuhlmann KF,De Castro SM,Wesseling JG,et al.Surgical treatment of pancreatic adenocarcinoma: actual survival and prognostic factors in 343 patients[J].Eur J Cancer,2004,40(4):549-558.
[17]Geer RJ , Brennan MF. Prognostic indicators for survival after resection of pancreatic adenocarcinoma [J]. Am J Surg,1993,165(1): 68-72.
[18]Fortner JG,Klimstra DS,Senie RT,et al.Tumor size is the primary prognosticator for pancreatic cancer after regional pancreatectomy[J].Ann Surg,1996,223(2):147-153.
[19]Van Geenen RC,Van Gulik TM,Offerhaus GJ,et al.Survival after pancreaticoduodenectomy for periampullary adenocarcinoma: an update[J].Eur J Surg Oncol,2001,27(6):549-557.
[20]Kedra B,Popiela T,Sierzega M,et al.Prognosis factors of long term survival after resective procedures for pancreatic cancer[J]. Hepatogastroenterology,2001,48(42):1762-1766.
[21]Adham M,Mirza DF,Chapuis F,et al.Results of vascular resections during pancreatectomy from two European centres: an analysis of survival and disease-free survival explicative factors[J].HPB (Oxford),2006,8(6):465-473.
[22]Zacharias T,Jaeck D,Oussoultzoglou E,et al.Impact of Lymph Node Involvement on Long-term Survival after R0 Pancreaticoduodenectomy for Ductal Adenocarcinoma of the Pancreas[J].J Gastrointest Surg,2007,11(3):350-356.
[23]Ahmad NA,Lewis JD,Ginsberg GG,et al.Long term survival after pancreatic resection for pancreatic adenocarcinoma[J].Am J Gastroenterol,2001,96(9):2609-2615.
[24]Yoshizawa K,Nagai H,Kurihara K,et al.Long-term survival after surgical resection for pancreatic cancer[J]. Hepato-gastroenterology,2001,48(40):1153-1156.
[25]Nakao A,Harada A,Nonami T,et al.Clinical significance of carcinoma invasion of the extrapancreatic nerve plexus in pancreatic cancer[J].Pancreas,1996,12(4):357-361.
[26]Ozaki H,Hiraoka T,Mizumoto R,et al.The prognostic significance of lymph node metastasis and intrapancreatic perineural invasion in pancreatic cancer after curative resection[J].Surg Today,1999,29(1):16-22.
[27] Pantalone D,Ragionieri I,Nesi G,et al.Improved survival in small pancreatic cancer[J].Dig Surg,2001,18(1):41-46.
[28]Michelakos T,Pergolini I,Castillo CF,et al.Predictors of resectability and survival in patients with borderline and locally advanced pancreatic cancer who underwent neoadjuvant treatment with FOLFIRINOX[J].Ann Surg,2019,269(4):733-740.
[29]李佶松, 田孝东, 高红桥,等. 胰腺癌术后预后因素分析及AJCC第8版TNM分期意义评价(附143例报告)[J]. 中国实用外科杂志, 2018, 38(7): 786-791.
[30]任泰,郭世伟,王伟珅,等. 基于淋巴结分期评分的胰腺癌手术淋巴结清扫数目探讨(附四中心临床研究结果)[J]. 中国实用外科杂志, 2019, 39(6):584-589.
[31]Konstantinidis IT,Deshpande V,Zheng H,et al.Does the mechanism of lymph node invasion affect survival in patients with pancreatic ductal adenocarcinoma?[J].J Gastrointest Surg,2010,14(2):261-267.
[32]Katz MH,Wang H,Fleming JB,et al.Long-term survival after multidisciplinary management of resected pancreatic adenocarcinoma[J].Ann Surg Oncol,2009,16(4):836-847.
[33]Robinson S,Rahman A,Haugk B,et al.Metastatic lymph node ratio as an important prognostic factor in pancreatic ductal adenocarcinoma[J].Eur J Surg Oncol,2012,38(4):333-339.
[34]Kimura K,Amano R,Nakata B,et al.Clinical and pathological features of five-year survivors after pancreatectomy for pancreatic adenocarcinoma[J].World J Surg Oncol,2014,12(1):360.
[35]Leach SD,Lee JE,Charnsangavej C,et al.Survival following pancreaticoduodenectomy with resection of the superior mesenteric-portal vein confluence for adenocarcinoma of the pancreatic head[J].Br J Surg,1998,85(5):611-617.
[36]Michalski CW,Kleeff J,Wente MN,et al.Systematic review and meta-analysis of standard and extended lymphadenectomy in pancreaticoduodenectomy for pancreatic cancer[J].Br J Surg,2007,94(3):265-273.
[37]Farnell MB,Aranha GV,Nimura Y,et al.The role of extended lymphadenectomy for adenocarcinoma of the head of the pancreas: strength of the evidence[J].J Gastrointest Surg,2008,12(4):651-656.
[38]Howard TJ,Krug JE,Yu J,et al.A Margin-negative R0 resection accomplished with minimal postoperative complications is the surgeonu0027s contribution to long-term survival in pancreatic cancer[J].J Gastrointest Surg,2006,10(10):1338-1346.
[39]Ferrone CR,Brennan MF,Gonen M,et al.Pancreatic adenocarcinoma: the actual 5-year survivors[J].J Gastrointest Surg,2008,12(4):701-706.
[40]Konstantinidis I,Warshaw AL,Allen JN,et al.Pancreatic ductal adenocarcinoma: is there a survival difference for R1 resections versus locally advanced unresectable tumors? What is a "true" R0 resection?[J].Ann Surg,2013,257(4):731-736.
[41]李勃,郭世伟,蒋慧,等.胰腺癌手术切缘共识与争议[J]. 中国实用外科杂志, 2019,39(9):983-987.
[42]Boyd CA,Benarroch-Gampel J,Sheffield KM,et al.415 patients with adenosquamous carcinoma of the pancreas: a population-based analysis of prognosis and survival[J].J Surg Res,2012,174(1):12-19.
[43]Conroy T,Hammel P,Hebbar M,et al.FOLFIRINOX or gemcitabine as adjuvant therapy for pancreatic cancer[J].N Engl J Med,2018,379(25):2395-2406.
[44]White RJ,Hasan S,Monga D,et al.Time to adjuvant systemic therapy following pancreatic cancer resection and effect on outcome[J].Pancreas,2019,48(8):1086-1091.
[45]Riquelme E,Zhang Y,Zhang L,et al.Tumor microbiome diversity and composition influence pancreatic cancer outcomes[J].Cell,2019,178(4):795-806.
[46]Pezzilli R,Falconi M,Zerbi A,et al.Clinical and patient-reported outcomes after pancreatoduodenectomy for different diseases: a follow-up study[J].Pancreas,2011,40(6):938-945.
[47]Cloyd JM,Cao HS,Petzel MQ,et al.Impact of pancreatectomy on long-term patient-reported symptoms and quality of life in recurrence-free survivors of pancreatic and periampullary neoplasms[J].J Surg Oncol,2017,115(2):144-150.
[48]Huang JJ,Yeo CJ,Sohn TA,et al.Quality of life and outcomes after pancreaticoduodenectomy[J].Ann Surg,2000,231(6):890-898.
[49]Klaiber U,Probst P,Büchler MW,et al.Pylorus preservation pancreatectomy or not[J].Transl Gastroenterol Hepatol,2017,2:100.
[50]Hackert T,Bruckner T,Dörr-Harim C,et al.Pylorus resection or pylorus preservation in partial pancreatico-duodenectomy (PROPP study): study protocol for a randomized controlled trial[J].Trials,2013,14(1):44.
[51]Hackert T,Probst P,Knebel P,et al.Pylorus resection does not reduce delayed gastric emptying after partial pancreatoduodenectomy: a blinded randomized controlled trial (PROPP Study, DRKS00004191)[J].Ann Surg,2017,267(6):1021-1027.
[52]Kurahara H,Takao S,Shinchi H,et al.Subtotal stomach-preserving pancreaticoduodenectomy (SSPPD) prevents postoperative delayed gastric emptying[J].J Surg Oncol,2010,102(6):615-619.
[53]Matsumoto I,Shinzeki M,Asari S,et al.A prospective randomized comparison between pylorus- and subtotal stomach-preserving pancreatoduodenectomy on postoperative delayed gastric emptying occurrence and long-term nutritional status[J].J Surg Oncol,2014,109(7):690-696.
[54]Klaiber U,Probst P,Strobel O,et al.Meta-analysis of delayed gastric emptying after pylorus-preserving versus pylorus-resecting pancreatoduodenectomy[J].Br J Surg,2018,105(4):339-349.
[55]Klaiber U,Probst P,Hüttner FJ,et al.Randomized trial of pylorus-preserving vs. pylorus-resecting pancreatoduodenectomy: long-term morbidity and quality of life[J].J Gastrointest Surg,2020,24(2):341-352.
责任编辑:华夏病理 本站欢迎原创文章投稿,来稿一经采用稿酬从优,投稿邮箱tougao@ipathology.com.cn
相关阅读
 数据加载中
数据加载中
我要评论

热点导读
-

淋巴瘤诊断中CD30检测那些事(五)
强子 华夏病理2022-06-02 -

【以例学病】肺结节状淋巴组织增生
华夏病理 华夏病理2022-05-31 -

这不是演习-一例穿刺活检的艰难诊断路
强子 华夏病理2022-05-26 -

黏液性血性胸水一例技术处理及诊断经验分享
华夏病理 华夏病理2022-05-25 -

中老年女性,怎么突发喘气困难?低度恶性纤维/肌纤维母细胞性肉瘤一例
华夏病理 华夏病理2022-05-07







共0条评论