[导读] 来源:跟我一起会诊086公众号;作者:潘华雄
当年我分配到病理科,工会罗主席去组织部领我,然后带我去病理科,在去病理科的途中,罗主席说,病理科医生就是法官,决定人的生死。罗主席退休后我就再也没有见过她,我也已经离开那家医院多年,但罗主席的这个比喻我已经记住了,尽管这个比喻并不十分恰当。病理科医生绝不是做法官那么简单,这里不是贬低法官的意思,病理医生应该是身兼法官、辩方律师、控方律师的职责。一个病理诊断,相当于一份判决书,这是综合了各种证据,包括临床、形态、免疫、分子,参照WHO标准,排除了一系列相似疾病,得出的判决。这个过程应该相当严谨,是辩方律师与控方律师经过激烈的法庭内交锋、相互质证,引用法典,法官根据控辩双方的辩论结果最终做出判决,这是一个多么激动人心的场景。如果控辩双方加法官三位一体,这个场景就不是那么美丽了,见过疯人院的描述,恐怕就是如此。面对病例的时候,控方律师以抢劫罪起诉,辩方律师以盗窃罪辩护,法官说考虑抢劫罪,不排除盗窃罪,也存在无罪可能,请上级法官判案,这场景像不像疯人院里面的场景?
现在的病理诊断,已经逐渐摆脱了经验为主的模式,证据加逻辑分析构成了今天淋巴瘤诊断的思维模式,充分体现了在证据面前人人平等。每当看到一份病理检查报告,我会对其诊断进行逻辑推理,看看是不是证据充分,适用法律是否准确等等。今天我们一起分析上周六送来的会诊病历。
病例
男性,30岁,升结肠活检。

病理诊断为T细胞淋巴瘤,符合肠病相关性T细胞淋巴瘤。这份判决无效,理由如下:
1、 T细胞淋巴瘤分为前驱和外周,该判决没有明确,尽管“符合肠病相关性T细胞淋巴瘤”提示这是一个外周T细胞淋巴瘤;
2、 WHO(2008)分类将肠病相关性T细胞淋巴瘤分为I型与II型,在WHO(2017)分类中,已经将肠病相关性T细胞淋巴瘤II型改名为单形性嗜上皮性肠道T细胞淋巴瘤,原来的I型继承了肠病相关性T细胞淋巴瘤这一名称。本次判决没有说明依据的哪一个WHO版本。从原单位的病理描述里面,推测是考虑WHO(2008)的肠病相关性T细胞淋巴瘤II型,即WHO(2017)的单形性嗜上皮性肠道T细胞淋巴瘤。
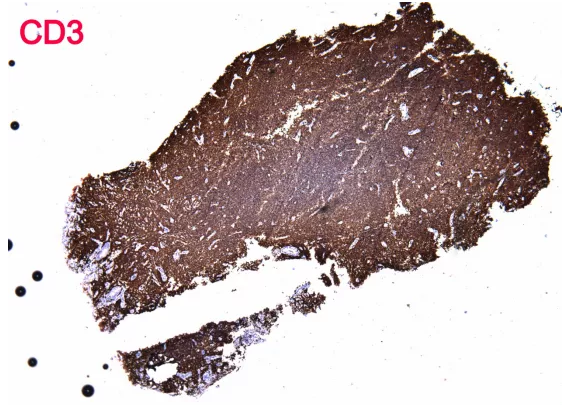
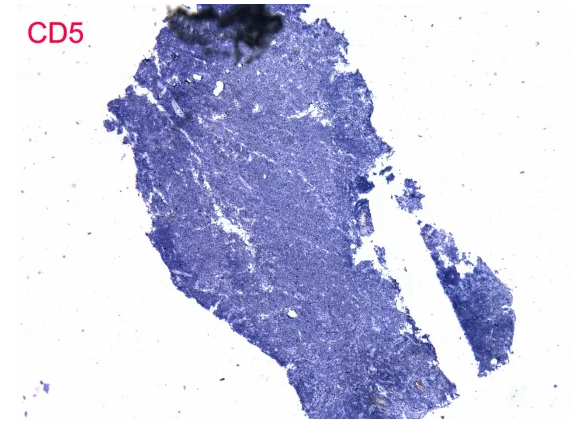
3、 证据不充分。单形性嗜上皮性肠道T细胞淋巴瘤形态是单一形态、小至中等大小细胞,表达CD3及CD56,不表达CD5及EBER,本病例符合,但是其他证据嗜上皮、CD4与CD8的表达情况、细胞毒性分子的表达情况没有。
4、 病变部位不典型。WHO(2017)关于发病部位的描述:这种疾病最常出现在小肠,空肠比回肠更容易受到影响。肿瘤肿块,无论有没有溃疡,都很常见。肠粘膜内常可见弥漫性播散。系膜淋巴结受累较常见。也可能涉及胃(5%的病例发生)或大肠(16%的病例。随着扩散,多个结外部位可能会受累。本病例发生于大肠,属于少见部位。
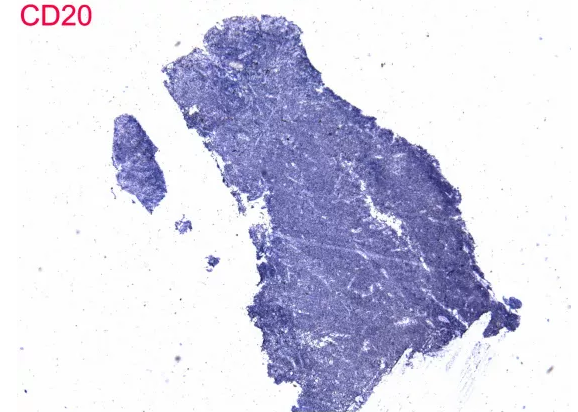
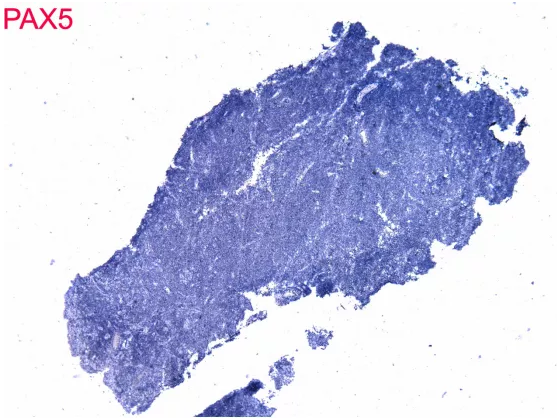
5、 程序不合法。本病例考虑T细胞淋巴瘤,但是免疫标记中大量出现B细胞标记,而缺乏诊断所必须的T细胞标记、细胞毒性标记,可见其并没有阅读本人的公众号文章“淋巴瘤免疫组化初筛套餐——非常6+1”。Vimentin在淋巴瘤的诊断中毫无价值,对于分类方向的选择也没有价值,这里属于滥用。
有了这么多的理由,我并不能说这份报告就是完全错误的,只能说明其证据不充分,可信度存疑。现在来看看具体的形态。
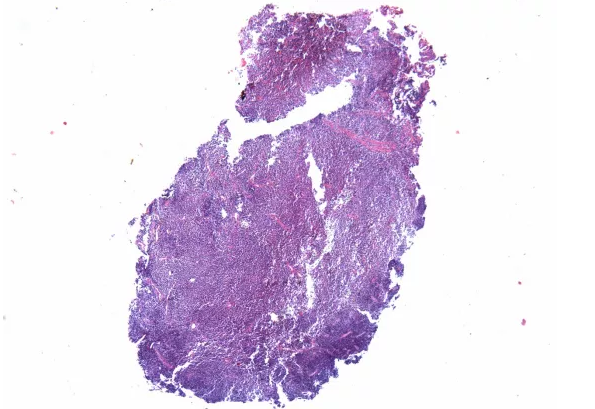
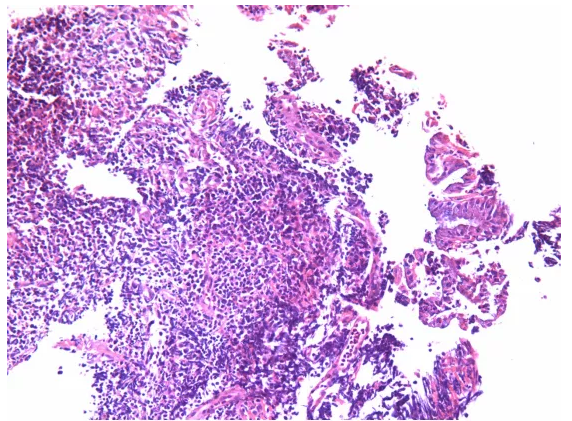
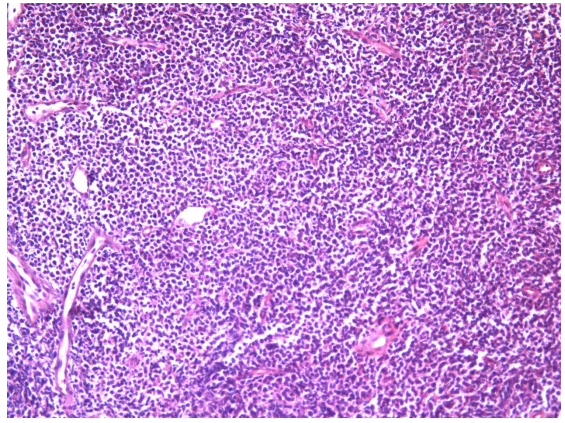
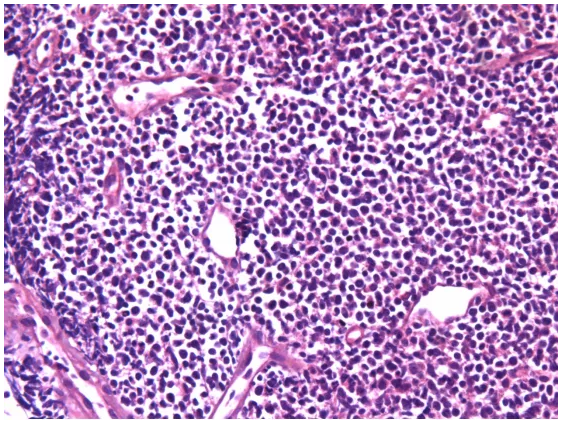
原单位对于形态的描述似乎是准确的,单一细胞形态,小至中等大小细胞。只是细胞形态存在明显收缩,所有细胞有些透亮,说明组织固定不充分。
染色强度可以,明确阳性,但是存在染色不均,明显周边强,中间弱,这种染色效果大多与免疫白片的质量不佳有关。

也存在染色不均的现象

原单位做了BCL6,但是不评判。怀疑是非特异着色,因为不是关键性指标,我也就不重复了。
缺乏对照,非关键性指标
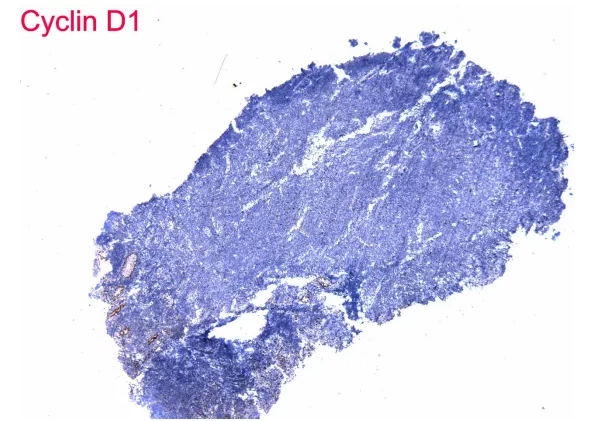
内对照上皮阳性,染色成功
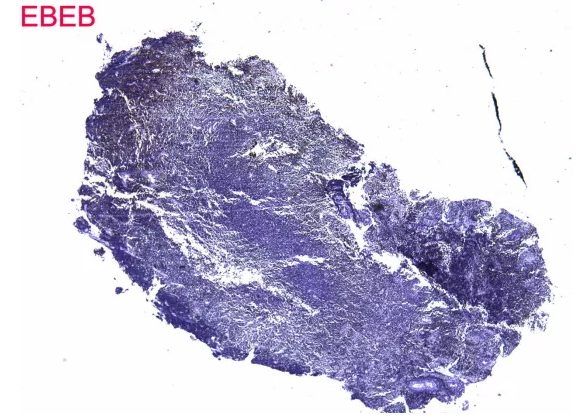
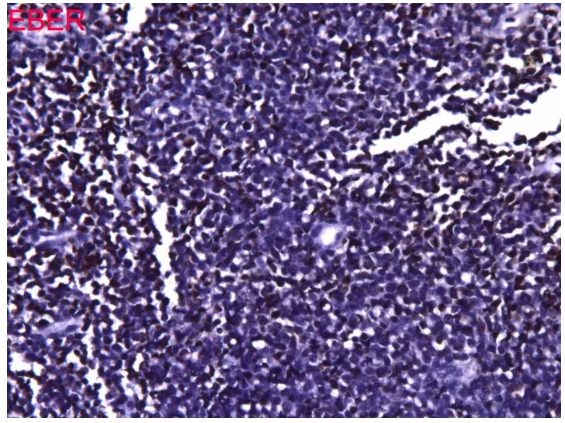
EBER,这是阳性还是阴性?,结果可信吗?

EBER外对照染色良好,EBER结果可信
肠道T细胞淋巴瘤包含有多种疾病,不是说发生在肠道的T细胞淋巴瘤就是肠病T,这一点让我想起20年前刚刚听说MALT淋巴瘤,理解为发生为黏膜部位的淋巴瘤就是MALT淋巴瘤。
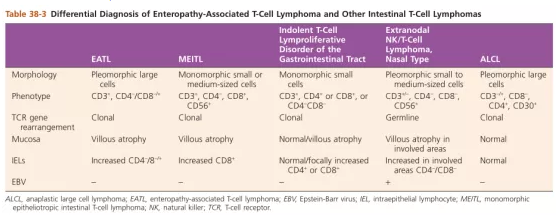
Hematopathology 2nd
上图为肠病相关性T细胞淋巴瘤及其鉴别诊断,EBER阳性的只有结外NK/T细胞淋巴瘤,经典的免疫表型为CD3、CD56阳性,CD5、CD4、CD8阴性,同时表达TIA-1及Gran B,与之最重要的鉴别诊断就是单形性嗜上皮性肠道T细胞淋巴瘤,经典的免疫表型为CD3、CD56、CD8阳性,CD4、CD5阴性,表达TIA-1,表达Gran B少见,不存在EBV感染。
我假设原单位按照我前面提到把所有指标全部做全了,情形会是怎么?下面的是我们的免疫组化,就当是原单位做的。

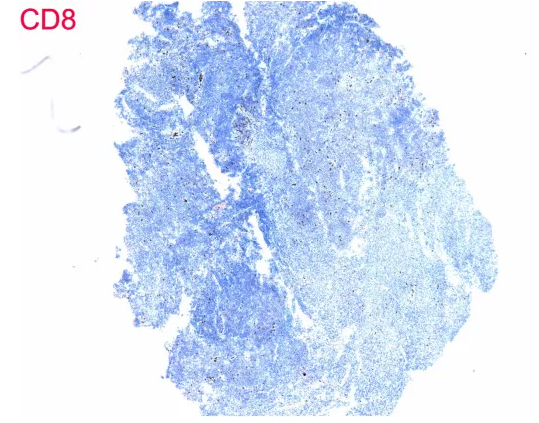
单形性嗜上皮性肠道T细胞淋巴瘤一般CD4阴性,CD8阳性,这个不符

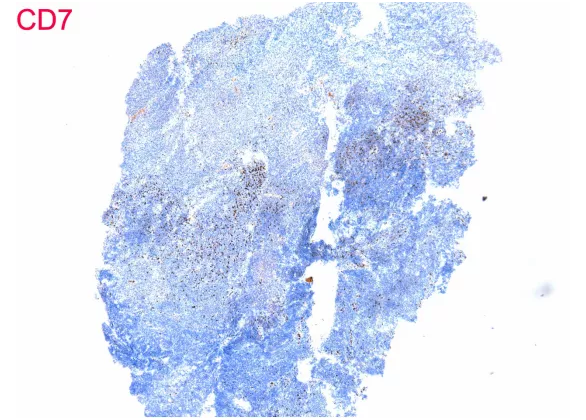
T细胞有CD3、CD2表达,CD5、CD7、CD4、CD8表达缺失

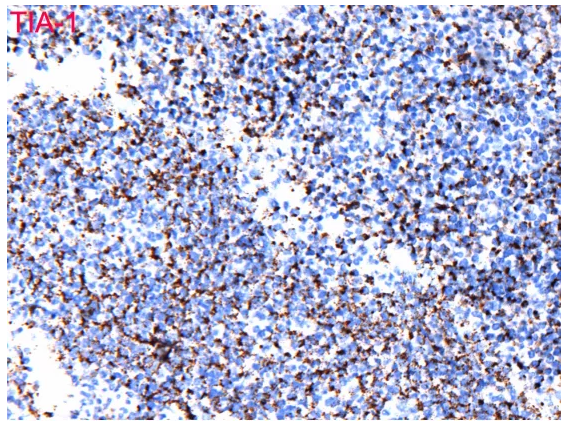

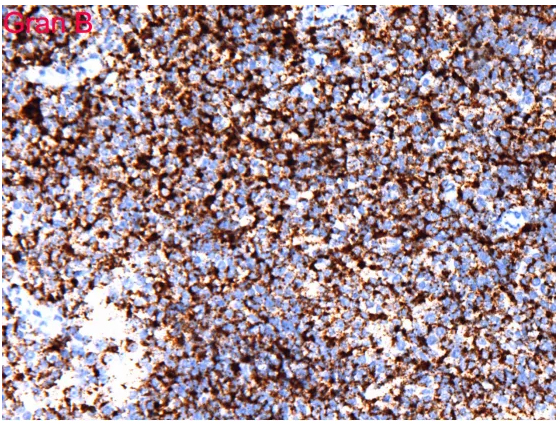
细胞毒标记TIA-1及Gran B均表达
这个时候该看书了,先看WHO(2017)

GOOGLE翻译:免疫表型MEITL具有独特的免疫表型,绝大多数病例CD3、CD8和CD56呈阳性{746}。大多数肿瘤缺乏CD5,这一特征提示存在γδT细胞来源。T细胞受体(TCR)γ表达常为阳性,但部分病例表达TCRβ{178,3889}。在极少数病例中,肿瘤细胞是TCR沉默的,或者很少同时表达TCRγ和TCRβ{644}。一项研究报告了CD8α同源二聚体(CD8α)的高发病率{3889}。细胞毒性颗粒相关蛋白TIA1通常是阳性的,但其他细胞毒性分子(包括颗粒酶B和穿孔素)的表达不太一致{4021}。约20%的病例显示CD20{3889}表达异常。大多数病例表达MATK,这是一种有助于与EATL{3890}区分的标记,如果存在于>80%的肿瘤细胞中。


通过看书,我们我可以肯定,这不是一个典型的单形性嗜上皮性肠道T细胞淋巴瘤的免疫表型,当然罕见情况下也可以是这种免疫表型。是不是该回看一下EBER?

EBER,图片进行强曝光
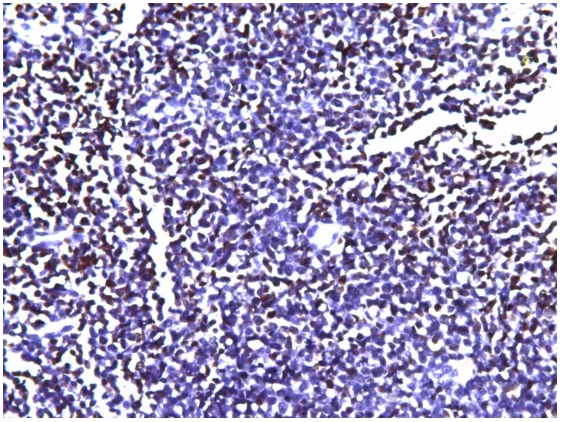
EBER,图片改变色温,减少蓝色。
EBER难道是阳性?如果EBER是阳性,那么最后的判决是不是要改写了?
看看我们重复的EBER

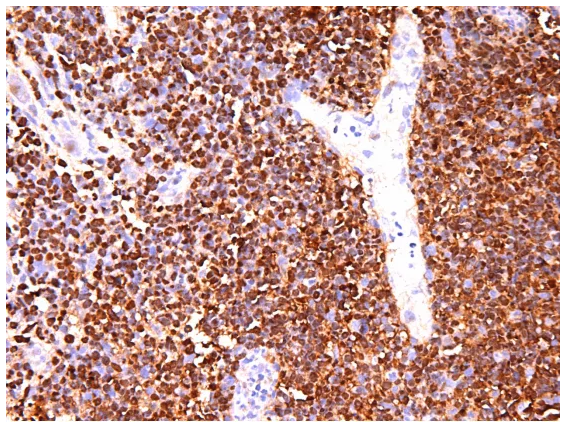
我们重复的EBER明确无误阳性,判断容易。原单位的EBER染色强度较弱,复染的颜色较重,掩盖了阳性信号,可以采用盐酸酒精分化掉过深的复染来证实这一点,但这是原单位的染色切片,我不方便做这方面的事情。既然可以重复这些结果,我也不再改变原单位的切片染色,把这个工作留给原单位。另外需要采取手段加深染色强度,比如说调整消化时间。
有人说,无坏死,不NK,这个病例没有坏死,不是典型病例。我要说,不是所有结外NK/T细胞淋巴瘤都有坏死,有时候有坏死,但是你看不到。看看我们染免疫组化的同时染的HE切片,与与原单位用的同一个蜡块。
图片的下方就是坏死
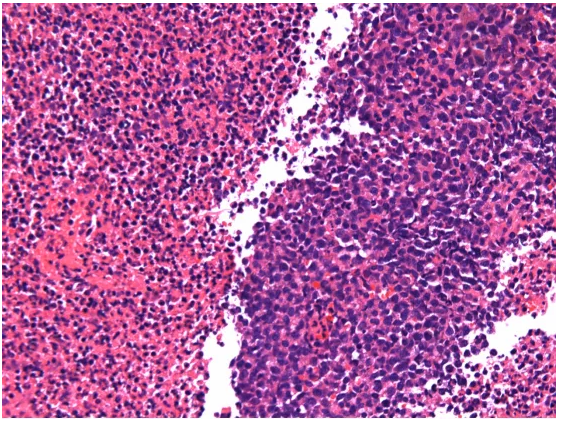
图片的左侧就是坏死,由此可以推测,原单位切片中看不到坏死实际上是因为组织包埋方向的问题,坏死面包埋的时候朝上了。
我经常参加临床的病例讨论,临床医生对于疾病的治疗相当的努力,对于治疗中出现的各种问题,引用指南或最新的临床试验,提出各种方案,严谨且细致。尴尬的是,如果治疗的依据——病理诊断出现了问题,比如本病例,临床医生的一切努力就是白费,诊断错了治疗就错了。
小结
1、 对于疾病分类所要求的证据必须充分。淋巴瘤诊断的证据需要多层次,不是单一依靠某一个指标诊断建立或排除诊断。
2、 诊断指标的判读,特别是关键性指标,需要细致准确。
3、 淋巴瘤的诊断离不开辅助技术的支持,辅助技术跟不上诊断的需求,诊断出错在所难免。
4、 做一个懂技术的病理科医生。
看最新的086文章,敬请关注公众号。
您的关注、阅读及转发是我前行的动力。




















































共0条评论