[导读] 以下文章来源于中国实用妇科与产科杂志 ,作者王玉东;本文刊登于《中国实用妇科与产科杂志》2020,36(5):432-440.DOI:10.19538/j.fk2020050113
作者:中国优生科学协会肿瘤生殖学分会,中国医师协会微无创医学专业委员会妇科肿瘤专委会
通讯作者:王玉东,上海交通大学医学院附属国际和平妇幼保健院,上海 200030,电子信箱:owangyudong@126.com;向阳,中国医学科学院北京协和医院,北京 100730,电子信箱:Xiangy@pumch.cn;张师前,山东大学齐鲁医院,山东 济南 250012,电子信箱:r370112@126.com
执笔专家(按姓氏笔画排序):王玉东(上海交通大学医学院附属国际和平妇幼保健院);生秀杰(广州医科大学附属第三医院);张师前(山东大学齐鲁医院);陆琦(复旦大学附属金山医院)
参与共识编写专家(按姓氏笔画排序):王丹波(辽宁省肿瘤医院);王玉东(上海交通大学医学院附属国际和平妇幼保健院);王刚(四川省妇幼保健院);王沂峰(南方医科大学珠江医院);王建东(首都医科大学附属北京妇产医院);王悦(河南省人民医院);生秀杰(广州医科大学附属第三医院);任琛琛(郑州大学第三附属医院);向阳(中国医学科学院北京协和医院);刘乃富(山东省肿瘤医院);孙蓬明(福建省妇幼保健院);阳志军(广西医科大学附属肿瘤医院);纪妹(郑州大学第一附属医院);李小平(北京大学人民医院);李长忠(山东省立医院);李玉宏(上海交通大学医学院附属国际和平妇幼保健院);张师前(山东大学齐鲁医院);张国楠(四川省肿瘤医院);张燕(武汉大学人民医院);陆安伟(南方医科大学深圳医院);陆琦(复旦大学附属金山医院);陈焱(上海交通大学医学院附属国际和平妇幼保健院);陈必良(空军军医大学西京医院);范江涛(广西医科大学第一附属医院);侯建青(青岛大学附属烟台毓璜顶医院);徐子峰(上海交通大学医学院附属国际和平妇幼保健院);康山(河北医科大学第四医院);程蔚蔚(上海交通大学医学院附属国际和平妇幼保健院);薛凤霞(天津医科大学总医院)
卵巢肿瘤是常见的女性生殖系统肿瘤,可发生在包括育龄期的任何年龄段女性。随着女性生育年龄延后、辅助生殖技术的广泛应用,妊娠合并卵巢肿瘤的发生率逐渐增加。关于非妊娠期卵巢肿瘤的诊治,国内外均有不少指南、规范和共识;而妊娠期卵巢肿瘤与非孕期不同,需要考虑到妊娠与肿瘤的相互影响,亟需一个规范化、人性化、个体化的专家共识。有鉴于此,中国优生科学协会肿瘤生殖学分会及中国医师协会微无创医学专业委员会妇科肿瘤专委会组织有关专家制订本共识,以期为妊娠合并卵巢肿瘤的规范化治疗提供有益的借鉴。
1 妊娠期卵巢肿瘤的发生率
妊娠期卵巢肿瘤的发生率从0.05%~2.4%不等,其中大部分为生理性卵巢囊肿和良性肿瘤,恶性肿瘤约占妊娠期卵巢肿瘤的1%~6%。妊娠期卵巢肿瘤主要发生在妊娠早期,为21.4%~75.7%,随着孕周增加,发生率逐渐下降,妊娠中期为10.9%~44.4%,妊娠晚期为4.0%~22.2%,产后为0~7.1%。约70%在妊娠早期发现的卵巢肿瘤,随着孕周增加而自行消失;持续存在的卵巢肿瘤中约有3.6%~6.8%最终病理诊断为恶性。妊娠期卵巢恶性肿瘤的发生率是1/32 000~1/15 000次妊娠。与非妊娠期卵巢恶性肿瘤相比,妊娠期卵巢恶性肿瘤的预后相对较好,5年生存率为72%~90%,与卵巢恶性肿瘤相关的病死率约为4.7%。
2 妊娠期卵巢肿瘤的临床表现
妊娠期卵巢肿瘤多无特异性临床表现,偶有妊娠早期合并巨大卵巢肿瘤可见腹部膨隆。鉴于妊娠期的特殊性,常规妇科双合诊检查常被产科医生忽略,加之增大的子宫影响检查结果,所以妊娠期卵巢肿瘤多在常规超声检查或者剖宫产手术时意外发现。妊娠期卵巢肿瘤也可表现为其他非特异性症状,包括腹部或背部疼痛,便秘,腹胀和泌尿系统等症状,这些非特异性症状在正常妊娠中普遍存在,因而常被忽略,致使少数患者发生肿瘤扭转或者破裂引发剧烈疼痛时方被重视。在妊娠期卵巢肿瘤患者中,卵巢囊肿扭转的发生率在1%~22%不等。最常见的临床症状是突发局限性腹痛,呈间歇性、非放射性,并伴有恶心和呕吐。诱发扭转的风险包括:囊肿中等大小,活动度较大,重心偏移。直径6~10 cm的囊肿易发生扭转,囊肿扭转的风险与囊肿的大小不成正比;一半以上的囊肿扭转发生在妊娠早期,随着孕周增加,卵巢囊肿扭转的风险降低。
3 妊娠期卵巢肿瘤的分类
妊娠期卵巢肿瘤的类型同非妊娠期,包括卵巢生理性囊肿和卵巢良性/恶性肿瘤。但由于在妊娠这一特殊时期,尤其是促排卵药物的使用及妊娠期体内激素水平的变化,使妊娠期卵巢生理性囊肿的发生率增加。妊娠期超声发现的直径<5 cm的单纯性卵巢囊肿,大多数是功能性肿瘤,包括卵泡囊肿、黄体囊肿、黄素囊肿及卵巢过度刺激综合征等。妊娠早期发现的所有卵巢囊肿中,高达70%左右在妊娠中期会自行消失。其中最常见者为妊娠黄体或黄体囊肿,约占妊娠期卵巢肿瘤的13%~17%。黄体出现于排卵后,持续至妊娠8~9周,妊娠黄体如在妊娠9周后未被吸收,则形成黄体囊肿。大多数黄体囊肿至妊娠16周会逐渐消失。黄素囊肿系因卵巢被高水平人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)刺激或对hCG过度敏感而形成,常发生在妊娠滋养细胞疾病、多胎妊娠、超促排卵的女性,形态学上多表现为双侧卵巢囊肿。
妊娠中、晚期持续存在的卵巢肿瘤,或超声影像学有典型特异表现时多为病理性肿瘤。依据组织病理学发生率依次为:成熟性畸胎瘤、浆液性囊腺瘤、卵巢系膜囊肿、黏液性囊腺瘤、子宫内膜异位囊肿等,凡此均有特异超声影像学特点,结合病史和肿瘤标志物当不难诊断。
妊娠合并卵巢恶性肿瘤中,50%为上皮性肿瘤,30%为生殖细胞肿瘤,其余为性索间质肿瘤及其他类型肿瘤(如肉瘤、库肯勃氏瘤等转移性肿瘤)。需注意的是,在所有卵巢恶性肿瘤中,10%为转移性肿瘤,其主要来源是胃肠道和乳腺。上皮性恶性肿瘤中超过50%为低度恶性潜能未定(交界性)卵巢肿瘤,其余为卵巢上皮性癌。生殖细胞肿瘤中,约3/4为无性细胞瘤,其他为内胚窦瘤、未成熟性畸胎瘤和混合型生殖细胞瘤等;除10%~15%的无性细胞瘤可双侧发生外,其他的生殖细胞肿瘤常为单侧。妊娠期卵巢颗粒细胞瘤占卵巢性索间质肿瘤的50%,Sertoli-Leydig细胞肿瘤占1/3,其余是未分类的间质肿瘤,这些肿瘤大多数是单侧发生。
4 妊娠期卵巢肿瘤的诊断与评估
妊娠期卵巢肿瘤诊断的重点是评估卵巢肿瘤恶性的风险、持续存在的可能性及出现并发症的概率,从而判断干预时机。由于临床表现及体征缺乏特异度,常依赖于辅助检查进行评估。
4.1 超声检查 超声检查是公认的安全检测技术,对母胎均无不良影响,可反复使用。因此,超声检查是妊娠期评估卵巢肿瘤的常用方法。非妊娠期卵巢恶性肿瘤的超声特点,包括:卵巢肿瘤为实性或囊实性,肿瘤为多房且直径>6 cm,囊壁增厚、伴内生乳头或结节,多普勒提示局部血流丰富、血流阻力降低,腹腔游离液体等,这些特点在妊娠期同样适用。但需注意妊娠期超声检查具有局限性,妊娠中、晚期卵巢肿瘤常被增大的子宫遮挡,约20%的妊娠期卵巢肿瘤在超声检查时未能发现,因而需要联合MRI检查评估。另外,超声的血流参数会因妊娠而有所改变,包括流速增加和妊娠期血管阻力降低,使得良性和恶性肿瘤之间的流量模式存在重叠。因此,超声检查对于良恶性的鉴别需慎重。
4.2 磁共振成像(magnetic resonance imaging,MRI) MRI检查可清楚显示盆腔软组织结构及淋巴结,在鉴别卵巢肿瘤良、恶性方面有明显的优势,准确率可达93%。一项随访4年的大型研究发现,在妊娠早期使用MRI检查不会增加死胎、新生儿死亡、先天性异常、肿瘤、视力或听力损伤的风险,1.5T可以满足绝大多数的诊断需要。一项回顾性研究显示妊娠期使用3T MRI检查,发现在暴露组与非暴露组间平均出生体重、听力损伤的发生率(随访到新生儿12个月)差异无统计学意义。《ACR磁共振安全操作指南文件:2013》认为,在妊娠任何时候,包括妊娠早期,行MRI检查安全。在子宫增大,超声评估有困难时,MRI更有助于判断卵巢肿瘤的性质,同时可用于术前评估肿瘤侵袭范围、分期,评估腹膜、盆腔淋巴结及肿瘤与周围组织的关系等,用以指导和决策治疗方案。
MRI造影剂可穿透胎盘,并由胎儿肾脏排泌到羊水中,容易造成影像学的误判;另外,在动物实验中证实造影剂可增加子代骨骼畸形的发生率,因此妊娠期行增强MRI时需慎重。钆是最常用的造影剂,可以通过胎盘并被分泌到羊水中,进入胎儿循环,但动物实验表明,只有非常少量的钆进入胎儿组织(主要是骨组织);在人类研究中,妊娠期暴露于钆与风湿性、炎症或浸润性皮肤病的风险增加相关,增加死胎和新生儿死亡的风险,但不增加先天性异常的风险。因此,妊娠期非必要时应避免使用钆等造影剂。
4.3 计算机断层扫描(computed tomography,CT) CT常用于卵巢恶性肿瘤的诊断及评估肿瘤侵袭范围,但因CT具有一定剂量的电离辐射,妊娠期应尽量避免使用。单次盆腔CT,胎儿接受电离辐射剂量为0.01~005Gy,甚至更低,但即使低于0.05Gy的安全阈值,仍不排除增加妊娠早期流产、先天性畸形、胎儿生长受限、围产儿死亡及儿童癌症的风险。此外,联合碘化造影剂的增强CT有可能增加短暂抑制胎儿甲状腺的风险。
4.4 肿瘤标志物 妊娠期存在胎儿抗原,如甲胎蛋白(alpha fetoprotein,AFP)、hCG和糖类抗原(carbohydrate antigen,CA)125,与胎儿的发育、分化和器官成熟功能相关,在妊娠期会出现生理性增高并随孕周波动。另外,当胎盘或胎儿异常(如子痫前期、唐氏综合征、开放性神经管缺陷)时,这些肿瘤标志物也会有所升高。故非妊娠期常用的卵巢肿瘤标志物在妊娠期的诊断价值受限,但仍有一定的规律可循,妊娠期连续检测有助于鉴别诊断。
4.4.1 CA125 妊娠早期孕妇血清中CA125会出现生理性升高,在妊娠35~60 d达到峰值,在妊娠3个月后开始逐渐下降。在妊娠中、晚期羊水中CA125含量较高,而孕妇血清中含量较低。由于孕妇血清CA125浓度明显受妊娠影响(尤其是在妊娠早期),若将CA125用于妊娠期卵巢肿瘤的监测,建议提高CA125的诊断界值(≥60 kU/L)。
4.4.2 CA199、癌胚抗原(carcino⁃ embryonic antigen,CEA) CA199在孕期会有轻度的升高,但不超过正常值。CEA不受妊娠影响。这两种标志物可用于妊娠期卵巢肿瘤的监测、随访。
4.4.3 人附睾蛋白-4(human epididymis protein 4,HE4) HE4于2009年被美国食品药品监督管理局(FDA)批准用于卵巢癌患者的病情监测,但不适宜于筛查。妊娠期与非妊娠期女性体内HE4水平差异无统计学意义,并且在妊娠早、中、晚期亦差异无统计学意义,故HE4作为肿瘤标志物不受妊娠的影响,有助于评估妊娠期卵巢肿瘤性质。
4.4.4 孕妇血清AFP AFP于妊娠早期由卵黄囊产生,妊娠中、晚期在胎儿肝脏产生。孕妇血清AFP在妊娠早、中期逐渐增加,在妊娠28~32周达到相对稳定。AFP在胎儿神经管缺陷和唐氏综合征孕妇中则明显升高。并发胎儿神经管缺陷时AFP水平升高,但通常低于500μg/L;而在某些卵巢生殖细胞肿瘤(如内胚窦瘤、胚胎性癌和混合性肿瘤)中,AFP水平明显升高,通常大于1000μg/L,尤其是单纯内胚窦(卵黄囊)瘤,AFP水平可大于10 000μg/L。
4.4.5 乳酸脱氢酶(lactic dehydrogenase,LDH) LDH在正常妊娠中不会升高,在卵巢无性细胞瘤患者中会升高。但需注意,在某些与妊娠有关的疾病中LDH也会升高,例如子痫前期和HELLP综合征(溶血,肝酶升高,血小板减少)。
由于卵巢肿瘤无特异临床表现,肿瘤标志物受妊娠干扰需要连续检测,而超声和非增强MRI在妊娠期可安全使用,且两者对于判断卵巢肿瘤性质具有较高准确率,故妊娠期卵巢肿瘤的诊断与评估主要依赖于影像学检查。见图1。
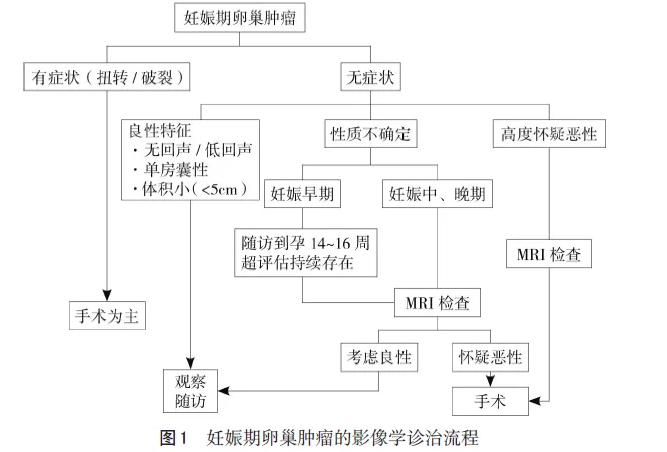
5 妊娠期卵巢良恶性肿瘤的鉴别要点
目前缺乏针对妊娠期卵巢肿瘤良、恶性的鉴别策略,故借鉴非妊娠期卵巢肿瘤良、恶性的鉴别要点。另外,要重视超声和MRI检查,并了解妊娠期肿瘤标志物的波动规律。
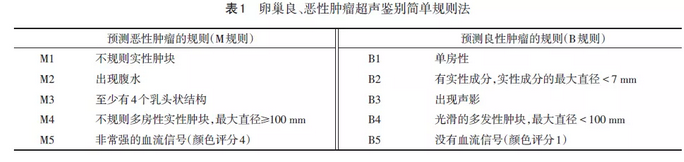
5.1 简单规则法 即依据超声特征予以判断。见表1。
5.2 多指标综合评分法 依据家族史、年龄、超声学特征综合评价,不考虑肿瘤标志物水平。见表2。

6 妊娠期卵巢肿瘤的处理
6.1 期待治疗 多数妊娠早期的卵巢肿瘤(<5 cm)会自行消失,若无症状多不需要处理。因此,对于妊娠早期的卵巢肿瘤(5~10 cm),只要其恶性风险不高且无急腹症表现,应鼓励期待治疗,密切随诊。妊娠中期(孕14~16周)再次超声和(或)MRI评估:若可疑恶性则考虑手术;若无恶性风险仍可继续随诊(需向患者交待病情)。妊娠晚期若无临床症状,并除外恶性可能,则继续观察,待剖宫产或者阴道分娩后6周再评估。
6.2 手术治疗
6.2.1 手术指征 妊娠期卵巢肿瘤出现以下情况时,需要考虑手术干预:高度怀疑为恶性肿瘤;伴发急腹症(如囊肿扭转、破裂);肿瘤直径>10 cm并持续存在;出现严重的合并症(如肾积水);估计肿瘤会引起产道梗阻等。
6.2.2 手术时机 妊娠早期由于胎盘未形成,维持妊娠所需激素主要来源于卵巢,手术明显会增加流产的风险。妊娠12周后胎盘形成,维持妊娠的激素逐渐过渡为胎盘来源,对卵巢的依赖性降低;且生理性卵巢囊肿多在妊娠中期消失,盆腹腔尚有一定手术空间。因此,妊娠中期是适宜的手术时机。如果需要切除双侧附件,手术建议在妊娠14周之后进行,此时胎盘可以提供足够的激素维持妊娠。如果在妊娠14周之前手术,需要外源性补充孕激素。妊娠24周以后,随着子宫的进一步增大,手术导致不良结局的风险增加,如果没有卵巢恶性肿瘤征象或扭转、破裂、继发感染等急腹症,可以选择密切随诊,待剖宫产(如果有产科剖宫产指征)时或者阴道分娩6周后重新评估。
6.2.3 手术方式选择 妊娠期开腹和腹腔镜(包括单孔腹腔镜、无气腹腹腔镜)手术均可实施,其母胎结局都是满意的。需根据孕周、医生经验、肿瘤性质、手术范围和手术部位来决定。对卵巢恶性肿瘤、尤其是肿块较大时,推荐开腹手术,应选择足够大纵切口,充分暴露手术视野,以减少对子宫的干扰,并有利于完整切除肿瘤。对预评估为良性的卵巢肿瘤,更推荐行腹腔镜手术。
妊娠期腹腔镜手术与开腹手术相比不增加母胎风险。腹腔镜手术对母胎有良好的安全性,其不良胎儿结局、孕妇并发症率等同或低于开腹手术。妊娠期腹腔镜手术的死胎率为0.4%,术中孕妇并发症发生率为3.86%,术后孕妇并发症发生率为4%,其中严重并发症占比低于1/3。妊娠期手术不增加胎儿畸形和死胎的风险。对于妊娠期卵巢良性肿瘤患者,腹腔镜手术具有以下优势:疼痛轻,出血少,早期恢复胃肠道功能及下床活动,静脉血栓栓塞风险降低,住院时间更短,切口感染风险低。建议由经验丰富的腹腔镜医生施行妊娠期腹腔镜手术。
6.2.4 妊娠期腹腔镜手术注意事项 腹腔镜手术的非妊娠特异性并发症包括穿刺孔出血和切口疝。由于妊娠期子宫增大和附件血管充盈怒张,导致妊娠期腹腔镜手术中出血风险增加,术中器官损伤的风险亦增加,特别是有穿刺损伤子宫的风险。临床医生需告知孕妇子宫损伤的可能后果:子宫破裂、感染、早产、胎盘撕裂。因此,术中需要特别注意如下事项。
(1)穿刺孔的选择,根据宫底高度决定首个穿刺孔(观察孔)的位置,避免因为观察孔离宫底太近而导致的子宫损伤和视野受限。建议观察孔远离宫底4~6 cm(二横指以上)为妥;对于肥胖宫底不清者,可行经腹超声引导下穿刺,或者采用开放式置入首个穿刺孔套管。辅助穿刺孔套管的位置应根据妊娠子宫大小和病变情况,可考虑设置在病变部位同侧,以避免术中操作时手术器械无法越过妊娠子宫。(2)腹腔压力及手术时间控制:长时间的CO2气腹会导致高碳酸血症,同时腹压过高,会导致子宫血供减少。建立气腹时可以20~25mmHg(1mmHg=0.133kPa)压力注入气体,手术过程中腹压宜控制在12mmHg以内。由有经验的医生进行操作,手术时间控制在90~120min以内。(3)应避免孕妇低血压以保证子宫-胎盘血流灌注,当血压维持在基线附近,呼气末CO2分压(ETCO2)控制在3.7~4.3kPa之间时,胎儿未发生不良结局。建议孕妇左侧倾斜卧位以减少巨大子宫对下腔静脉的压迫,维持血流动力学稳定;减少血容量不足所致低血压而引起的子宫-胎盘血流灌注减少和胎儿窘迫。(4)注意切口疝:>1 cm的切口形成疝的风险为1%~2%,术后仔细缝合穿刺孔切口(尤其是筋膜层),避免腹压增加导致切口疝。
6.2.5 妊娠期计划手术的干预措施 若胎儿有存活条件,且孕妇有分娩迹象,应在具备产科和新生儿抢救设施的医疗机构进行手术。如果有早产风险,根据孕周在产前使用糖皮质激素促胎肺成熟和硫酸镁保护胎儿脑神经。产前可考虑使用糖皮质激素(24~35+6周)和硫酸镁(截止至33+6周)。紧急手术不因使用糖皮质激素而延迟。不推荐在妊娠期腹腔镜或开腹手术常规使用宫缩抑制剂,宫缩抑制剂使用与否对早产率没有影响。
6.3 妊娠期卵巢囊肿扭转处理 目前,尚无妊娠期与非妊娠期卵巢囊肿并发症的比较研究。一项前瞻性研究对161例妊娠早期超声发现卵巢囊肿的孕妇进行随访,每4~6周1次超声检查,随访中3%的卵巢囊肿出现扭转。超声是首选的影像学检查方法。妊娠期出现可疑卵巢囊肿扭转时不推荐保守治疗。
妊娠期卵巢囊肿扭转建议手术探查(开腹或腹腔镜)明确诊断,术中解除扭转,无论卵巢外观和扭转持续时间,均可考虑保留卵巢;除非卵巢严重坏死、切除不可避免。一般认为卵巢功能在症状出现72h后会急剧下降,但术中卵巢外观并不是可靠的卵巢活力指标,卵巢在解除扭转后36h可恢复正常。目前,无证据支持卵巢囊肿扭转复位与发生血栓栓塞的相关性。无充分证据表明卵巢固定术可降低扭转复发的风险。
6.4 妊娠期卵巢恶性肿瘤处理 妊娠期卵巢恶性肿瘤的处理原则基本同非妊娠期,应首先考虑母亲的生命安全。但在治疗决策时,需同时综合多种因素,包括诊断时的孕周、临床分期、病理类型和孕妇对胎儿的期望值,经妇科肿瘤、产科、麻醉和新生儿医生为主的多学科诊治中心(MDT)会诊,并与患者及家属共同讨论后,给予个体化处理。流程图见图2(参照《妊娠期妇科肿瘤:基于第3次国际共识会议的指南》,妊娠22周不是绝对的期限)。
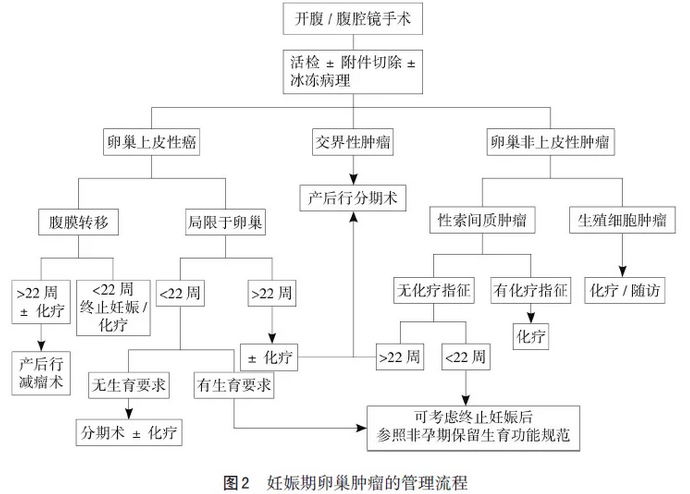
6.4.1 卵巢上皮性癌 术前影像学及术中探查提示卵巢可疑恶性肿瘤,建议先行单侧附件切除,不宜行肿瘤剥除手术,以免剥除过程中肿瘤破裂污染术野。术中立即送冰冻病理,对侧卵巢外观正常可不活检,若有可疑可行剖视活检并送冰冻病理检查。
妊娠早期诊断卵巢上皮性癌,建议终止妊娠,参照非妊娠期卵巢上皮性癌保留生育功能的规范诊治。
妊娠中、晚期合并早期卵巢癌,应该行标准分期手术,包括腹腔积液或腹腔冲洗液细胞学检查;全面探查腹膜和腹腔脏器表面,活检和(或)切除任何可疑病灶;正常腹膜随机盲检,如双侧盆腔、双侧结肠旁沟、膈下等部位;全子宫和双附件切除;大网膜切除;盆腔/腹主动脉旁淋巴结切除。黏液性癌患者若阑尾外观异常需切除,正常阑尾可保留。如果患者强烈要求继续妊娠,在权衡利弊与充分告知潜在的母胎风险后,进行个体化的处理:患侧附件切除术,或行双附件切除+保留妊娠的分期手术;术后根据病理结果进行铂类为基础的联合化疗;分娩前评估是否行“再分期手术”。
妊娠中、晚期合并晚期卵巢上皮性癌,需充分告知肿瘤风险与预后,按照非妊娠期相关指南处理,行包括子宫切除的肿瘤细胞减灭术。若需继续妊娠,可在有明确病理诊断前提下给予化疗(卡铂+紫杉醇)直至胎儿成熟,剖宫产同时行肿瘤细胞减灭术。若胎儿已接近成熟,可在促胎肺成熟前提下行剖宫产术及肿瘤细胞减灭术;若因妊娠期肠道准备不充分等原因,无法实施满意的初次肿瘤减灭术,则行新辅助化疗后的中间型减瘤术。
卵巢交界性肿瘤不同于恶性肿瘤,对化疗不敏感,治疗主要以手术切除为主,满意的分期手术至关重要。妊娠期卵巢交界性肿瘤除非有浸润性种植,否则术后无需补充化疗。如妊娠晚期诊断高度可疑的卵巢交界性肿瘤,考虑进展为侵袭性肿瘤的风险较低,手术可以适当推迟到分娩后。
6.4.2 卵巢非上皮性肿瘤 妊娠期卵巢非上皮细胞肿瘤(生殖细胞来源和性索间质来源)大部分最终诊断为FIGOⅠ期,生殖细胞恶性肿瘤对化疗极其敏感,可行保留妊娠的分期手术;术中已明确存在盆腹腔转移,应尽可能进行肿瘤细胞减灭术,手术减瘤的范围应个体化,充分权衡手术范围与预期获益,可以不进行淋巴结清扫。术后根据分期及病理类型进行化疗,必要时妊娠终止后行再次分期手术。性索间质细胞肿瘤为低度恶性,常单侧发生并多为早期,可行保留妊娠的分期手术,但不需淋巴切除。妊娠早期合并卵巢非上皮性肿瘤,若对孕期化疗有顾忌,也可酌情考虑终止妊娠,参照非孕期保留生育功能的规范诊治。
6.5 麻醉方式的选择 没有证据表明麻醉方式的选择与新生儿结局有关。妊娠期腹腔镜下妇科肿瘤手术的麻醉方式取决于孕妇情况、手术部位和方式。区域麻醉时,发生胎儿药物暴露和孕妇围术期并发症的风险最低。但是,腹腔镜手术通常需要全身麻醉。无论采取何种麻醉方式都应避免缺氧、低血压、低血容量、高碳酸血症和低碳酸血症的发生。此外,还应检查血糖水平,尤其对长时间手术或合并妊娠期糖尿病的孕妇更应如此。
全身麻醉要求制定气道管理策略,预防误吸,行气管内插管。采用快速序贯诱导并压迫环甲膜,降低误吸的风险。麻醉维持推荐使用中等浓度的挥发性麻醉药(<1.5~2.0MAC)和高浓度的氧气(FiO2=0.5),给予充分镇痛。避免对孕妇进行过度通气,维持ETCO2在正常范围,防止子宫血流降低所致的子宫胎盘低灌注。区域麻醉时通过预扩容和下肢加压,减少蛛网膜下腔阻滞或硬膜外阻滞所致的孕妇低血压。备好血管加压药,预防麻醉平面过高,避免孕妇局麻药中毒。
美国FDA已经建立了妊娠期风险分级系统,很多麻醉药被归为B类或C类。只有苯二氮卓类被归为D类(风险阳性,调查和上市后的数据表明其对胎儿有风险,然而潜在的利大于弊)。可卡因归为X类,禁用于孕妇。
致畸剂必须在发育的关键点给予足够的剂量才会产生致畸作用,在使用临床治疗剂量和维持正常生理功能的情况下,没有证据表明麻醉药物具有胎儿致畸风险。单次和短时间(≤3h)的全身麻醉药物对发育期中枢神经系统没有影响。
7 妊娠期卵巢恶性肿瘤化疗
化疗药物主要作用于快速增殖的细胞,故肿瘤细胞和发育的胚胎组织细胞均对化疗药物敏感。妊娠4周内,胚胎尚未分化,暴露于细胞毒性药物会出现“全或无”的现象:或者妊娠丢失,或者妊娠继续无影响。妊娠5~10周是器官分化关键时期,此期间暴露于细胞毒性药物,会增加胎儿畸形的风险。孕早期的化学药物暴露发生先天畸形的风险为10%~20%。妊娠14周后化疗相对安全,妊娠中、晚期化疗,虽然胎儿畸形的风险较低,但胎儿生长受限、早产和低出生体重风险增加;药物对母体的影响同样会波及胎儿,如骨髓抑制,末次化疗至分娩间隔3周对于母体和胎儿的骨髓恢复至关重要。因此,妊娠35周后或预期分娩3周内不宜化疗,若为周疗方案时,建议给药不应超过妊娠37周,从而避免新生儿及产妇出血,败血症和死亡的潜在风险。
7.1 卵巢上皮性癌 妊娠期卵巢上皮性癌化疗的适应证、方案、剂量同非孕期。化疗用于分期手术后的ⅠA或ⅠB期/G3以及ⅠC期以上患者;ⅠA(包括透明细胞癌)、ⅠB期/G2、ⅠC期/G1子宫内膜样癌患者术后可选择化疗或随访;ⅠA或ⅠB期/G1患者术后可仅随访。化疗建议使用铂类加紫杉烷类联合方案(TP方案)。卡铂优于顺铂,顺铂具有更重的肾脏和神经毒性风险;紫杉醇优于多西紫杉醇,因为紫杉醇通常对骨髓的毒性较小。化疗方案见表3。妊娠期不建议使用目前临床上任何靶向化疗药物。

7.2 生殖细胞肿瘤 大多数卵巢生殖细胞恶性肿瘤发生在年轻女性,并且多限于单侧卵巢。在行保留生育功能的分期手术后,除了ⅠA期无性细胞瘤和高分化Ⅰ期未成熟畸胎瘤的患者外,均应行辅助化疗。常用的化疗方案是博来霉素、依托泊苷和顺铂(BEP)方案;鉴于依托泊苷的毒性,目前首先考虑TP方案。
7.3 交界性肿瘤 以手术为主,对化疗不敏感,大多数患者不需要辅助化疗。化疗只适宜于交界性肿瘤伴浸润性种植者,化疗方案与疗程遵循低级别癌。
7.4 性索间质肿瘤 多局限于单侧卵巢,属低度恶性,进展缓慢,具有远期复发特点。建议对妊娠期间诊断的性索间质肿瘤仅行肿瘤切除术;如果需要化疗,可以推迟到产后。首选TP方案。
部分早期恶性肿瘤患者担忧胎儿安全而将辅助化疗推迟至分娩后,在充分评估和告知前提下可能也是合理的;晚期恶性肿瘤患者应在手术康复后立即开始化疗,妊娠期间未完成的化疗疗程,待产后补充完成。
7.5 化疗的相关建议如下 (1)妊娠期化疗药物剂量应用原则同非妊娠患者,根据妊娠期实际体重计算。(2)妊娠早期禁忌化疗,以免影响胎儿器官发育。化疗推迟至妊娠中期(妊娠14周后),也要综合考虑胎儿获益与孕妇风险。(3)末次化疗至分娩间隔3周对于母体和胎儿的骨髓恢复至关重要,妊娠35周后不建议化疗。(4)妊娠期禁忌使用抗血管内皮生长因子(VEGF)和其他抗血管生成药物。(5)在获得安全性数据之前,妊娠期应避免进行靶向药物治疗。(6)必要时可使用甲氧氯普胺、5-HT3拮抗剂、雷尼替丁、质子泵抑制剂、甲基泼尼松龙、泼尼松龙或氢化可的松。(7)化疗期间不主张母乳喂养。
8 终止妊娠
妊娠期卵巢良性肿瘤患者,若无产科指征,可行阴道分娩,待产后6周再次评估;也可在剖宫产同时行卵巢肿瘤手术。妊娠期卵巢恶性肿瘤者建议剖宫产终止妊娠,可在剖宫产同时按照卵巢恶性肿瘤手术原则处理卵巢肿瘤,需妇科肿瘤医生完成肿瘤手术。
9 妊娠结局
国际癌症、不孕不育和妊娠网络公布了其综合各国的1100多例妊娠期恶性肿瘤数据(经过20年的随访),其中88例诊断为卵巢癌的孕妇中早产率为28%,小于胎龄儿为16%,先天性畸形率为5%。在妊娠期间没有死产或孕妇死亡的报告。其他产科并发症还包括流产(4%)、妊娠期糖尿病(4%)、高血压(3%)和孕妇感染(1%)。
10 总结和建议
(1)妊娠期卵巢肿瘤多为生理性,约70%以上在妊娠中、晚期自行消失;恶性肿瘤占比为1%~6%。(2)妊娠期卵巢肿瘤绝大多数无症状,少数发生扭转或破裂。超声是最常用的诊断方法,非增强MRI检查在整个妊娠期是安全的。(3)肿瘤标志物的连续检测,有助于妊娠期卵巢良、恶性肿瘤的鉴别诊断。(4)除非可疑恶性或出现急腹症,否则不宜在妊娠早期行卵巢肿瘤手术。以下情况建议积极手术干预:①肿瘤实性或囊实性伴乳头生长,血流丰富,血流阻力低(2B级证据);②肿瘤直径>10 cm,持续存在或不断增大(2C级证据)。(5)妊娠中期是手术的最佳时机,腹腔镜(有经验的医生)与开腹手术都可以选择。(6)术前影像学检查和术中探查均考虑良性,建议行肿瘤切除而非卵巢切除(2C级证据)。如为实性或囊实性肿瘤,有乳头生长,伴有腹水或具有其他恶性特征,则行患侧附件切除,术中冰冻明确诊断。对侧卵巢除非发现病变,否则不需活检。(7)妊娠14周后化疗,致畸率无明显升高,但导致胎儿生长受限、低出生体重儿和早产发生率升高。妊娠35周以后或预期分娩3周之内不宜化疗。(8)形成本专家共识,旨在为妊娠合并卵巢肿瘤的诊治提供一个基本规范;在共识制订过程中,专家团队虽已广泛检索文献集思广益,唯恐挂一漏万,但仍难达面面俱到。故专家共识团队希冀在临床诊治过程中,还需综合兼顾肿瘤病情(分期、分级)、胎儿(孕周及生存能力)和意愿(孕妇及家属),结合MDT的意向,以期做到规范化和个体化处理。(参考文献略)


















共0条评论