[导读] 作者:纪元教授等;来源:复旦大学附属中山医院病理科
免疫疗法是当前备受全世界瞩目的疗法,正掀起肿瘤治疗的革命,引领癌症治疗的变革。目前,十余种免疫检查点抑制剂作为单一疗法或联合疗法的药物治疗方案正用于不同肿瘤的治疗或正处于临床开发的不同阶段。然而,有效靶向肿瘤细胞的免疫检查点抑制剂在刺激免疫系统的同时也可能会导致免疫介导的不良事件,如免疫介导的肝功能异常。这些事件可能是严重的,有时甚至是致命的。因此,如何对免疫检查点抑制剂治疗后肝功能异常的组织病理学进行规范化的分析至关重要。近日,复旦大学附属中山医院病理科纪元教授团队在《中华病理学杂志》上发表了《免疫检查点抑制剂治疗后肝功能异常的组织病理学分析》,为精准的免疫介导肝功能异常诊断提供可靠依据。

研究背景
免疫检查点阻断剂(immune checkpoint inhibitors, ICI)打开了肿瘤治疗的新篇章,目前如nivolumab,pembrolizumab等多种ICI已用于不同肿瘤的治疗中。ICI通过靶向阻断肿瘤免疫逃避发挥作用,但会破坏机体免疫耐受平衡,从而引起免疫相关并发症,其中免疫介导的肝炎(immune-mediated hepatitis,IMH)是重要事件之一。索拉非尼、仑伐替尼等多靶点酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)可靶向阻断VEGFR1-3、FGFR1-4、PDGFRα、RET及KIT等血管生成相关通路,目前在包括肝细胞肝癌(hepatic cell carcinoma,HCC)等肿瘤中使用。同时,ICI和抗血管生成TKI的联合使用日渐增多,而随之引起的IMH的发生率可能更高,表现也更为复杂。
组织学形态是准确诊断和及时治疗的基石。我们聚焦于此,回顾性研究免疫治疗后肝功能损害的组织病理形态,并初步比较ICI单药治疗与ICI联合靶向抗血管治疗的组织病理学差异,以期为今后不断增加的免疫治疗积累经验。
研究内容
收集 2015至2019年在复旦大学附属中山医院接受抗ICI治疗发生肝功能异常且获得肝组织标本的病例21例。其中10例使用单药ICI,另11例使用ICI及靶向抗血管TKI联合治疗,观察组织病理形态,使用免疫组织化学方法检测程序性死亡配体1(programmed cell death-ligand 1, PD-L1)表达情况。
研究结果
单药ICI治疗的IMH表现为程度不等、均匀分布于肝小叶及汇管区的炎症,并可出现小胆管炎、静脉内皮炎、Kupffer细胞活化及紫癜样变(图1)
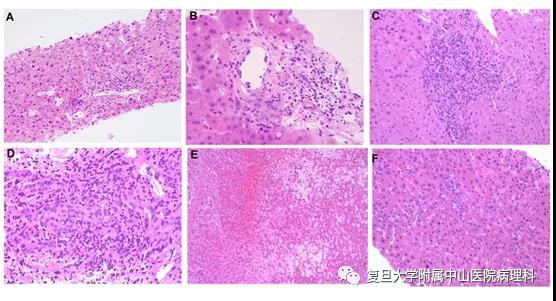
图1:常见的IMH组织学形态。A. 肝小叶内炎症:肝小叶内肝细胞呈点灶状坏死,凋亡肝细胞周围伴嗜酸性粒细胞浸润。少量肝窦扩张,汇管区轻度炎症。B. 肝小叶中央静脉内皮炎,炎细胞浸润中央静脉周围,内皮细胞核凸显。C. 汇管区较多淋巴细胞、浆细胞及中性粒细胞浸润。少量肝细胞浊肿。D. 中度小胆管炎。E.肝组织呈紫癜样改变: 周围肝组织中央静脉周围肝窦充血、紫癜样变,部分肝细胞液化、脱失。F. 肝窦间可见显著活化的Kupffer细胞。
单药ICI治疗组中,8例(8/10)出现轻度肝损伤,2例(2/10)出现轻-中度肝损伤。在使用ICI及抗血管TKI联合治疗的患者中,肝损伤往往较为严重,其中4例(4/11)出现中-重度肝损伤,肝细胞桥接坏死、大片坏死,汇管区中-重度炎症,部分小胆管上皮变性,伴显著界面性肝炎(图2)。
在较严重IMH的病例中,较多CD8+的T淋巴细胞聚集在汇管区及肝窦内,且有部分肝窦内皮细胞表达PD-L1。
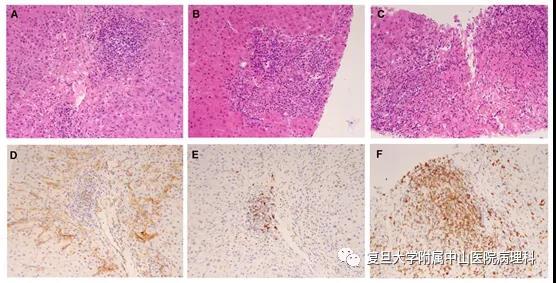
图2: A. 汇管区中度炎症,伴界面性肝炎及淋巴滤泡形成 B. 小胆管上皮变性 C. 小叶中央静脉内膜炎,周围可见淋巴细胞、浆细胞浸润及渗血,肝细胞内大片桥接坏死 D. 肝小叶内约肝细胞及Kuppfer细胞显著表达PD-L1(142) E. 汇管区少量CD20阳性的B淋巴细胞浸润 F. 汇管区多量CD8阳性的T淋巴细胞浸润
单药治疗、联合治疗中各有2例发生死亡,其中联合治疗组中有1例经Nivolumab联合仑伐替尼治疗后,接受右半肝切除术,术后病理显示肿瘤大部分坏死,瘤床内残留约5%的肿瘤组织,伴大量淋巴细胞浸润。
患者术后4 天突发肝功能损伤,MRI显示残肝左叶多发局灶性炎性坏死。患者接受糖皮质激素治疗并于术后第14天行肝穿刺,活检组织内大片凝固性坏死,坏死区内仅残存汇管区组织,汇管区内残存的小胆管内炎症细胞浸润,胆管上皮变性,部分肝细胞内胆汁淤积。坏死组织与汇管区交界处见组织细胞反应(图3)。IHC提示肝窦内皮细胞及组织细胞表达PD-L1。
我们推测血管内皮损伤致血栓形成、堵塞供血血管后,肝脏小叶坏死,从而造成该例患者免疫相关损伤。最终患者出现双下肢皮疹、甲状腺功能减低、糖尿病、间质性肺炎、肺部感染等症状,免疫系统全面失衡,多器官衰竭,于术后2月死亡。
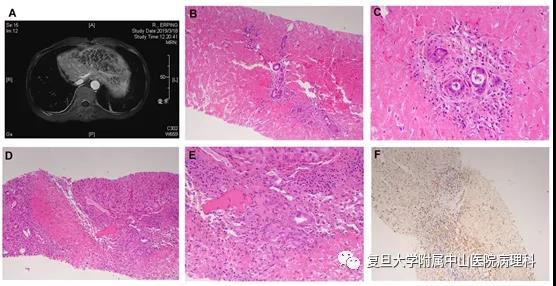
图3: 联合免疫治疗后发生免疫性肝炎病例。A. 肝右叶切除术后3天上腹部MRI增强扫描:残肝左叶多发局灶性肝炎性坏死,可见弥漫性斑片状异常信号影,呈网格状改变。B. 激素治疗后肝穿刺见大片凝固性坏死,仅残存汇管区结构。C. 残存的小胆管内炎症细胞浸润,胆管上皮变性。D残存肝组织存结节性肝硬化形态。E. 肝细胞水肿、淤胆。F. 肝窦内皮细胞及组织细胞表达PD-L1(28-8)。
鉴别诊断
IMH的临床表现并无特异性,需综合病史、血清学、病毒学、影像学检查结果,与自身免疫性肝炎(autoimmune hepatitis,AIH)、病毒性肝炎等进行鉴别。
AIH表现为显著的界面性肝炎,汇管区有较多淋巴细胞、浆细胞浸润并可延伸至肝小叶内,变性的肝细胞可形成“玫瑰花结”样的假腺腔结构,肝小叶内损伤相对较少。而IMH表现为均匀分布于肝小叶内的炎症,以淋巴细胞、巨噬细胞为主,浆细胞不如AIH多,并可见分散分布的中性粒细胞和嗜酸性粒细胞。肝小叶内可见点灶状坏死。
IMH亦需与在我国较为常见的慢性乙型病毒性肝炎(chronic hepatitis B,CHB)鉴别。CHB主要表现为汇管区慢性炎症,较重时有界面性肝炎。当HBV复制活跃时,小叶内出现肝细胞坏死,但小叶内的损伤程度与汇管区的炎症程度并不平行一致。IMH主要表现为均匀分布于全小叶的炎症,小叶与汇管区的炎症通常较为一致,小叶内肝细胞点灶状坏死,伴肝窦内中性粒细胞聚集。汇管区少量炎症细胞浸润,炎症程度不如CHB突出。此外,在本组病例中有2例出现HBV病毒性损伤,除汇管区炎症外,小叶内肝细胞点灶状坏死,伴周围淋巴细胞及中性粒细胞浸润,IHC显示部分肝细胞HBsAg胞质弥漫阳性(图4),提示为免疫性肝损伤合并活动性病毒损伤。
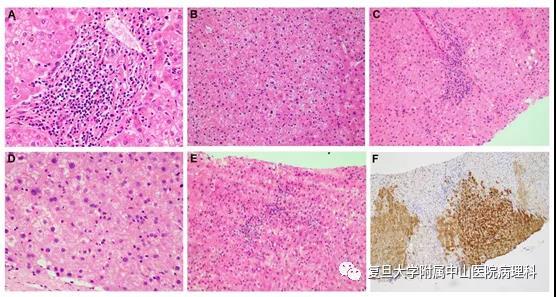
图4: 慢性乙型病毒性肝炎病例接受免疫治疗后的形态变化 A. 病例17使用ICIs 4月前手术切除肝组织的形态,汇管区可见炎症细胞浸润。B.肝小叶内未见明显损伤,部分肝细胞浊肿,肝窦内少许淋巴细胞浸润。 C.联合使用ICIs(pembrolizumab,乐伐替尼)5周期后,肝穿刺活检,汇管区仍有少量炎症细胞浸润。 D. 肝小叶内出现炎症损伤,可见肝细胞点状坏死,伴周围中性粒细胞小簇浸润。E.病例13肝小叶内可见点灶状坏死,伴淋巴细胞及中性粒细胞浸润,为免疫性肝损伤合并活动性病毒性肝损伤。F. 部分肝细胞HBsAg胞浆弥漫强阳性,提示HBV活动。
PD-1的表达上调常与病毒持续性感染、T细胞耗竭正相关,使用ICI后机体免疫激活,可抑制肿瘤进展及病毒复制,理论上可产生双管齐下的疗效。然而在本组研究中,2例出现HBV复制再次活跃。文献也报道过使用ICI后HBV再激活的病例。我们推测,HBV慢性感染后机体形成免疫耐受,使用ICI后免疫系统被激活,对HBV产生强烈应答,造成肝细胞损伤。这提示我们,在合并有肝炎的病例中需同时抗病毒治疗,监测DNA拷贝数及肝功能变化。肝活检组织也应常规检测HBsAg和HBcAg的表达情况。
研究结论
总之,IMH的诊断需结合病史、血清学及影像学检查,与病毒复制再活跃、自身免疫性肝炎、药物性肝损伤等疾病鉴别。IMH的组织学表现并无特异性,最常表现为小叶内肝炎,程度可轻重不等。ICI及抗血管生成TKI联合治疗后对肝细胞损伤造成叠加效应,引起严重IMH的可能性更高。
参考文献
章琼燕, 陈伶俐, 高峰, 等。免疫检查点抑制剂治疗后肝功能异常的组织病理学分析[J]. 中华病理学杂志, 2020, 49 (4).


















共0条评论