[导读] 作者: 阿甘
摘要
血管肉瘤(Anigosarcoma,AS)是起源于血管内皮或淋巴管内皮的恶性肿瘤,包括来源于血管内皮的血管肉瘤(hemanigosarcoma)和来源于淋巴管内皮的淋巴管肉瘤(Lynrphangiosarcoma)。鉴于目前尚无可靠的形态学指标和免疫组化特征来区分,因此目前仍将二者统称为血管肉瘤(angiosarcoma)。血管肉瘤比较罕见,约占软组织肉瘤的1%一2%。本文就有关血管肉瘤的临床表现、病理学改变、分子遗传学改变及治疗预后做一简明阐述。
临床表现
血管肉瘤可发生于全身任何部位,皮肤及头颈部血管肉瘤最常见,好发于老年男性,约2/3发生于40岁以上。目前普遍认长期的慢性淋巴水肿、电离辐射史、化学接触史、外伤史及慢性感染与血管肉瘤的发生息息相关。血管肉瘤临床表现多种多样,大体可分为结节型、弥漫型和溃疡型。表浅病变初起时象碰伤后的青肿、淤点或淤斑,界限不清,边缘稍硬,后增大较迅速,高出于皮肤表面,紫红色,偶尔有溃疡形成,有时病灶周围形成小的卫星结节。低分化者表现为多灶性及广泛局部浸润,病灶呈局灶性颜色发红,变深,局部隆起,生长迅速,易出血,有时呈霉菌样外观,可形成深底溃疡。
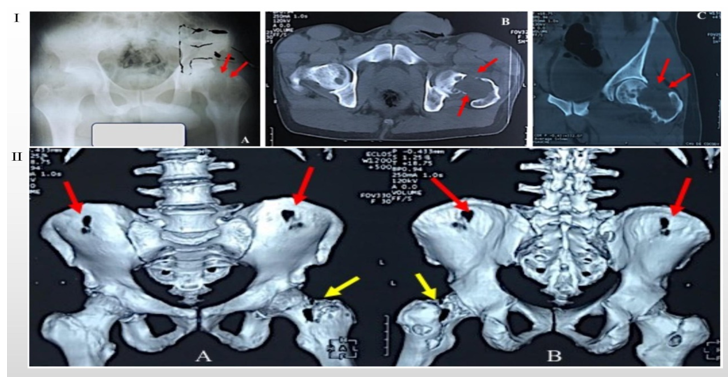
图1、盆腔AS。IA:盆腔X线平片,左侧股骨头低密度区;IB和IC,低密度区CT平扫;IIA和IIC;CT立体重建(红色和黄色箭头标记处为肿物)。
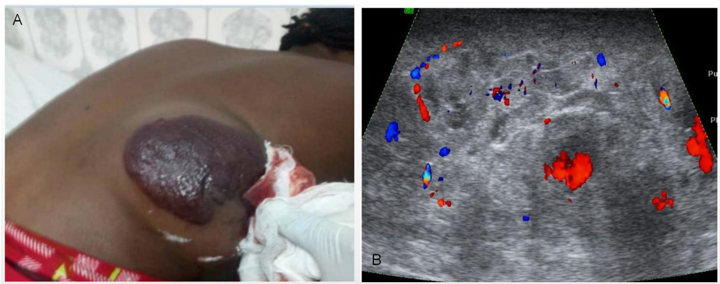
图2、肝脏原发AS侵犯胸侧壁。A;胸侧壁灰褐色质软肿物;B;彩色多普勒超声显示肿物内有血流信号。
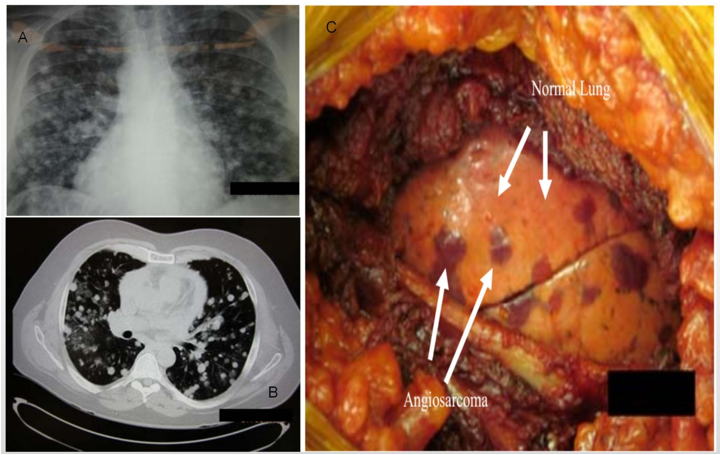
图3、肺部原发性AS。肺部多发结节X平片(A)和CT平扫(B);手术所见病灶(C)。
病理学改变
血管肉瘤在组织学上分高、中、低分化3种病理类型。高分化的血管肉瘤中肿瘤血管与正常淋巴管在组织学上很相似。有时病变存在毛细血管型脉管,腔内空虚、或充满蛋白性液体及红细胞。
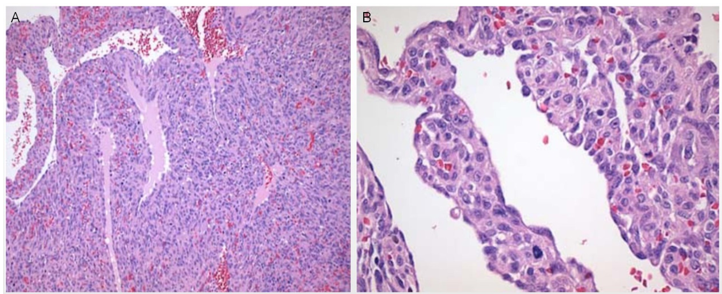
图4、右心房AS。(A)肿瘤细胞排列呈实性;(B)非典型的梭形肿瘤细胞。
光镜下肿瘤由异型性不同的内皮细胞组成。内皮细胞是呈梭形、立方形或不规则形,核有明显的异型性,染色质粗短,核分裂相多见。内皮细胞围成不规则、互相吻合的血管腔,血管腔的大小和形态不一,互相吻合,切割真皮胶原或将筋膜和皮下脂肪组织分隔。分化良好的区域,血管腔明显、或呈裂隙状,或扩张成窦状,内皮细胞扁平,增生的内皮细胞可达数层,甚至阻塞管腔或形成乳头突入腔内,但核仍有异型性,核分裂相少见。分化差的区域,内皮细胞呈实性巢状弥漫性排列,血管腔不明显,内皮细胞异型性明显,核大深染,核仁显著,分裂相多见。偶有过度角化或角化不全现象,肿瘤内常发生坏死。
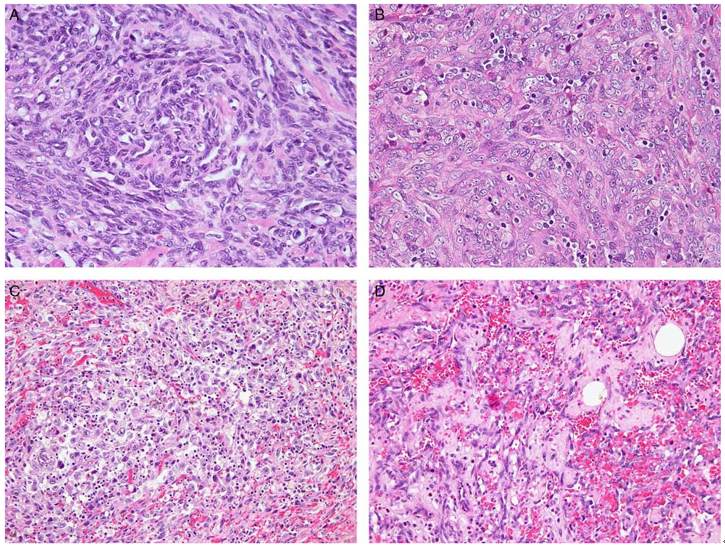
图5、低级别AS。(A)肿瘤呈实性生长;(B)多形性肿瘤细胞和不明显的血管形成;(C和D)肿瘤细胞围绕成血管。
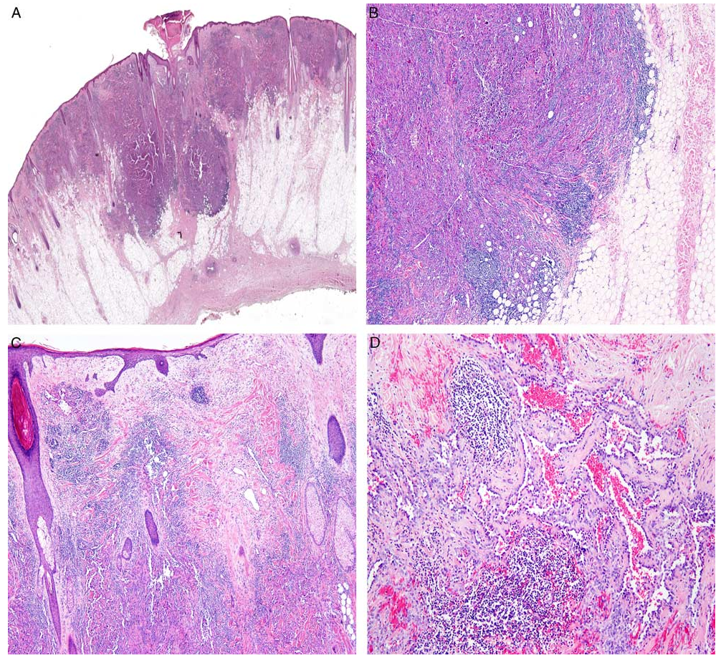
图6、皮肤AS。(A)肿瘤浸润至皮下脂肪;(B)肿瘤组织周围有淋巴细胞浸润;(C)肿瘤呈浸润性生长;(D)肿瘤细胞形成血管样结构。
免疫组织化学染色,CD31,CD34,cytokeratin,EMA,HMB-45,VEGF,D2-4-,PROX-1染色阳性。
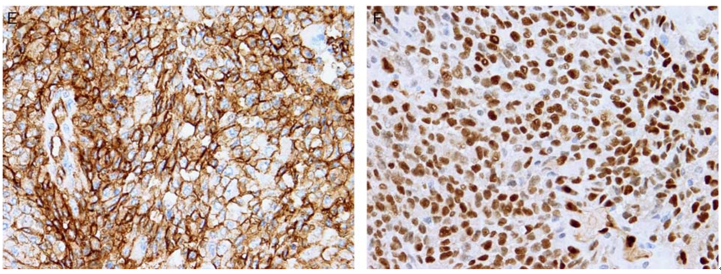
图7、AS免疫组织化学染色。(E)CD31;(F)VEGF。

图7、AS免疫组织化学染色。(A)D2-40;(F)PROX-1。
电镜下肿瘤可有典型的血管腔形成,腔内排列恶性内皮细胞,可见吞饮小泡,完整或片段状基底膜,细胞间可见紧密联接但无桥粒,偶见鞭毛状微管小体,没有明确的Wiebel-Palde小体。通常该小体仅见于血管内皮细胞而不存在于淋巴管内皮细胞,因此缺乏该小体的血管肉瘤或是细胞在恶性变的过程中失去了分化该结构的能力,或是来源于淋巴管内皮。
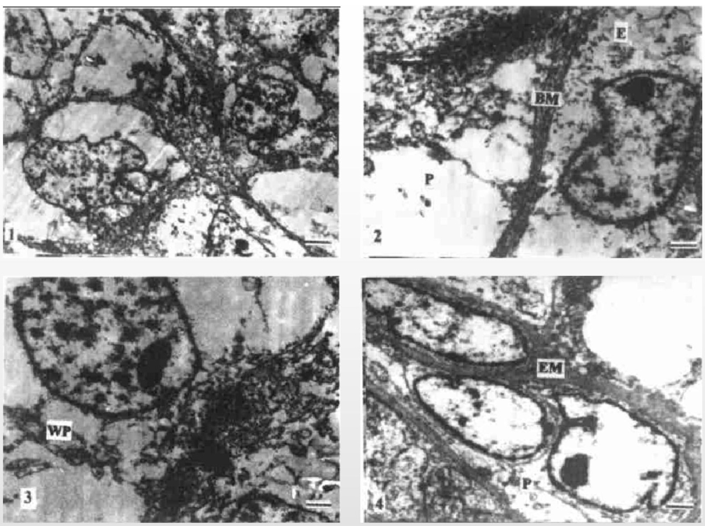
图8、AS电镜特点。(1)瘤细胞间主要为紧密连接;(2)肿瘤细胞为不完整的基板包绕;(3)W- P小体是正常内皮细胞的标志性结构;(4)周细胞周围常为多量外板包绕。
分子遗传学改变
多数患者存在CIC基因重排(84.31%)。低级别AS多数患者存在MYC基因(86.92%)和FLT-4基因(72.6%)扩增。大多数AS患者存在PTPRB基因(90.45%)和PLCG1基因(89.64%)突变。
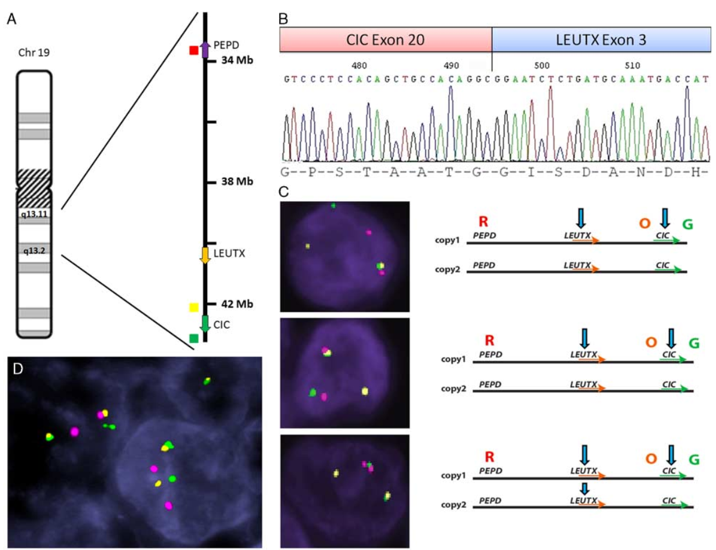
图9、AS中CIC基因重排。
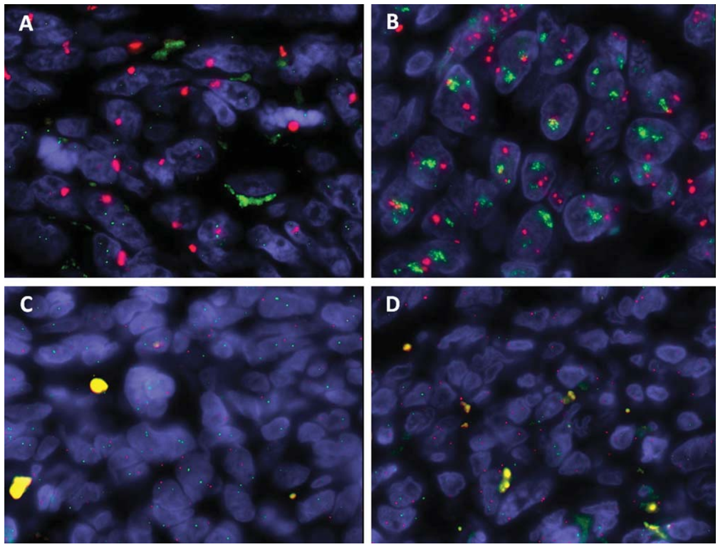
图10、AS中MYC和FLT-4基因扩增。(A和B)MYC基因;(C和D)FLT-4基因。
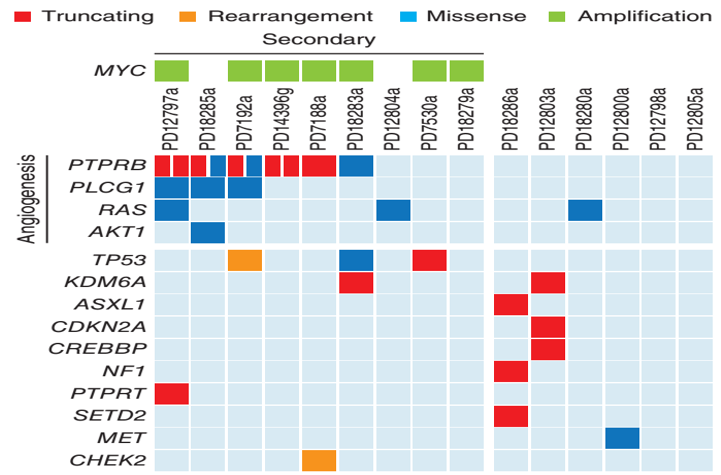
图11、AS中常见的基因突变位点。
治疗预后
外科治疗是血管肉瘤的主要治疗手段。术前或术后放疗和(或)化疗,有望降低局部复发或远处转移。外科手术方法通常要求手术切除的范围距肉眼肿瘤基部外3cm,皮下再向外潜行分离4-5cm,或术中根据冰冻切片的情况来决定切除的范围。由于血管肉瘤具多中心性及浸润性,因此局部放疗对提高局部控制有效。推荐对多中心或边界不清的血管肉瘤,在大体边界外放数厘米的范围,给60-70Gy的剂量,可获得较好的疗效。化疗为一种必要的姑息治疗手段,常用的化疗药物为ADM。应用以ADM为基础的术后化疗,尽管总生存率无明显提高,但无局部复发生存率及无瘤生存率却显著地提高。
预后因素包括肿瘤大小、年龄、治疗模式、能否取得肿瘤局部广泛切除以及有丝分裂指数等。肿块大小是重要的预后因素之一,肿块<5cm者生存明显好于>10cm者。治疗模式是另一个重要的预后因素。肿瘤局部切除、局部扩大切除或截肢后加化疗和/或放、化疗(综合治疗)患者,预后明显优于接受单一治疗方法的患者。有丝分裂指数是血管肉瘤的一个预后因素。有丝分裂指数为每10个高倍野中的分裂数,分3级〔低级:0-5个核分裂像/每高倍视野;中级:6-10个核分裂像/每高倍视野,高级:10以上核分裂像/每高倍视野),低、中级分裂指数预后明显好于高分级者。PD-1阳性的患者较阴性的患者预后较好。
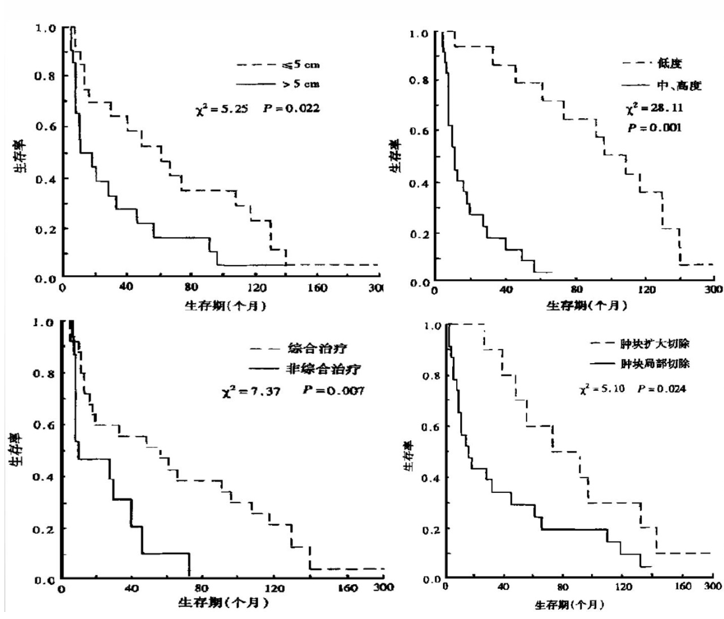
图12、AS相关预后因素。
图片来源:
图片1来源于Samba Koné, Abidou Coulibaly, Nawe Astride Ngandeu, et,al. Pelvic Multifocal Primitive Bone Epithelioid Angiosarcoma (Iliac Crest and Hip) about One Case and Literature Review. Open Journal of Pathology, 2017, 7, 58-65. Doi: 10.4236/ojpathology.2017.73006.
图片2源自于Mamadou Diallo, Mazamaesso Tchaou, Issifou Boube, et, al. Primary Hepatic Angiosarcoma Revealed by a Hemorrhagic Parietal Metastasis about a Case in Lomé. Open Journal of Radiology, 2019, 9, 176-180. Doi: 10.4236/ojrad.2019.93016.
图片3源自于Brendan F. Judy, Jarrod D. Predina, Jay Mittal, et, al. Metastatic Primary Pulmonary Angiosarcoma. Surgical Science, 2011, 2, 130-133. doi:10.4236/ss.2011.23026.
图片4源自于Anwar Ramadhan, Helena Willén, Andreas Thor. Angiosarcoma of the mandible: Metastasis from a primary tumor of the right atrium of the heart. Case Reports in Clinical Medicine. 2013; 2(1); 53-57. Doi: 10.4236/crcm.2013.21015.
图片5源自于Shih-Chiang Huang, Lei Zhang, Yun-Shao Sung, et, al. Recurrent CIC Gene Abnormalities in Angiosarcomas A Molecular Study of 120 Cases With Concurrent Investigation of PLCG1, KDR, MYC, and FLT4 Gene Alterations. Am J Surg Pathol. 2016; 40(5):645-55. doi: 10.1097/PAS.0000000000000582.
图片6源自于Anthony P, Mauricio Zapata, Paula E, et, al. Lymphatic-type “Angiosarcoma” With Prominent Lymphocytic Infiltrate. Am J Surg Pathol. 2020 ;44(2):271-279. doi: 10.1097/PAS.0000000000001398.
图片7源自于Shih-Chiang Huang, Lei Zhang, Yun-Shao Sung, et, al. Recurrent CIC Gene Abnormalities in Angiosarcomas A Molecular Study of 120 Cases With Concurrent Investigation of PLCG1, KDR, MYC, and FLT4 Gene Alterations. Am J Surg Pathol. 2016; 40(5):645-55. doi: 10.1097/PAS.0000000000000582.
图片8源自于刘斌, 邢传平, 钱震, et al. 血管肉瘤的电镜及免疫组化观察. 西北国防医学杂志, 2004, 25(1):25-27. Doi: 10.3969/j.issn.1007-8622.2004.01.009.
图片9源自于Shih-Chiang Huang, Lei Zhang, Yun-Shao Sung, et, al. Recurrent CIC Gene Abnormalities in Angiosarcomas A Molecular Study of 120 Cases With Concurrent Investigation of PLCG1, KDR, MYC, and FLT4 Gene Alterations. Am J Surg Pathol. 2016; 40(5):645-55. doi: 10.1097/PAS.0000000000000582.
图片10源自于Tianhua Guo, Lei Zhang, Ning-En Chang, et, al. Consistent MYC and FLT4 Gene Amplification in Radiation-Induced Angiosarcoma But Not in Other Radiation-Associated Atypical Vascular Lesions. Genes Chromosomes Cancer. 2011;50(1):25-33. doi: 10.1002/gcc.20827.
图片11源自于Behjati S, Tarpey PS, Sheldon H, et, al. Recurrent PTPRB and PLCG1 mutations in angiosarcoma. Nat Genet. 2014 Apr;46(4):376-379. doi: 10.1038/ng.2921.
图片12源自于高远红, 张玉晶, 钱图南. 血管肉瘤的临床分析. 中华放射肿瘤学杂志, 2000;11(4).251-255. Doi:10.3760/j.issn:1004-4221.2000.04.009.
参考文献
1、Samba Koné, Abidou Coulibaly, Nawe Astride Ngandeu, et,al. Pelvic Multifocal Primitive Bone Epithelioid Angiosarcoma (Iliac Crest and Hip) about One Case and Literature Review. Open Journal of Pathology, 2017, 7, 58-65. Doi: 10.4236/ojpathology.2017.73006.
2、Mamadou Diallo, Mazamaesso Tchaou, Issifou Boube, et, al. Primary Hepatic Angiosarcoma Revealed by a Hemorrhagic Parietal Metastasis about a Case in Lomé. Open Journal of Radiology, 2019, 9, 176-180. Doi: 10.4236/ojrad.2019.93016.
3、Brendan F. Judy, Jarrod D. Predina, Jay Mittal, et, al. Metastatic Primary Pulmonary Angiosarcoma. Surgical Science, 2011, 2, 130-133. doi:10.4236/ss.2011.23026.
4、Shih-Chiang Huang, Lei Zhang, Yun-Shao Sung, et, al. Recurrent CIC Gene Abnormalities in Angiosarcomas A Molecular Study of 120 Cases With Concurrent Investigation of
PLCG1, KDR, MYC, and FLT4 Gene Alterations. Am J Surg Pathol. 2016; 40(5):645-55. doi: 10.1097/PAS.0000000000000582.
5、Anthony P, Mauricio Zapata, Paula E, et, al. Lymphatic-type “Angiosarcoma” With Prominent Lymphocytic Infiltrate. Am J Surg Pathol. 2020 ;44(2):271-279. doi: 10.1097/PAS.0000000000001398.
6、刘斌, 邢传平, 钱震, et al. 血管肉瘤的电镜及免疫组化观察. 西北国防医学杂志, 2004, 25(1):25-27. Doi: 10.3969/j.issn.1007-8622.2004.01.009.
7、Tianhua Guo, Lei Zhang, Ning-En Chang, et, al. Consistent MYC and FLT4 Gene Amplification in Radiation-Induced Angiosarcoma But Not in Other Radiation-Associated Atypical Vascular Lesions. Genes Chromosomes Cancer. 2011;50(1):25-33. doi: 10.1002/gcc.20827.
8、Behjati S, Tarpey PS, Sheldon H, et, al. Recurrent PTPRB and PLCG1 mutations in angiosarcoma. Nat Genet. 2014 Apr;46(4):376-379. doi: 10.1038/ng.2921.


























共0条评论