[导读] 作者:慧海拾穗
临床特征:上皮样神经鞘瘤是一种少见的神经鞘瘤,最初由Orosz等于1993年首次描述。上皮样神经鞘瘤好发年龄为40岁左右,男女发病率无差异。大多数肿瘤位于上肢和下肢的真皮和皮下组织,较少累及胃肠道、背部、胸部和头颈部。
病理特征:大体上,大多数病例为单个结节或多结节,边界清楚,有包膜,平均大小为1~2厘米。镜检可见上皮样细胞索状和簇状分布,位于黏液样和/或透明质基质中,胞质嗜酸性。尽管诊断上皮样神经鞘瘤所需上皮样细胞的百分比没有明确规定,但至少50%的肿瘤细胞应具有上皮样形态。与经典型神经鞘瘤相似,上皮样细胞变异型可见血管周围透明化、血管扩张、淋巴聚集、模糊的核栅栏状和退变性非典型性。部分病例可见巨大菊形团(Giant rosettes)结构。核分裂象通常较低(1~2个/10个高倍视野[HPFs]),无非典型核分裂象或坏死。2016年Hart等对58例上皮样神经鞘瘤进行研究发现,部分病例(22%)可显示非典型性形态,包括核有异型性,核大小不一(可相差3倍以上),核分裂象≥3个/10HPF。在这些病例中,只有一例患者复发,没有转移,这表明即使具有这些特征的肿瘤也表现为良性。
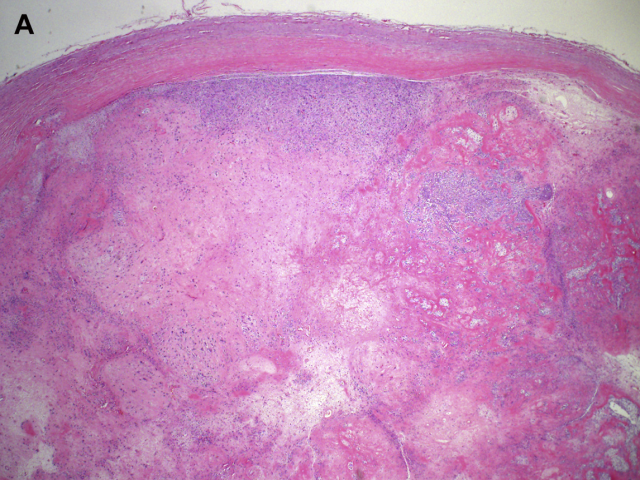
图1A:低倍镜下显示上皮样神经鞘瘤境界清楚,包膜完整。
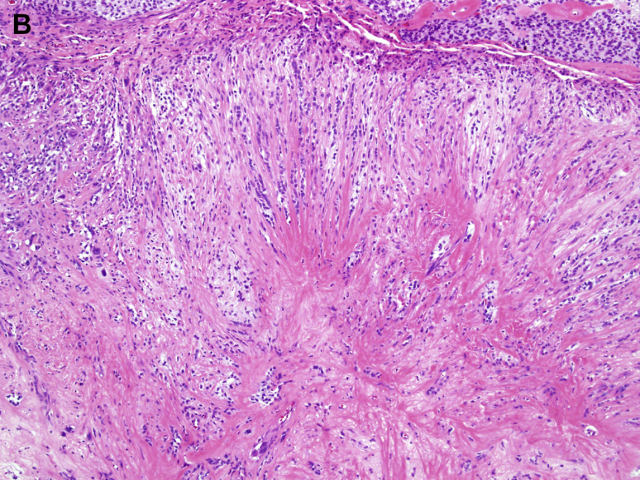
图1B:高倍镜下显示上皮样瘤细胞呈索状和簇状(cords and clusters)排列。
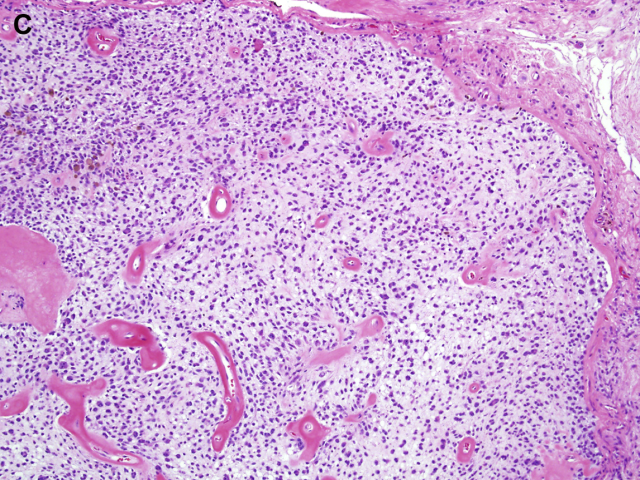
图1C:上皮样神经鞘瘤背景黏液样变性。
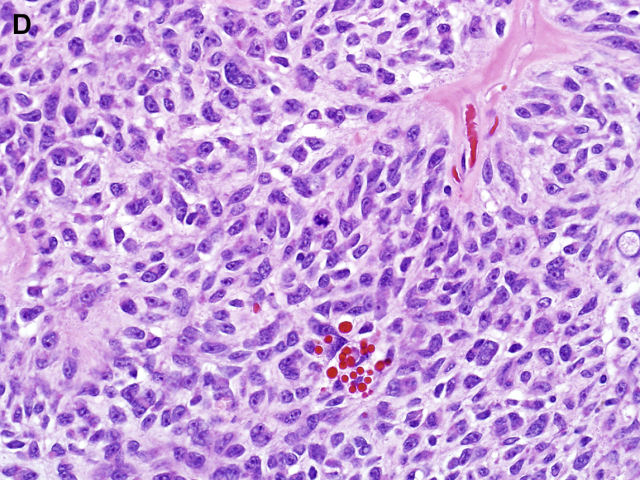
图1D:上皮样神经鞘瘤可见核非典型性和核分裂象,但这些特征与预后不良无关。
免疫表型方面,上皮样神经鞘瘤和经典型神经鞘瘤一样,弥漫强阳性表达S100和SOX10,部分病例表达胶质纤维酸性蛋白(GFAP),少数病例角蛋白局灶阳性,不表达黑色素细胞特异性标记HMB45和melan-A。分子研究证实约半数家族性神经鞘瘤病和一小部分散发性神经鞘瘤病患者存在胚系突变。随后的研究发现,大多数家族性神经鞘瘤病和高达50%散发性神经鞘瘤病中SMARCB1/INI1呈马赛克样或部分缺失。此外,高达2/3的上皮样恶性周围神经鞘肿瘤显示该标记物丢失。最近,Jo和Fletcher对57例上皮样神经鞘瘤的研究发现有24例(42%)显示SMARCB1/INI1表达完全缺失,提示SMARCB1/INI1异常可能在这些肿瘤部分病例的发病机制中起作用。
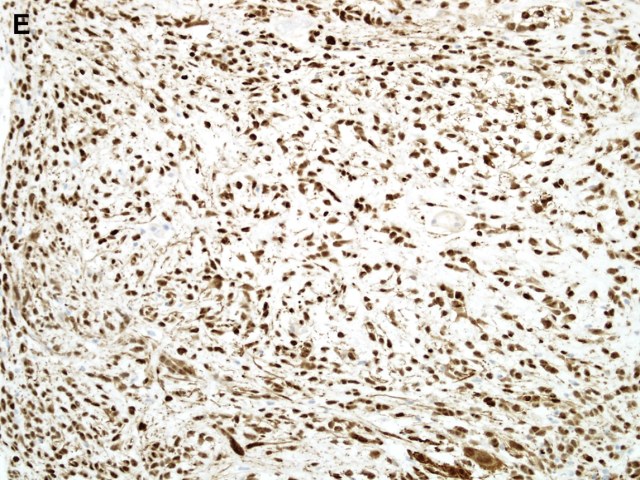
图1E:上皮样神经鞘瘤弥漫强表达S100。
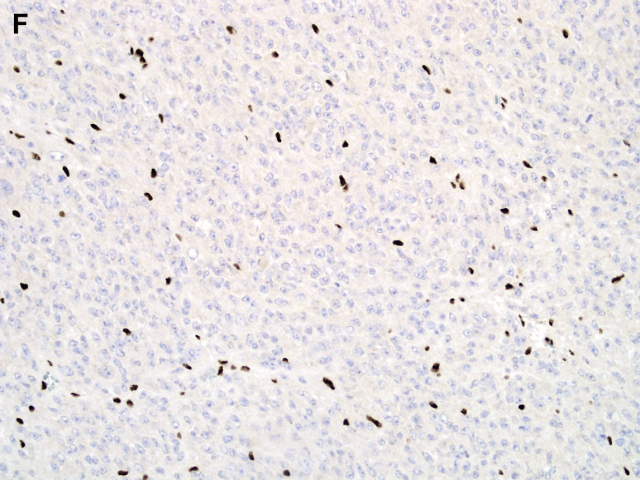
图1F:上皮样神经鞘瘤不表达INI1(间质细胞阳性表达,肿瘤细胞阴性)。
鉴别诊断:骨化性纤维黏液样瘤、骨外黏液样软骨肉瘤和肌上皮瘤是具有上皮样形态的黏液样间叶性肿瘤,在鉴别诊断中应予以考虑。外周骨壳(shell of bone)有利于骨化性纤维黏液样瘤的诊断,但约25%~30%的骨化性纤维黏液样瘤缺乏这一特征。骨外黏液样软骨肉瘤的病变细胞比较一致,胞质深嗜酸性,这些肿瘤常有出血区域。肌上皮瘤可能有骨或软骨病灶,肿瘤细胞排列方式多样。骨化性纤维黏液样瘤主要表达vimentin、S100和CD10,部分病例表达desmin和SMARCB1/INI1的镶嵌丢失(mosaic loss)。SMARCB1/INI1的完全丧失可见于恶性肌上皮瘤和骨外黏液样软骨肉瘤,但前者典型地表现为角蛋白、p63、GFAP和平滑肌肌动蛋白的共同表达。分子检测对诊断困难的病例或小活检标本有用,因为80%的骨化性纤维黏液样瘤具有PHF1基因重排,大多数骨外黏液样软骨肉瘤显示NR4A3基因重排,并且大约50%的肌上皮瘤显示融合EWSR1基因重排。最具挑战性的鉴别诊断是上皮样恶性外周神经鞘肿瘤,因为这两种肿瘤均弥漫表达S100/SOX10,并可能显示SMARCB1/INI1表达缺失。上皮样恶性外周神经鞘肿瘤具有明显的核异型性,与上皮样神经鞘瘤相比,其包膜较少。此外,非典型核分裂像和/或坏死提示上皮样恶性周围神经鞘瘤的诊断。
参考文献:
[1] Update on Peripheral Nerve Sheath Tumors. Surg Pathol Clin,2019,12(1):1-19.



















共0条评论