[导读] 作者:慧海拾穗
【前言】
等于2019年在《Experimental and Molecular Pathology》杂志上发表了题为《EWSR1-SMAD3 positive fibroblastic tumor》文章,本文将其主要内容进行翻译并复习相关文献。
【病例介绍】
患者,男性,24岁,右脚疼痛持续三个月。两年前,他在当地一家医院做了手术,切除了一个原诊断为“弥漫型腱鞘巨细胞瘤”的肿瘤。体格检查发现右脚背部皮下结节,境界不清,被认为是肿瘤复发。超声显示皮下有两个相邻的低回声结节。磁共振成像(MRI)显示结节位于第三跖趾关节区,T1WI呈低信号,T2WI呈高信号(图1)。实验室检查均在正常范围内。复发病灶在当地医院再次切除。本次病理诊断为“中、低度恶性梭形细胞瘤,不排除低度恶性周围神经鞘瘤(MPNST)”。为进一步治疗,来我院会诊。
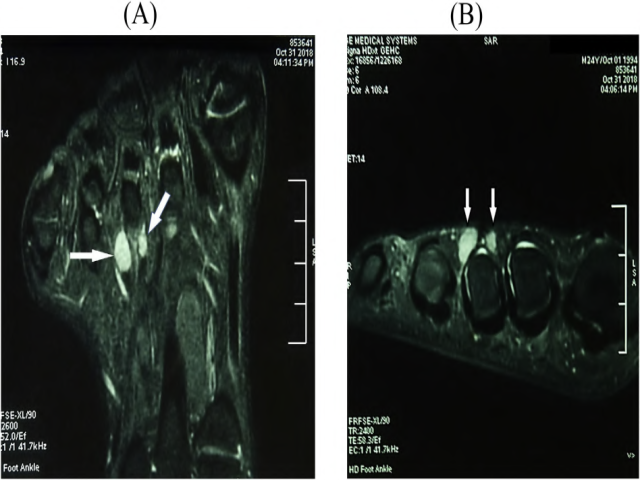
图1 影像学特征:右脚矢状面(A)和冠状面(B)MRI显示2个高信号小结节,位于第三跖趾关节区。
病理检查:大体上,原发性肿瘤和复发性肿瘤标本大小分别为1.3×0.6×0.3cm和3.5×2×1cm,由纤维脂肪组织组成,切面实性区均质,灰白。显微镜下,两个肿瘤均位于皮下组织,呈结节状或丛状生长模式(图2A,B),界限不清,浸润脂肪组织(图2C)。原发性肿瘤是由单一形态的淡染梭形细胞呈束状排列,瘤细胞核细长,染色质细腻分散,核仁小而不明显,缺乏核分裂象(图2D)。部分区域,基质明显玻璃样变性(图2E),局部可见点状钙化(图2F)。复发的肿瘤表现出相似的特征。有一个模糊的分带结构,中央细胞稀少玻璃样变性,边缘细胞密度高(图2G)。基质黏液样变与玻璃样变交替出现(图2H)。
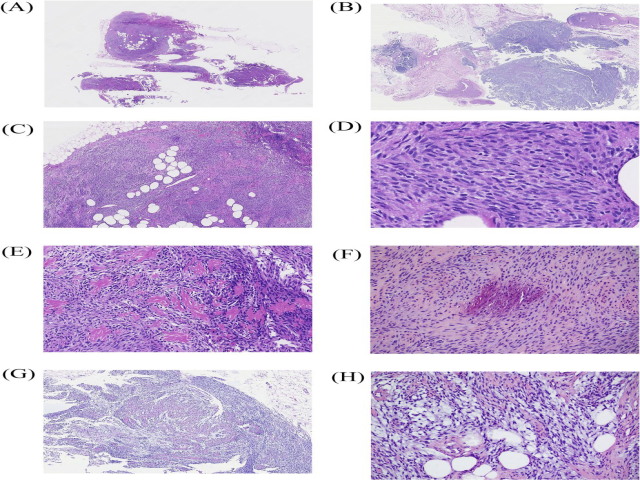
图2 组织学特征:原发性肿瘤位于皮下,呈结节状生长(A);复发性肿瘤中的肿瘤性结节(B);肿瘤细胞浸润到脂肪组织中(C);淡染梭形细胞呈束状排列(D);基质明显玻璃样变性(E);局灶点状钙化(F);中央细胞稀少玻璃样变性,边缘细胞密度高(G);基质黏液样变与玻璃样变交替出现(H)。
免疫组化显示,原发性和复发性肿瘤的梭形细胞ERG呈弥漫性强核染色(图3A)。SATB2在复发肿瘤中呈局灶性弱表达(图3B)。两种肿瘤Ki-67指数均较低(<2%)。研究中使用的其他抗体(AE1/AE3、EMA、bcl-2、CD99、vimentin 、CD34 、α-SMA、desmin、β-catenin、S100 、SOX10 、H3K27Me3 、MUC4和CD31)均为阴性。FISH检测显示EWSR1不平衡易位,在原发性和复发性肿瘤中端粒部分丢失(图4A)。通过NGS分析,EWSR1外显子7-SMAD3外显子6融合导致t(15;22)(q22;q12)(图4B)。此外,还检测到1型胶原α1(COL1A1)、钙网蛋白(CALR)、细胞周期蛋白依赖激酶4(CDK4)、四磷酸腺苷31(TSPAN31,又称SAS)和信号转导和转录激活因子6(STAT6)的扩增。肿瘤突变负荷相对较低(1.8muts/Mb)。
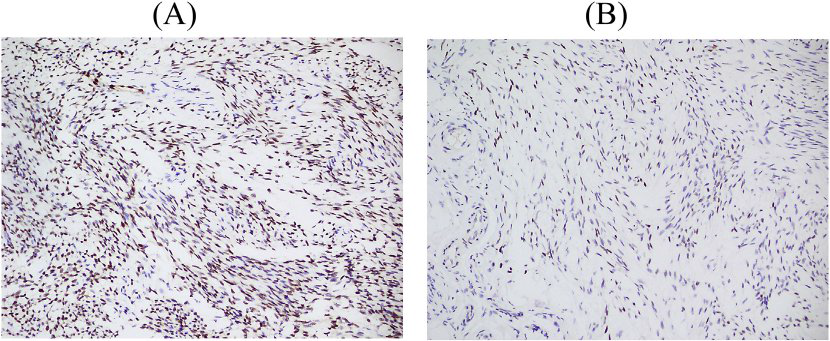
图3:免疫组化显示梭形细胞ERG呈弥漫性强核染色(A),SATB2局灶性弱表达(B)。
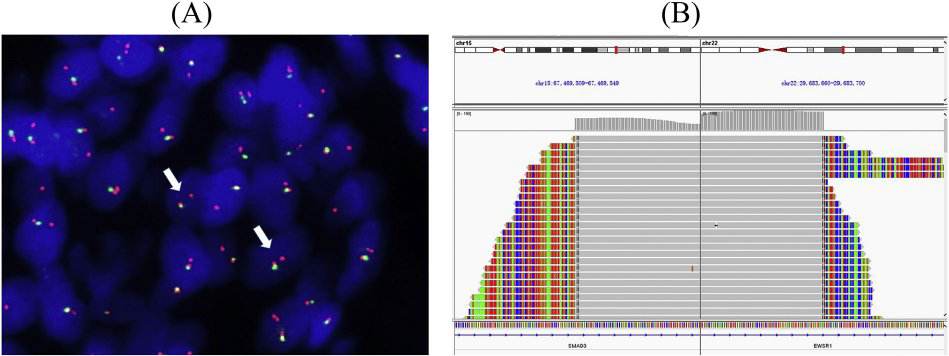
图4:FISH检测显示EWSR1不平衡易位,端粒部分丢失(A),NGS分析显示EWSR1-SMAD3基因融合(B)。
【讨论】
软组织肿瘤是由一组异质性实体类型构成的。从遗传学上讲,其中很多疾病特征性的基因重排易位,可作为分子诊断标记。众所周知的基因融合包括滑膜肉瘤中t(X;18)易位引起的SS18-SSX1/2融合和尤文肉瘤中t(11;22)或t(21;22)引起的EWSR1-FLI1或ERG融合。为了检测肿瘤特异性融合基因,间期FISH或逆转录聚合酶链反应(RT-PCR)方法被广泛应用。然而,这些分子技术不适用于遗传异常未知的肿瘤。近年来,NGS的出现为寻找新的基因融合提供了新的办法。随着NGS在临床上的应用,越来越多的肿瘤被认为是新的实体(novel entities)。在本研究中,我们描述了一例EWSR1-SMAD3基因融合纤维母细胞肿瘤,其是一种好发于肢端软组织的暂定新实体。这个新的EWSR1-SMAD3融合基因最初是在1例1岁婴儿足部肿瘤中被检测到,表现为皮肤和皮下界限不清的结节。另外两个病例显示相似的组织学特征和具有相同的基因融合,作者描述了一小系列EWSR1-SMAD3基因融合的肢端梭形细胞肿瘤。另一个病理医生不久又报告了4例。包括本例在内,迄今已有8例EWSR1-SMAD3阳性纤维母细胞肿瘤报道。总之,患者的就诊年龄从1岁到68岁不等(平均36岁;中位数36.6岁)。女性占优势,比例为3:1。除1例发生小腿外,其余7例均位于肢端,包括足部(n=3)、足跟(n=1)、脚趾(n=1)、手部(n=1)和拇指(n=1)。值得注意的是,1例分别位于指间关节和跖趾关节(本例)。临床上,所有肿瘤均表现为真皮或皮下结节或肿块,大小从1~2厘米不等(平均1.3厘米;中位数1.2厘米)。由于局部浸润性生长,6例患者中有4例(67%)出现局部复发,主要原因是切除不全。复发间隔时间为5个月~10年,表明此病需要长期随访。
组织学上,EWSR1-SMAD3基因融合纤维母细胞肿瘤是由缺乏核异型性、多形性、明显核仁和核分裂象的形态一致的纤维母细胞样梭形细胞组成。在成人病例中,出现了一种明显的带状结构,外周梭形细胞束和中央细胞稀少玻璃样变性。斑点状营养不良钙化1例。此外,我们的病例还显示了交替的基质黏液样变,这可能与低度恶性MPNST略微有点相似(vague resemblance)。免疫组化上,除了1例报告CK和EMA模糊弱染色外,肿瘤细胞不表达α-SMA、CD34、S100蛋白和SOX10。有趣的是,8例均呈弥漫性ERG核阳性表达。然而,我们的病例显示CD31阴性表达,否定了肿瘤细胞向内皮细胞分化。肿瘤中普遍存在的ERG染色被认为是由于ERG的过度表达(通过RNA测序显示),以及FN1 mRNA表达的显著上调,类似于其他纤维母细胞性肿瘤。
SMAD3是SMAD家族的一员,含有N端Mad同源性1(MH1)、C端MH2结构域和连接MH结构域的连接区,在转化生长因子β(TGF-β)/SMAD信号通路中起信号转导或转录调节作用。以往的研究表明,SMAD3是调节细胞增殖、分化和凋亡、细胞外基质(ECM)、上皮间质转化(EMT)和TGF-β介导的纤维化的重要细胞内介质。除EWSR1-SMAD3融合外,本病例还发现有COL1A1基因和STAT6基因扩增。前者是SMAD3靶点之一,编码I型胶原的前α1链,富含于骨、真皮和肌腱,后者可被白细胞介素-4(IL-4)激活,并结合和激活肺纤维化中的胶原启动子。这些分子遗传事件与纤维化和胶原的产生密切相关,支持通过整个转录组测序分析推测的成纤维细胞分化。此外,我们的病例中检测到CDK4、TSPAN31和CALR基因拷贝数增加。越来越多的证据表明,CDK4/CDK2可以磷酸化SMAD3,从而抑制其转录活性并导致肿瘤的发生。在一些骨髓增生性肿瘤(myeloproliferative neoplasms)患者中,编码内质网Ca 2+结合蛋白的CALR发生了突变,但其在肿瘤发生中的作用尚不清楚。
在肿瘤部位及组织形态学方面,EWSR1-SMAD3基因融合纤维母细胞肿瘤的鉴别诊断包括梭形细胞滑膜肉瘤、钙化性腱膜纤维瘤、NTRK基因重排梭形细胞间叶性肿瘤、低度恶性MPNST及磷酸盐尿性间叶肿瘤。梭形细胞滑膜肉瘤通常发生在四肢深部软组织,常发生于关节旁。它是一种梭形细胞肉瘤,表现为不同的上皮分化,并含有特异性SS18-SSX融合基因。钙化性腱膜纤维瘤也出现在四肢远端,其特征是纤维瘤病样浸润的梭形细胞成分和散在结节状钙化成分,常有软骨样外观。FN1-EGF融合基因的检测可能有助于鉴别诊断。NTRK基因重排梭形细胞间叶性肿瘤是一种新的实体肿瘤,其形态和组织学分级范围广泛,包括最近所报道的脂肪纤维瘤病样神经肿瘤。免疫组化结果显示,多数病例pan-TRK呈弥漫性染色,在低级别肿瘤中常共表达S100和CD34。所有病灶均以NTRK基因重排为特征。胶原或黏液样基质的少细胞区可能使EWSR1-SMAD3基因融合纤维母细胞肿瘤与MPNST相似,但肿瘤细胞不表达S-100蛋白和SOX10,且保留H3K27me3表达有助于排除MPNST的诊断。磷酸盐尿性间叶肿瘤(PMT)是一种罕见但独特的肿瘤,可引起肿瘤性骨软化(tumor-induced osteomalacia)。组织学上,它是由以产生“污浊”样基质或“粗糙”钙化为特征的平淡梭形细胞组成(it is composed of bland spindle cells characterized by producing “smudgy”-appearing matrix or “grungy” calcification)。值得注意的是,ERG和SATB2在PMT中也有表达,显示与EWSR1-SMAD3基因融合纤维母细胞肿瘤重叠的免疫表型。然而,PMT具有FN1-FGFR1或FN1-FGF1基因融合的分子特征,这可能有助于区分PMT与EWSR1-SMAD3基因融合纤维母细胞肿瘤。
综上所述,我们的研究进一步支持EWSR1-SMAD3基因融合纤维母细胞肿瘤是一个独特的临床病理实体。在缺乏形态学和免疫组化特异性分化的挑战性病例中,NGS分析可能有助于识别新的未知遗传学异常,这可能是病变的特征性标记(characteristic hallmarks)。

















共0条评论