[导读] 作者:李佳伟,时兆婷,侯英敏,张 凯,钱 雨,曾 炜,范亦武,常 才. 浸润性三阴性乳腺癌超声特征的临床、病理学及免疫组织化学基础[J]. 中国癌症杂志, 2019, 29 (1): 37-44.
三阴性乳腺癌(triple-negative breast cancer,TNBC)是一种特殊类型的乳腺癌,占乳腺癌总数的10%~20%[1-2]。TNBC是指免疫组织化学染色雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)均阴性的乳腺癌[3],是所有乳腺癌中恶性程度最高、预后最差的一种分子分型。其病理学类型以浸润性导管癌常见,细胞分化低,增殖程度高,肿瘤负荷大[1,4-5]。由于没有相应的激素受体或HER2表达,内分泌治疗及抗HER2靶向治疗均不能成为TNBC的有效治疗方法。临床上具有复发风险高、转移早和预后差等特点[1-2,4,6-8]。
TNBC的恶性程度高,缺乏靶向药物治疗,因此早期诊断是改善预后的重要手段。超声检查无辐射,对软组织具有良好的分辨力,不存在检查盲区,是乳腺癌筛查及良恶性鉴别诊断的重要检查方法之一。与非TNBC相比,TNBC在超声声像图上具有某些共同特征,多为较规则肿块,内部以不均质低回声为主,弹性值多≥4分,少见边缘毛刺征及高回声晕,少见纵横比>1及后方回声衰减[9-14]。但是据我们对TNBC超声图像的随访观察,发现其超声特征表现出明显的变异性。某些TNBC在年轻女性中容易被误诊为良性结节而延误治疗[13]。早期、准确地识别TNBC,将有助于早期治疗和改善预后。因此,了解TNBC的超声表现及与其相关的肿瘤生物学特性对于超声科医师减少误诊及漏诊至关重要。本文将重点研究临床、病理学及免疫组织化学因素对TNBC超声特征的影响。
1.资料和方法
1.1 研究对象
本研究获得复旦大学附属肿瘤医院伦理委员会的批准及对患者知情同意书的豁免。收集2014年6月—2016年12月于复旦大学附属肿瘤医院接受乳腺癌手术的723例患者的临床资料并进行回顾性分析。收集内容包括术前超声图像及描述、手术方式和术后病理学诊断资料。入选标准:女性,初发及单侧单发乳腺癌结节,术前未接受新辅助化疗,术后石蜡病理学证实为浸润性乳腺癌,免疫组织化学证实为TNBC。排除标准:有乳腺癌病史,双侧乳腺癌,多灶乳腺癌,复发病例,术前接受过新辅助化疗,肿块较大侵犯大部分乳腺腺体,超声图像质量差,免疫组织化学检测HER2扩增状态不能确定的病例。所有的临床资料均由同一名研究者进行分析校对。最终119例浸润性TNBC患者纳入研究。
1.2 仪器与方法
选用法国Supersonic Imagine公司Aixplorer、美国GE公司Logiq E9、荷兰Philips公司iU22和日本Toshiba公司Aplio 500超声诊断仪,线阵探头,频率6~14 MHz。超声检查按乳腺检查规范进行。根据每例患者的条件调节仪器的频率、增益及时间增益补偿(time gain compensation,TGC)曲线以达到最佳灰阶超声成像质量,深度范围及焦点位置根据结节的深度调节。2名具有5年以上临床经验的超声科医师对以DICOM形式存储的超声图像进行回顾性特征评估,这2名医师对患者的其他临床资料均不知情。对肿块的超声特征按照2013年乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS)超声影像词典[方位(平行位和非平行位)、形态(规则和不规则)、边缘(光整和不光整)、边缘毛刺成角(有和无)、内部回声(低回声、实质混合回声和囊实性混合回声)、后方回声改变(衰减、增强和无变化)及钙化(有和无)]并加以整合进行评估[15]。对肿块超声特征评估不一致的病例,由2名医师共同讨论达成一致后记录数据资料。最终的BI-RADS分级为3~6级,其中4级又分为4A、4B和4C。
1.3 病理组织学特征检测
所有的TNBC标本记录大小后经石蜡包埋,进行4 μm切片,对其进行常规H-E染色及免疫组织化学检查。H-E染色标本记录内容包括病理学类型、组织学分级、脉管内癌栓及乳头内癌栓。组织学分级分为3类:Ⅰ级(高分化)、Ⅱ级(中分化)和Ⅲ级(低分化),其中I级和Ⅱ级为低级别,Ⅲ级为高级别。ER、PR、HER2及Ki-67表达的检测实验步骤严格按说明书进行。ER、PR及Ki-67的表达情况依细胞核着色情况进行判定,细胞核中出现棕黄色颗粒者为着色阳性细胞,视野中肿瘤细胞核着色细胞数<1%为阴性,≥1%为阳性。HER2结果为0或1+者为HER2阴性,3+者为HER2阳性。2+为HER2表达不确定,需进一步用荧光原位杂交(fluorescence in situ hybridization,FISH)进行HER2基因扩增检测。所有病理学特征及免疫组织化学结果均从患者术后病理学报告中获取并记录。TNBC为ER、PR和HER2均为阴性的病例[3]。
1.4 患者临床资料、病理学及免疫组织化学信息分组标准
按照年龄将所有患者分为3组:<45岁组、45~60岁组和>60岁组;按照肿瘤大小将所有患者分为3组:<2 cm组、2~5 cm组和>5 cm组;按照肿瘤的病理组织学分级分为两组:低级别组(Ⅰ级和Ⅱ级)和高级别组(Ⅲ级);按照免疫组织化学中Ki-67表达水平分为两组:低表达组(<40%)和高表达组(≥40%);按照HER2评分分为两组:低分组(0及1分)和高分组(2分)。
1.5 统计学处理
采用SPSS 18.0软件进行统计学分析,对连续性变量,首先运用Kolmogorov-Smirnov检验数据的正态性,然后根据数据的分布特点以x±s(范围)或中位数(四分位数)表示。分类变量用频数(百分比,95%CI)表达。用于分类数据的比较采用χ2检验。P<0.05为差异有统计学意义。
2.结果
2.1 患者基本信息
119例TNBC患者的年龄为24~77岁,平均(52.4±11.9)岁。肿瘤大小为1.0~6.0 cm,平均(2.3±0.9)cm。Ki-67表达水平为59.1%±23.2%。119例患者的基本信息、手术方式及术后病理学信息的总结见表1。其中5例患者的病理切片组织学分级不能确定,所以病理组织学低级别和高级别的病例总数为114例。
2.2 TNBC的超声特征
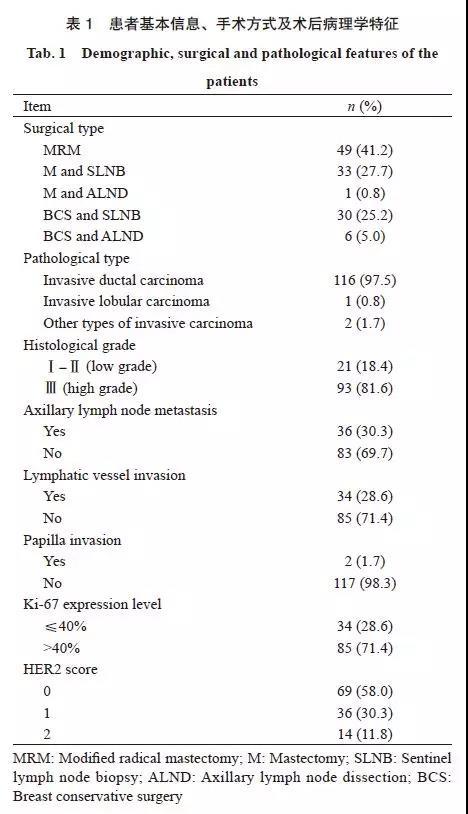
TNBC的超声特征分类及其比例见表2。大部分TNBC的超声声像图表现为非平行位(52.1%)、形态不规则(71.4%)、边缘不光整(88.2%)、无毛刺成角(79.0%)、后方回声无改变(61.3%)或增强(31.9%)及不伴钙化(79.8%)的低回声肿块。TNBC的BI-RADS分级主要为4B(18.5%)、4C(48.7%)及5级(26.1%)。TNBC的超声特征表现出明显的变异性,部分TNBC边缘具有毛刺成角的典型恶性特征(图1),与形态规则、边缘光整的TNBC完全相反(图2)。部分TNBC的超声图像与纤维腺瘤难以鉴别(图3、4)。
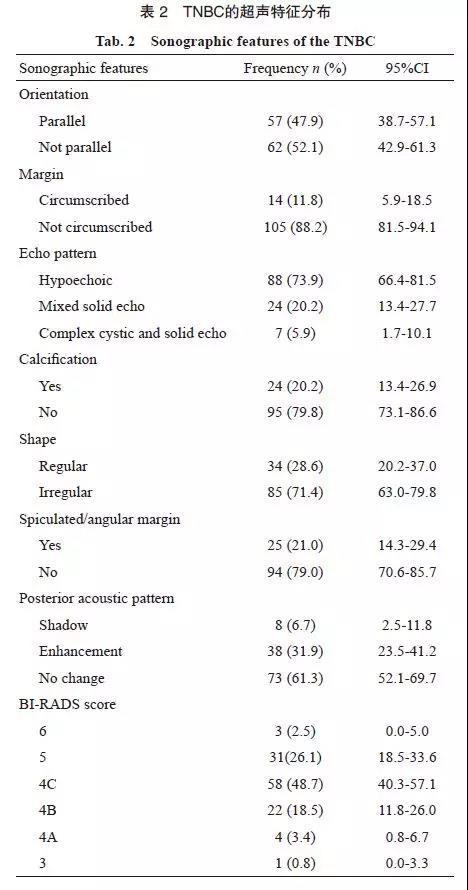
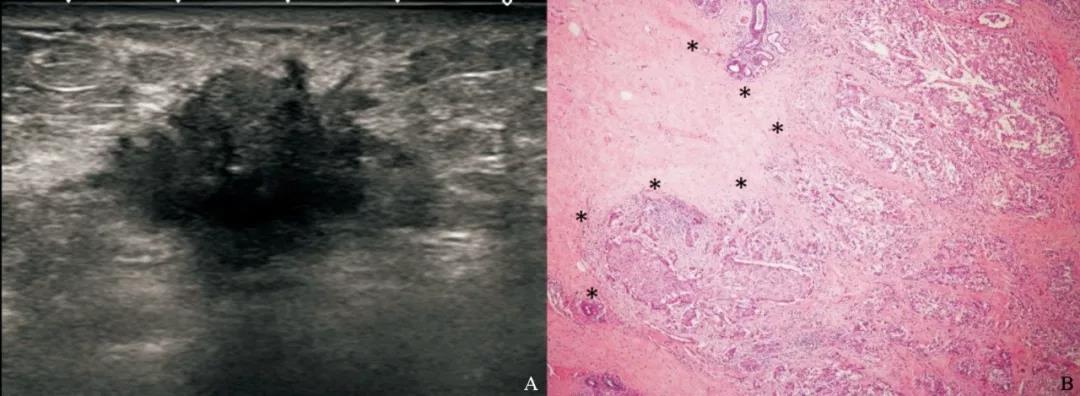
图 1 边缘具有毛刺成角的TNBC超声声像图及病理图示例
Fig. 1 TNBC with spiculated and angular margin in a 67-year-old female patient
Tumor size 3.0 cm×1.2 cm×3.0 cm, BI-RADS 5, grade Ⅲ, Ki-67 was 25%. A: A mass with irregular shape, spiculated and angular margin and posterior acoustic shadow in the sonogram; B: The uncircumscribed margin in the pathological photomicrograph (H-E staining, ×40); *: Cellular prominence in the margin
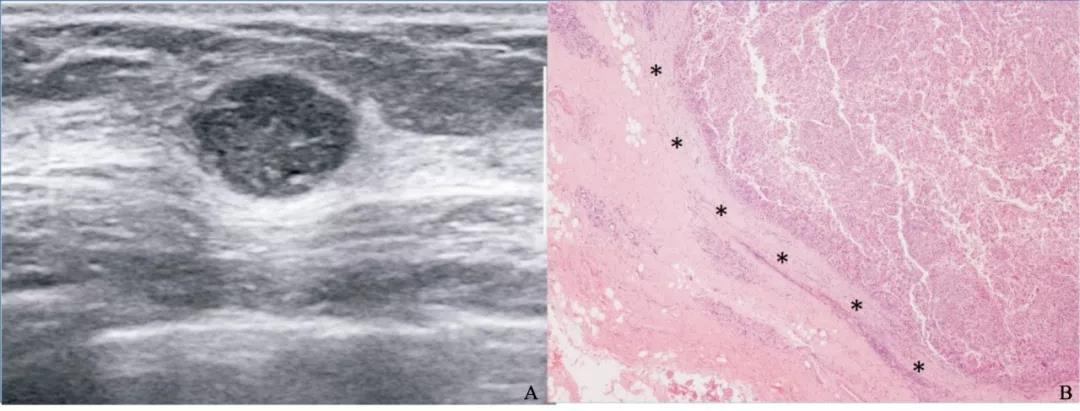
图 2 边缘光整的TNBC超声声像图及病理图示例
Fig. 2 TNBC with circumscribed margin in a 35-year-old female patient
Tumor size 1.4 cm×1.0 cm×1.3 cm, BI-RADS 4A, grade Ⅲ, Ki-67 was 30%. A: A mass with oval shape, circumscribed margin and posterior acoustic enhancement in the sonogram; B: The circumscribed margin in the pathological photomicrograph (H-E staining, ×40); *: The smooth margin
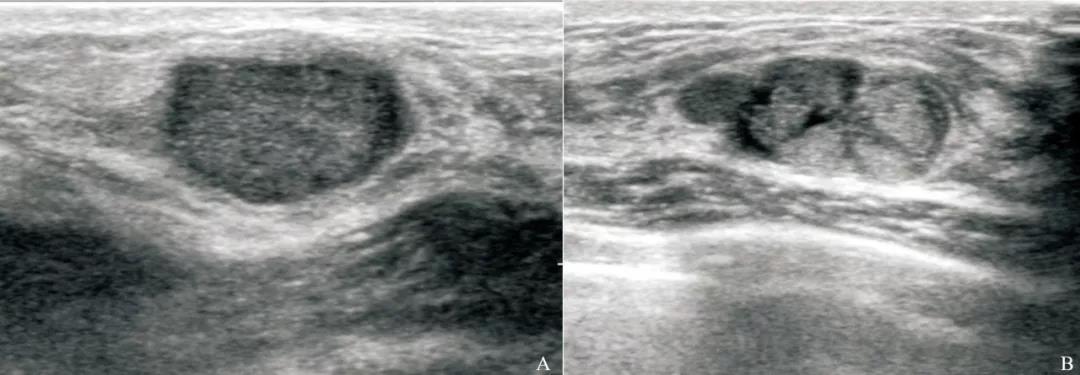
图 3 鉴别诊断难度较高的TNBC及纤维腺瘤的超声声像图
Fig. 3 TNBC and fibroadenoma with similar sonographic appearances
A: Invasive ductal carcinoma in a 35-year-old female patient, tumor size 1.4 cm×1.0 cm×1.3 cm, BI-RADS 4A, grade Ⅲ, Ki-67 30%; B: Fibroadenoma in a 43-year-old female patient, tumor size 1.6 cm×1.2 cm×1.3 cm, BI-RADS 4A
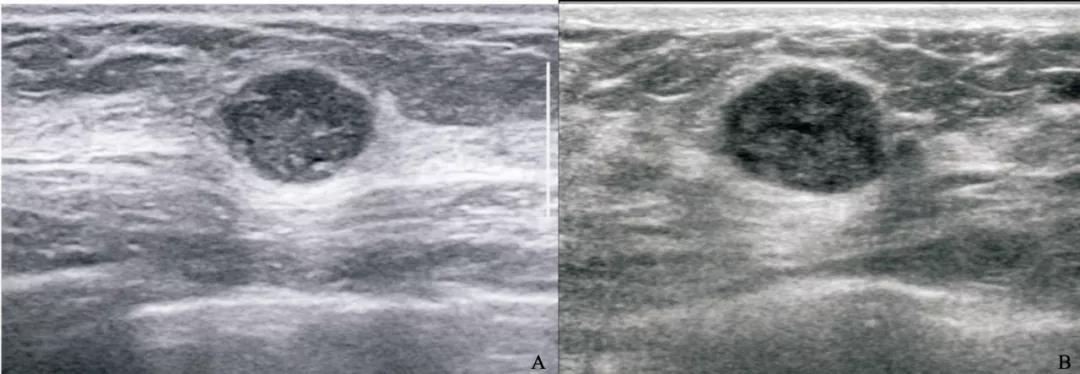
图 4 鉴别诊断难度较高的TNBC及纤维腺瘤的超声声像图
Fig. 4 TNBC and fibroadenoma with similar sonographic appearances
A: Invasive ductal carcinoma in a 33-year-old female patient, tumor size 1.7 cm×1.1 cm×1.4 cm, BI-RADS 4A, grade Ⅲ, Ki-67 80%; B: Fibroadenoma in a 27-year-old female patient, tumor size 2.0 cm×0.9 cm×1.7 cm, BI-RADS 4A
2.3 TNBC的超声特征与其临床、病理学及其免疫组织化学指标的关系分析
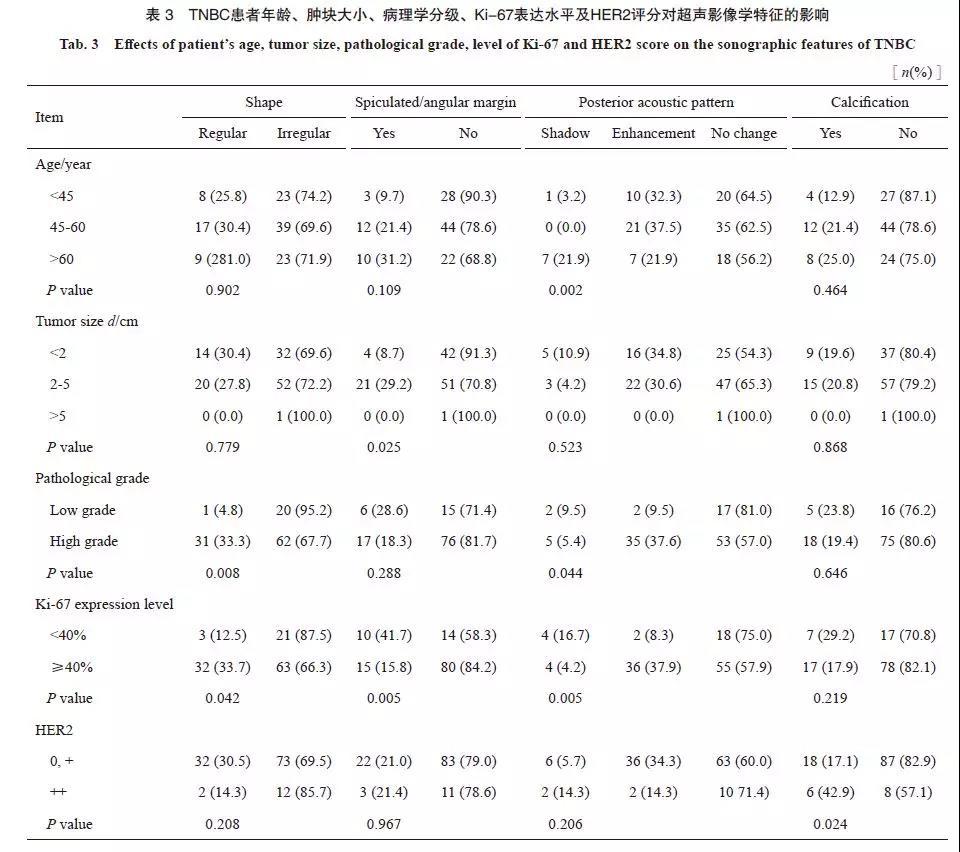
TNBC的超声特征与患者年龄、肿块大小、病理学分级、Ki-67表达水平及HER2评分的相关性见表3。年龄>60岁患者的TNBC肿块出现后方回声衰减的比例高于<60岁的患者(P=0.002)。大小为2~5 cm的肿块出现边缘毛刺成角的比例高于<2 cm的肿块(P=0.025)。相比于低级别TNBC,高级别TNBC表现为形态规则(P=0.008)及后方回声增强(P=0.044)的比例较高。相比于Ki-67表达水平<40%的TNBC,≥40%的TNBC肿块在超声声像图上更多的表现为形态规则(P=0.042)、边缘无毛刺成角(P=0.005)及后方回声增强(P=0.005)。HER2评分高的TNBC出现钙化的比例较高(P=0.024)。
3.讨论
乳腺癌是目前国内女性发病率最高的恶性肿瘤,占所有女性癌症的15%[16]。TNBC是其中恶性程度最高、预后最差的一种分子分型。TNBC的另外一个重要特征为肿瘤的异质性。基于细胞因子[17]、转录组[18-19]或基因组[20],TNBC可分为4个亚型,分别表现出不同的临床预后。另外一项来自21个研究中心的基因表达谱分析显示,TNBC可分为7个亚型[21],这些不同亚型的TNBC在复发风险及对化疗药物的治疗反应方面表现出明显的异质性[17-19]。基于TNBC的异质性,针对相关的信号通路、靶点及抑制剂的研究尚处于动物实验或临床实验阶段,尚未有临床转化的靶向药物[22]。因此TNBC的早期诊断和治疗对改善预后尤为重要。超声检查在乳腺癌的筛查和诊断中发挥着重大作用。
本研究发现浸润性TNBC大部分为浸润性导管癌,组织学级别高,Ki-67增殖程度高,与之前的研究结果一致[1,4-5,12]。本研究中大部分TNBC的超声声像图表现为非平行位、形态不规则、边缘不光整、无毛刺成角、后方回声无改变或增强、不伴钙化的低回声肿块。关于TNBC的超声声像图特征国内外已有文献报道[9-10,12,23-27],但所有研究均为TNBC的超声声像图特征描述性研究及与非TNBC超声特征的比较性研究。本研究首次评估临床、病理学指标及免疫组织化学分子标志物对TNBC超声特征的影响,发现TNBC的超声特征与患者年龄、肿块大小、病理学分级、Ki-67表达水平及HER2评分相关:患者年龄影响肿块的后方回声,肿块大小影响肿块边缘是否有毛刺成角,病理学分级影响肿块的形态及后方回声,Ki-67表达影响肿块的形态、边缘是否毛刺成角及后方回声,HER2评分影响钙化的发生率。
典型的恶性乳腺肿瘤表现为形态不规则、边缘毛刺成角、后方回声衰减的低回声肿块[28]。近年来有研究表明,这些典型的恶性特征通常出现在细胞增殖程度低的低级别乳腺癌中[23,29-31]。与此相反的是,边缘无毛成角或后方回声增强等被认为是良性肿瘤的特征,通常与增殖速度快的高级别乳腺癌相关[10,29-30]。肿瘤细胞增殖快较少诱发基质反应,导致肿块和周围正常组织间的边界较清楚[13,29,32]。边缘毛刺成角与肿瘤增殖率低有关,肿瘤细胞和宿主间有充分的时间相互作用,导致纤维化,包括成纤维细胞、炎性细胞及新生血管结构等[13,29,32]。纤维化引起超声波的反射及衰减,导致肿块后方回声衰减。与有后方回声衰减的乳腺癌相比,后方回声增强的乳腺癌肿瘤细胞成分多,并且倾向于高级别肿瘤[33]。
Ki-67抗原位于人类第10号染色体上,是一种细胞增殖相关蛋白,仅表达于增殖细胞核内,能够影响细胞合成及代谢。Ki-67高表达的乳腺癌肿瘤细胞增殖活跃,组织学级别和恶性程度高[34-35]。由于TNBC的Ki-67表达较高,肿瘤细胞增殖活跃,大部分肿块在超声上表现为边缘无毛刺成角及后方回声无衰减等典型恶性特征,在年轻患者及组织学高级别组中尤为显著。一项基于细胞因子对TNBC分子分型的研究发现,TNBC的病理学边缘特征与其分子亚型相关,病理切片中边缘光整的TNBC大多为基底细胞样亚型,预后较好;相反,浸润性生长的TNBC大多为腔面型,预后较差[17]。超声声像图上肿块的边缘与病理组织的边缘一致。但目前尚无关于TNBC超声特征的分子生物学基础研究及超声特征和肿瘤预后相关的临床意义的报道,这将是今后的研究重点。
TNBC的HER2均为阴性,但其钙化的发生与HER2评分有关,HER2为2级的TNBC比0及1级的病例钙化发生率高。有文献报道,HER2基因扩增与乳腺癌钙化高度相关[36-37]。然而,HER2评分对TNBC钙化的影响尚无报道。HER2基因扩增可引起肿瘤细胞增殖、加速血管生成及减少细胞凋亡[38],但HER2表达水平与乳腺癌超声图像钙化的相关机制值得进一步研究。
年龄是良恶性乳腺肿瘤鉴别诊断的另外一个重要因素,老年患者肿块后方出现回声衰减的比例较年轻人高[30],相对容易鉴别诊断。部分TNBC,尤其是年轻女性的超声声像图特征跟纤维腺瘤难以鉴别[36]。超声是针对年轻女性乳腺肿瘤的首选检查方法。年资低的住院医师需要认识到TNBC超声特征的变异性及超声特征的分子生物学基础。对这部分具有良性特征的TNBC需要引起重视,必要时结合MRI及穿刺活检加以鉴别,以提高对具有良性超声影像学特征的TNBC的检出率,降低漏诊率。
本研究存在一定的不足,为单中心的回顾性研究,数据样本量较小,对静态图像特征的回顾性分析会遗漏某些特征信息,超声声像图特征中缺乏血液流动和弹性评估的信息,今后会在前瞻性的研究工作中加以改进。
综上所述,浸润性TNBC的超声声像图特征与患者年龄、肿块大小、病理学分级、Ki-67增殖水平及HER2评分有关。有些年轻女性的TNBC容易被误诊为良性乳腺肿块。超声医师应该了解TNBC超声特征的分子生物学基础,以早期和准确地诊断TNBC。
文中摘要及参考文献部分略,详见原文。




















共0条评论