[导读] 作者:慧海拾穗
胃肠道恶性肿瘤的免疫标志物评价(二)
【摘要】与其他器官系统一样,免疫组织化学(IHC)可作为多种肿瘤性和非肿瘤性疾病的辅助诊断工具,包括感染、炎症的检查和胃肠道肿瘤分类。此外,IHC还可用于检测胃肠道癌的多种预后和预测性分子生物标记物。文献《An Update on the Role of Immunohistochemistry in the Evaluation of Gastrointestinal Tract Disorders》综述强调IHC在整个胃肠道常见诊断方案中的应用。主要讨论了IHC在胃肠道恶性肿瘤诊断中的应用,如腺癌与鳞状细胞癌(SCC),低分化恶性肿瘤的诊断与鉴别诊断,以及对罕见的胃肿瘤(产生α-甲胎蛋白的癌)和SWI/SNF复合物缺陷性癌的评估。最后,还对原发部位不明的神经内分泌肿瘤进行定位以帮助临床治疗,以及对HPV驱动的肛门肿瘤和IHC在基底样肛门肿瘤诊断中的作用进行了综述。
【前言】也许IHC在胃肠道中最重要的作用对恶性肿瘤进行分类。IHC通常用于定位转移癌的原发部位,并帮助对原发肿瘤(如SCC与腺癌)进行分类。使用谱系特异性标记物IHC也有助于低分化/未分化恶性肿瘤的诊断。这种方法最常用于从肝脏转移病灶、腹膜种植或破坏正常管状肠黏膜的肿瘤中获得的标本。与其他器官系统一样,对于低分化或未分化的恶性肿瘤,应运用一组初始的免疫标记物,以确定肿瘤的谱系:癌(细胞角蛋白AE1/3,OSCAR,CAM5.2),淋巴瘤(CD20,CD3),黑色素瘤(S-100蛋白,SOX10)和肉瘤(结蛋白,平滑肌肌动蛋白,MDM2,ERG)。当然,这个组合应该根据具体的临床病例进行修改。胃肠道转移瘤大多数是腺癌。典型的组合包括CK7、CK20和一些位点特定性标记,如TTF-1和CDX2。本文将不全面讨论CK7/CK20表型,但关于这一主题的有几个好的观点。可能需要相应的乳腺(GATA3,ER,PR)、妇科(PAX8,ER,PR)和前列腺癌(PSA,NKX3.1)标记物。一般来说,CK7/20表型与一个或多个额外的位点特异性标记结合,足以定位原发部位。对于无明显腺体形成的低分化癌,可根据肿瘤的临床病史和肿瘤形态学,结合鳞状细胞分化标志物(p63、p40、CK5/6)、神经内分泌标志物(Syn、CgA)、尿路上皮标志物(GATA3、p63)和肾标志物(PAX8)来提示分化方向。
(一)鳞癌与腺癌鉴别的免疫标志物
区分低分化腺癌和鳞癌是一个常见的难点,尤其是在食道。区分这两个疾病对围手术期、术前治疗以及IV期癌症的治疗都有意义。新辅助化疗或新辅助放化疗是治疗食管腺癌的最佳方法。围手术期化疗也可用于下三分之一或胃食管交界处的可手术腺癌患者。相比之下,食管鳞状细胞癌可以单独用放化疗法,手术保留治疗可能局部病变持续或复发。在DiMaio及其同事的一项研究中,作者评估了一组免疫组化标记物来区分食管SCC和腺癌。他们发现CK5/6(敏感性98%,特异性87%)和p63(敏感性100%,特异性90%)能够识别大多数SCC。此外,虽然p63或CK5/6染色在腺癌中很少观察到,但这些标记物的表达是相互独立的。因此,鉴于p63和CK5/6在检测SCC中的作用,作者认为CK5/6和p63标记物阴性则排除了SCC,支持了腺癌的诊断。有报道显示在诊断鳞状细胞癌尤其是肺部鳞状细胞癌方面p40比p63具有优越性。SCC几乎总是p63阳性,然而,各种非SCC肿瘤也可能表现出一些反应性,包括肺腺癌、某些肉瘤和淋巴瘤。常用克隆A4A的p63抗体可识别该蛋白的ΔNp63和TAp63亚型。p40抗体只针对ΔNp63亚型。只有少数研究比较了p63和p40在胃肠道癌中的表达。例如,Mochizuki和他的同事研究了胃食管连接处15例 SCC和26例腺癌,发现p63和p40对SCC的敏感性均为100%。然而,p40的特异性(88%)高于p63(46%)。Brown等人比较了一组SCC(n=25)和腺癌(n=24)中p40、p63和CK5/6在不同胃肠道原发灶的表达。p63在所有SCC和12.5%的腺癌中均有表达,p40在92.5%的SCC和4.1%的腺癌中有表达。CK5/6在96.2%的SCC和20.9%的腺癌中呈阳性。在本研究的基础上,p63是鳞状细胞分化的一个更敏感的标志物,而p40则更为特异(图2)。然而,由于缺乏检查胃肠道p40的研究,需要更多的工作来评估其作为独立诊断标记物的实用性。实际工作中,当试图区分鳞癌和腺癌时,最好包括p63、CK5/6和p40这一组合。
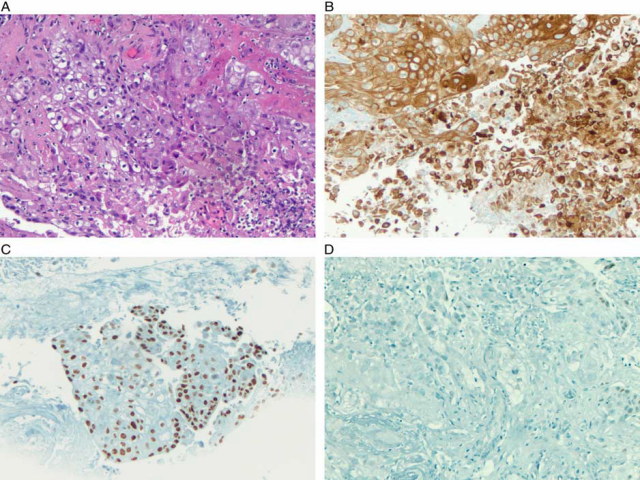
图2:食管鳞状细胞癌(A),CK5/6(B)和p63(C)阳性,p40(D)阴性。
(二)产生α-甲胎蛋白的癌
尽管绝大多数胃癌是肠型或弥漫型,但一些不常见的胃癌亚型需要辅助检查才能确诊。一种罕见的胃癌亚型以产生甲胎蛋白(AFP)为特征。产生AFP的癌占胃癌的2.7%~5.4%。这些肿瘤特别具有侵袭性,因为它们经常出现肝转移,与普通型腺癌相比预后不良。
在组织学上,这些肿瘤表现出两种不同的形态,即具有肝样分化和胎儿型分化的细胞。产生AFP的癌具有肝样分化时类似于肝癌,呈实性巢状或小梁状生长,瘤细胞多角形,胞质丰富嗜酸性。可见胆汁生成。这些通常被称为胃的肝样腺癌。胎儿型分化的特点是瘤细胞呈柱状,胞质透亮,呈管状或乳头状结构生长。这些形态可能相互混合,并且与更普通型的肠型腺癌间存在移形区。顾名思义,产生AFP的癌AFP呈阳性。除AFP外,许多肿瘤同时表glypican-3和SALL4(图3)。Ushiku等人对101例胃癌检测glypican-3的表达,其中大约一半的胃癌表现为肝样或胎儿型分化。glypican-3阳性病例中只有25%表达AFP。然而,鉴于它们的形态和侵袭行为,作者认为glypican-3阳性和AFP阴性的癌也可能属于这一类。需要更多的工作来确定最佳方法定义这一类别肿瘤,以及是否应该基于形态学、一个或多个癌胚蛋白的表达,或者两者的结合。
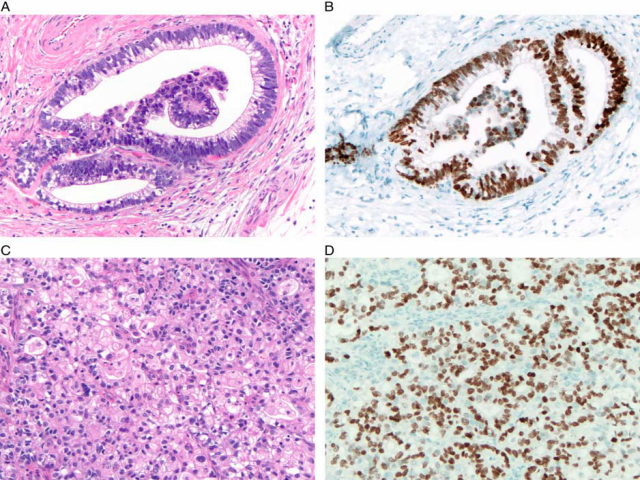
图3 产生甲胎蛋白的胃癌:活检显示有两种不同形态的肿瘤。管状生长模式,单个细胞呈柱状,胞质透亮(A)。这些细胞SALL4呈弥漫性阳性(B)。在其他区域,肿瘤表现出更多的肝样形态,其特征是细胞胞质丰富嗜酸性和小梁生长模式(C)。这些区域SALL4阳性(D)。
具有肝样特征的产生AFP的癌与HCC的鉴别值得进一步讨论。具有肝样特征的产生AFP的癌常转移到肝脏,因此,可与HCC非常相似。临床结果可以作为初步提供帮助。已知肝病患者的明显肿块最可能是肝癌。相比之下,健康肝脏中的多发性肝脏肿块,同时伴有胃肿块,高度提示胃原发累及肝脏。从形态学上看,这两个疾病是不可区分的。即使在IHC的帮助下,具有肝样特征的产生AFP的癌也很难与HCC鉴别。具有肝样特征的胃腺癌通常对肝细胞标志物阳性,包括AFP、HepPar-1、精氨酸酶-1和白蛋白。然而,SALL4被证明在这一区别中是有帮助的。Ushiku及其同事比较了SALL4在338例胃癌、60例HCCs、48例胆管细胞癌和31例产生AFP的胃癌(包括18例以肝样为主)中的表达。所有HCCs均表达SALL4,78%的胃腺癌为阳性。同样,Ikeda和他的同事比较了产生AFP的胃癌(n=20)和同时患肝癌胆管癌(n=20)中SALL4的表达。95%的产生AFP的胃癌表达SALL4,而同时患肝癌胆管癌中SALL4阳性率为0%。因此,SALL4对具有肝样特征的产生AFP癌的诊断具有特异性,不过并不完全敏感。
(三)SATB2在腺癌诊断中的应用
SATB2是一种DNA结合蛋白,最初发现于成骨细胞谱系的形成中。多种研究表明,SATB2在阑尾和直肠上皮细胞中也有表达,约在这些部位起源的85%~95%腺癌中有表达。SATB2可用于鉴别结直肠和阑尾来源的低分化腺癌,其有时会失去其特有的细胞角蛋白和CDX2表达(图4)。例如,在一项对18例结肠髓样低分化癌的研究中,89%的病例SATB2阳性表达,而CK20和CDX2分别只有28%和67%。
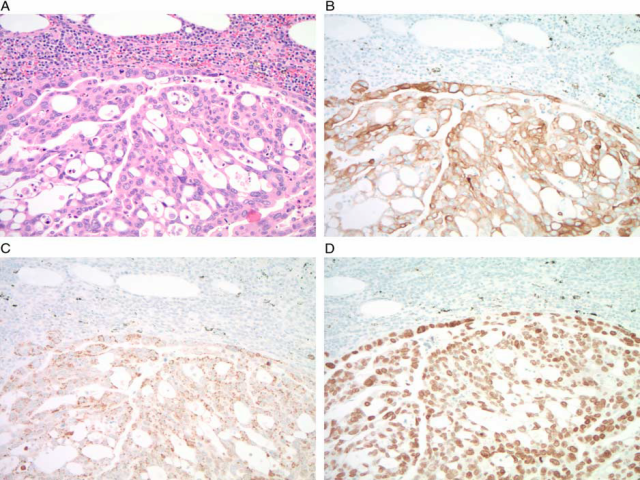
图4:患者,55岁,男性,有直肠腺癌病史,表现为门静脉周围淋巴结肿大。淋巴结活检显示浸润性腺癌(A),CK20阳性(B),CDX2阴性(C),SATB2阳性(D)。总的来说,免疫组化显示患者直肠原发性转移。
SATB2之所以越来越受欢迎,部分原因是它能够区分结肠阑尾腺癌和卵巢腺癌。原发性卵巢黏液腺癌很难与大肠或阑尾原发性卵巢继发病变相鉴别。有多种线索可以帮助区分这一点。有利于判断为转移的病理因素包括双侧卵巢受累、肿瘤>10cm、肿瘤表面受累、浸润性基质受累、血管侵犯和印戒细胞的存在。CK7、CK20和CDX2组合免疫组化检测通常有助于鉴别。总的来说,大多数卵巢肿瘤CK7阳性,CK20和CDX2阴性表达。然而,黏液性卵巢肿瘤更可能显示CK7+/CK20+或甚至CK7-/CK20+。CDX2对结肠和阑尾腺癌的敏感性高(92%),但特异性稍差,因为它在40%的黏液性卵巢肿瘤中也呈阳性。然而,CDX2在卵巢黏液性肿瘤中通常呈片状弱阳性,弥漫性核染色诊断结肠或阑尾起源肿瘤,但仅7%病例阳性。正常或肿瘤性卵巢上皮细胞不表达SATB2。Stickland及其同事的一项研究发现,SATB2在卵巢黏液癌中的表达率为1/20,20例卵巢黏液交界性肿瘤均为阴性表达。相比之下,SATB2在阑尾起源的肿瘤中的表达率为93.8%。同样,Moh和他的同事研究了大量卵巢肿瘤:黏液性囊腺瘤(n=22)、黏液交界性肿瘤(n=60)、黏液性腺癌(n=17)和子宫内膜样腺癌(n=72)。他们发现SATB2在5/177(3%)卵巢肿瘤中表达。有趣的是,这些肿瘤中有4个与畸胎瘤成分有关,SATB2表达可能是由病变内的肠畸胎瘤成分引起的。相反,SATB2在75%的结直肠腺癌、80%的低级别阑尾肿瘤和100%的高级别阑尾腺癌中表达。SATB2也有助于定位卵巢Krukenberg肿瘤的起源。大多数Krukenberg肿瘤表现为胃肠道转移,文献报道,原发于卵巢病例罕见。胃是最常见的原发部位(75%),其次是结直肠(11%),乳腺、阑尾和胆囊/胆管(共3%)。Krukenberg肿瘤累及卵巢可能是患者最初的表现,原发灶的定位可能是一个挑战。Yang和他的同事对70例Krukenberg肿瘤研究,发现SATB2在7/13(54%)结直肠原发癌和19/19(100%)腺癌杯状细胞癌中,但只有1/27(4%)胃原发癌、1/5(20%)乳腺原发癌和1/3(33%)膀胱原发癌表达。因此,SATB2染色强烈支持阑尾或结直肠起源,实际上排除了胃原发性。
(四)胃肠道SWI/SNF复合物缺陷性癌
SWI/SNF复合物是一组与染色质重塑有关的保守蛋白质。至少有8个基因编码这个复合体的成员。其中,SMARCB1(INI1)是研究最为广泛的亚单位。SMARCB1缺乏见于恶性横纹肌样瘤、非典型畸胎瘤/横纹肌样瘤、上皮样肉瘤、肾髓质癌、上皮样恶性周围神经鞘瘤、肌上皮癌和骨外黏液样软骨肉瘤。SWI/SNF复合物的其他亚单位(SMARCA2、SMARCA4、ARID1A)的抗体正变得越来越广泛,缺乏属于该复合物的其他蛋白表达的肿瘤也越来越受到重视。SWI/SNF复合物缺陷性癌在胃肠道少见(图5)。在Agaimy等人的一系列研究中,作者描述了来自胃肠道的13例SWI/SNF复合缺陷性癌:结肠(n=5)、小肠(n=2)、小肠和大肠(n=1)、胃(n=3)、壶腹部(n=1)和食管胃交界处(n=1)。所有肿瘤均呈高度间变性的大中细胞,横纹肌样特征细胞不等,常有多形性瘤巨细胞。1例伴腺样分化。只有1例与黏膜原位成分有关。SWI/SNF成分IHC显示SMARCB1(5/13)、SMARCA2(10/13)、SMARCA4(2/13)和ARID1A(2/13)丢失。一些肿瘤显示多个SWI/SNF成分丢失。例如,所有SMARCB1缺陷肿瘤对SMARCA2也呈阴性。有趣的是,2例微卫星不稳定,MLH1和PMS2蛋白丢失。鉴别这些肿瘤的临床意义尚不完全清楚。一般来说,SMARCB1缺乏与侵袭性临床行为有关。然而,由于缺乏数据,尚不清楚这是否适用于胃肠道癌。有趣的是,Agaimy等人对具有横纹肌样形态的胃肠道癌进行了文献回顾,确定了29/35的患者(83%)在12个月内死于疾病。根据横纹肌样形态,他们推测这些肿瘤可能存在SWI/SNF缺陷。需要更多的研究来验证这一假设,特别是针对SWI/SNF复合物的更特异的抗体运用于诊断。
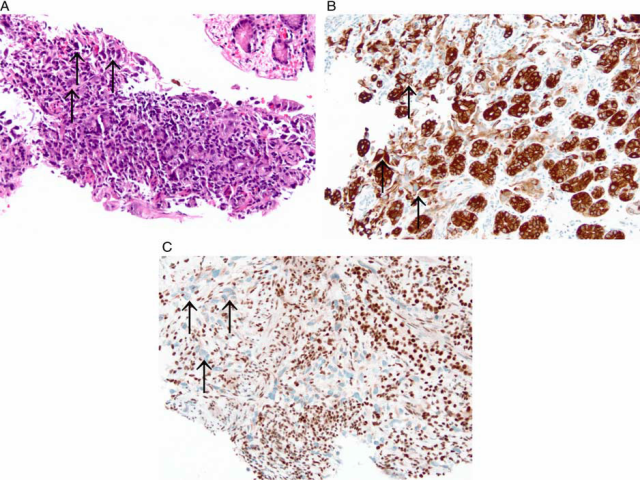
图5 胃肠道INI1缺陷性癌。胃活检显示一种低分化肿瘤浸润固有层(A)。这些细胞表达CAM5.2(B),缺乏INI1表达(C)。黑色箭头突出显示肿瘤细胞。
~~~未完待续~~~

















共0条评论