[导读] 作者:慧海拾穗
【摘要】具有低分化/未分化形态的高级别恶性肿瘤对诊断带来了很大挑战。越来越多地利用免疫组化和分子检测来描述这些肿瘤的组织病理学表型已经成为必要的了,特别是在头颈部肿瘤中。近年来,基于特定的免疫组化和遗传学特征,对一些具有低分化/未分化形态的肿瘤实体有了进一步的认识。Mok等在《Annals of Diagnostic Pathology》杂志发表了一篇题为《High-grade myoepithelial carcinoma can show histologically undifferentiated /anaplastic features》的文章,本文对其主要内容进行翻译如下:
(1)简介
头颈部未分化的恶性圆形细胞肿瘤由于其不同的组织发生/分化线索和重叠的形态学特征,给诊断带来了巨大的挑战。近年来,基于特异性免疫组化和遗传特征,一些显示这种形态学模式的肿瘤实体有了进一步的认识。我们在此报告两例高级别肌上皮癌,其在光镜下表现未分化的恶性间变性细胞。一例发生在下颌下腺,另一例发生在左鼻腔。具有这些形态学特征的高级别肌上皮癌(MECA)亚型的存在增加了这个本身就复杂的诊断领域的鉴别诊断,包括具有高度不同组织发生和/或分化谱系的各种不同类型的肿瘤。
(2)病例介绍
病例1:患者,男性,85岁,有高血压和慢性肾脏疾病病史,40包/年的吸烟史,因出现持续2个月的无痛性左颈肿胀而就诊。体格检查:左下颌下腺可触及一个质硬肿块,最大直径10厘米。磁共振成像(MRI)显示左下颌下腺一个7.5cm的局部侵袭性肿块,伴有中央坏死和血管包裹(图1a)。左颈部淋巴结肿大。胸部CT扫描显示多发肺实质及胸膜结节,大小在0.8~1.2cm,符合转移瘤。下颌下腺肿块的细针穿刺活检发现成团和单个的肿瘤细胞(图1b,c)。肿瘤细胞核质比高,胞质少。细胞核呈中度多形性,染色质空泡状和单核到多核。未见基质成分。细胞学考虑高级别恶性肿瘤,未进一步分类。随后进行了切除活检,显示实性肿瘤,由高度非典型的间变性恶性细胞呈片状和岛状排列(图1d),浸润到邻近的骨骼肌。无腺样、鳞状或横纹肌样分化。肿瘤细胞长15~30μm,细胞核大、空泡状、核仁明显,胞质稀少、嗜碱性至空泡状(图1e、f)。核分裂象多见,在肿瘤坏死区明显。未见黏液样或玻璃样变基质。进行了多个免疫标记物染色,结果显示:瘤细胞表达p63(图1g)、SMA(图1h)和p53(强而弥漫的核表达,图1i)。ki-67增殖指数高达80~90%。瘤细胞不表达细胞角蛋白(AE1/AE3、CAM5.2、MNF116、34βE12、CK14和CK5/6)、EMA、p40、S100、HMB45、SOX10、Syn、CgA、p16、NUT、Napsin A、amylase、CD99、desmin、CD31、CD34、ERG、LCA、CD43、CD68和CD163。EBER阴性。免疫组化SMARCB1和SMARCA4表达保留。BRAF和NRAS突变分析显示两个基因均为野生型。用PCR法进行HPV分子检测结果阴性。使用基于锚定多重PCR的下一代测序进行的基因融合分析,未识别涉及PLAG1、HMGA2、EWSR1或ALK基因的融合。患者接受了短暂的姑息性放射治疗,3个月内因疾病进展而死亡。
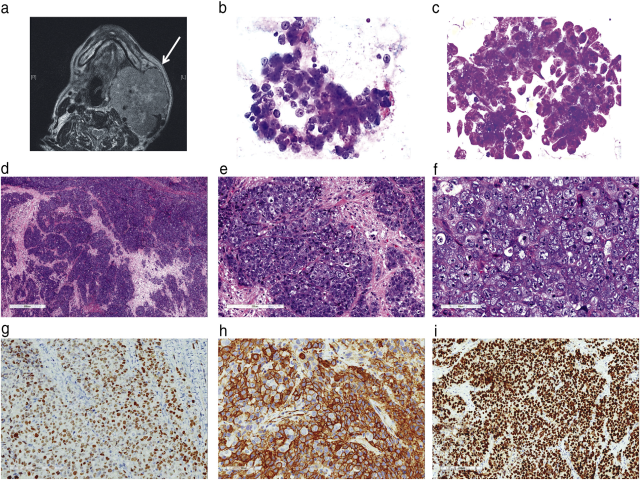
图1:头颈部MRI显示左侧下颌下腺一个大肿块(箭头所示),局部浸润,伴有中心性坏死(a);颌下腺肿块的细针抽吸显示肿瘤细胞成团,核质比率高,核染色质空泡状,单核或多核(b–pap,c–hc);HE染色切片显示恶性肿瘤细胞呈片状分布,核染色质空泡状,核仁明显,胞质稀少,为淡嗜碱性至空泡状(D-F);免疫组化显示p63(g)、SMA(h)呈局灶阳性,p53(i)呈弥漫强阳性;
病例2:患者,男性,64岁。既往无相关病史,有1年左侧鼻出血史。鼻内窥镜显示左前鼻腔有一个2cm长的不规则肉质肿瘤,经核磁共振证实(图2a)。鼻中隔、硬腭、左上颌窦及鼻咽均无肿瘤侵犯。未发现其他局部或远处转移。随后肿瘤完整切除送检。显微镜下显示一个明显异型、未分化的高级别恶性小圆形细胞肿瘤(图2b-d)。未见角化或腺样分化。瘤细胞染色质细腻,核仁为单个或多个。核分裂象易见,形态不典型。有片状坏死。未发现低级别成分。进行了多个免疫标记物染色,结果显示:细胞角蛋白Cam5.2(图2e)、MNF116、AE1/AE3、34βE12和EMA呈斑片状阳性表达。肿瘤细胞p63呈强的弥漫阳性(图2f)。CK5/6和SMA斑片状阳性(图2g)。ki-67增殖指数为90%。瘤细胞不表达CD3、CD20、S-100、Melan-A、Syn、CgA、Desmin、MyoD1、Myogenin和CD99。EBER原位杂交阴性。NUT无过度表达。免疫组化SMARCB1和SMARCA4表达保留。p53呈强而弥漫的核表达(图2h)。p16在大约90%的肿瘤细胞中显示出中等至强核阳性(图2i)。 HPV-DNA检测结果为阴性。使用靶向测序进行的基因融合分析未识别到PLAG1、HMGA2、EWSR1或ALK基因融合。病人接受放射治疗,11个月随访时仍有转移性病灶(多发骨转移,累及颅底、脊柱和肋骨)。
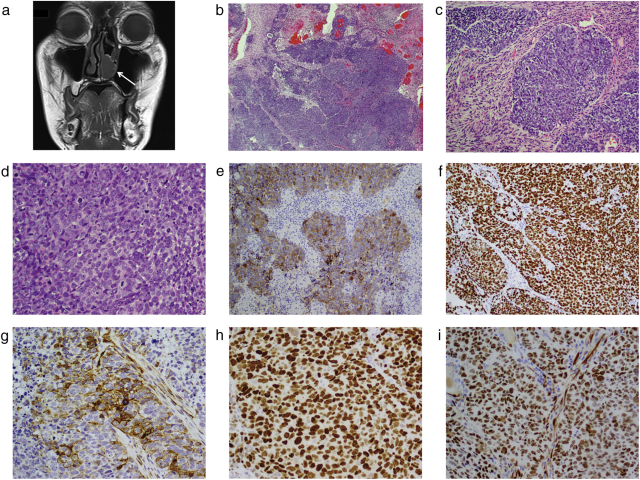
图2:头颈部MRI显示左前鼻腔有一个2cm大小的增强软组织肿块(箭头)(a);HE染色切片显示一个低分化的恶性小圆形细胞肿瘤,染色质细腻,核仁一至多个,核分裂象易见(B-D)。免疫组化显示Cam5.2(e)呈斑片状表达,p63(f)呈弥漫强阳性表达,SMA(g)呈斑片状表达;p53(h)呈弥漫性强阳性,瘤细胞核p16(i)呈中等强表达。
(3)讨论
光镜下头颈部未分化高级别恶性肿瘤的诊断具有挑战性。近年来,这些肿瘤的分类已经发展,认识了一些新的肿瘤实体。例如INI1缺陷性鼻窦癌和缺乏分化标志的转移性黑色素瘤。对于发生在唾液腺内/附近的肿瘤,由于在上呼吸道广泛存在小唾液腺,意味着存在广泛的解剖组织,其他考虑的诊断包括高级别基底细胞癌和皮脂腺癌、实性型腺样囊性癌、癌在多形性腺瘤中、大细胞神经内分泌癌和NUT癌。此外,考虑到所有的涎腺癌都可能经历高级别的转化,病理医生遇到头颈部发生的形态学未分化的高级别癌时,必须考虑到这一点。当光镜下为差分化或未分化癌时,在鼻腔、鼻窦的未分化癌、高级别嗅神经母细胞瘤、鼻咽未分化(淋巴上皮)癌、鼻腔畸胎瘤样癌中的神经上皮细胞(神经母细胞瘤样)也需要考虑。此外,软组织肿瘤包括实性腺泡状横纹肌肉瘤(ARMS)、原始神经外胚层肿瘤/Ewing肉瘤(PNET/ES)、促结缔组织增生性小圆细胞肿瘤(DSRCT)、低分化滑膜肉瘤和去分化孤立性纤维性肿瘤也应在鉴别诊断范围内。淋巴造血系统恶性肿瘤,如结外鼻NK/T细胞淋巴瘤,侵袭性B细胞淋巴瘤和髓系肉瘤在光镜下常表现为未分化/高级别的组织形态学特征,因此在面对具有高级别组织形态学特征的肿瘤时也要考虑。















共0条评论