[导读] 编译整理:强子
肌源性肉瘤及其新进展(一)
肌源性肉瘤及其新进展(三)
横纹肌肉瘤
2.腺泡状横纹肌肉瘤
腺泡状横纹肌肉瘤主要为形态单一的原始细胞构成,细胞核圆形,具有肌分化受阻(arrested myogenesis)的特征。腺泡状横纹肌肉瘤可发生于任何年龄,但相比年轻儿童来说,更多见于青少年和年轻人。患者年龄中位数6.8-9.0岁。腺泡状横纹肌肉瘤比胚胎性横纹肌肉瘤要少见,约占儿童横纹肌肉瘤的20%;无明显性别差异,也无明显地域或种族差异。
腺泡状横纹肌肉瘤一般发生于四肢,还可发生于脊柱旁、会阴、鼻窦等处。临床上一般表现为肢体处快速生长的肿物;其他部位者则主要产生压迫周围结构所致的症状。一般腺泡状横纹肌肉瘤确诊时分期较高,形成膨胀性、快速生长的软组织肿物。
组织学上细胞丰富,细胞形态为原始表现,细胞核圆形,纤维脉管束将肿瘤细胞分隔为巢团状。细胞巢中央的细胞黏附性差,而周边细胞密集,形成“腺泡状”表现。常见伴横纹肌母细胞分化的巨细胞。实性亚型的腺泡状横纹肌肉瘤缺乏纤维血管性间质,圆形肿瘤细胞形成片状,伴程度不一的横纹肌母细胞分化。
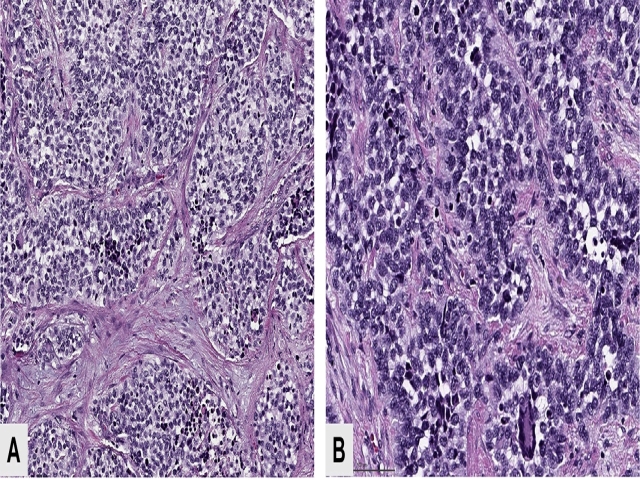
图4. 腺泡状横纹肌肉瘤,瘤细胞呈巢,细胞巢之间有纤维束分隔,低倍镜下呈腺泡状;高倍镜下,细胞中等大小,散在巨细胞。
免疫组化方面,腺泡状横纹肌肉瘤强阳性表达desmin;MyoD1一般也是细胞核弥漫强阳性。Myogenin一般弥漫阳性,不同于胚胎性横纹肌肉瘤中的局灶斑片状阳性,可作为小活检标本中的分型线索。据报道,头颈部腺泡状横纹肌肉瘤中约1/3至1/2会出现上皮标记的阳性表达。
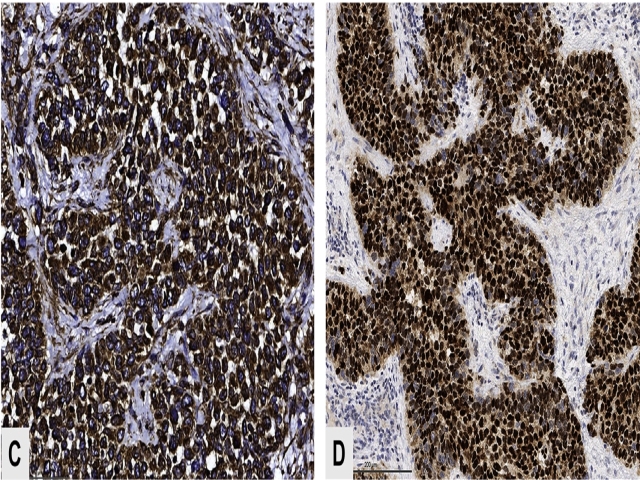
图5. 腺泡状横纹肌肉瘤,免疫组化弥漫阳性表达desmin(左)、myogenin(右)。
从形态学来说,腺泡状横纹肌肉瘤需鉴别其他亚型横纹肌肉瘤、小蓝圆细胞肿瘤谱系中的其他类型,后者如Ewing肉瘤、促纤维结缔组织增生性小圆细胞肿瘤。免疫组化及分子遗传学检测有助于确诊。
腺泡状横纹肌肉瘤有特征性基因易位,大部分病例中均有t(2;13)(q35;q14),少部分病例则为t(1;13)(p36;q14):2号染色体上的PAX3基因、1号染色体上的PAX7基因分别与13号染色体上的FOXO1基因融合,形成PAX3-FOXO1、PAX7-FOXO1融合基因。
腺泡状横纹肌肉瘤作为一种高级别肿瘤,比胚胎性横纹肌肉瘤更具侵袭性。前述国际横纹肌肉瘤协作组分组可预测预后。部分研究提出PAX7-FOXO1阳性肿瘤要比PAX3-FOXO1阳性肿瘤预后好,但不同基因融合的预后意义尚未完全明确。与胚胎性横纹肌肉瘤不同,腺泡状横纹肌肉瘤是少数可以转移至局部淋巴结的肉瘤之一,因此对腺泡状横纹肌肉瘤患者应注意影像学检查局部淋巴结。部分单位还会进行前哨淋巴结定位。成人腺泡状横纹肌肉瘤的预后也要差于成人胚胎性横纹肌肉瘤的预后。
3.多形性横纹肌肉瘤
多形性横纹肌肉瘤几乎总是发生于成人,其组织学形态为怪异的多边形、圆形及梭形细胞,具有骨骼肌分化特点,但无胚胎性或腺泡状横纹肌肉瘤成分。男性患者更为多见,年龄中位数50-70岁。临床上一般发生于下肢的深部软组织,但其他多个部位也有报道。
临床上,大部分患者表现为快速生长、伴疼痛、肿胀的肿物。肿瘤一般较大,5-15cm不等,境界清楚,周围常有假包膜。切面灰褐色、肉质,伴程度不等的出血及坏死。形态学上表现为多形性肉瘤,细胞为未分化的圆形至梭形细胞,混有多边形细胞,胞质丰富、嗜酸性,细胞可呈梭形、蝌蚪状、网球拍样。一般无横纹。
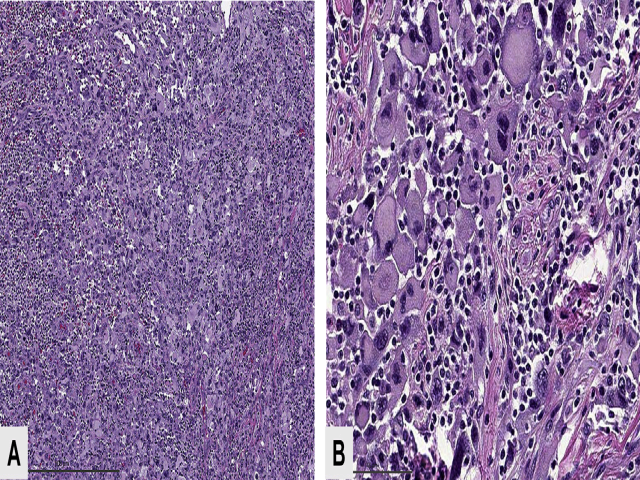
图6. 多形性横纹肌肉瘤,低倍镜下瘤细胞呈片状排列,高倍镜下为横纹肌样形态的大细胞,细胞核大而多形性。
免疫组化方面,多形性横纹肌肉瘤与其他亚型横纹肌肉瘤一样,也表达desmin、MyoD1、myogenin,且MyoD1和myogenin呈局灶阳性。遗传学方面,多形性横纹肌肉瘤核型复杂,具有拷贝数异常、结构不平衡方面的异常。该组肿瘤预后差。
由于该组肿瘤主要发生于成人,因此应注意鉴别其他高级别肿瘤,如去分化脂肪肉瘤、高级别未分化多形性肉瘤。免疫组化和分子遗传学检测有助于明确诊断。
4.梭形细胞型/硬化性横纹肌肉瘤
该亚型横纹肌肉瘤并不常见,最初认为是胚胎性横纹肌肉瘤中的梭形细胞亚型。鉴于这部分肿瘤形态学特殊,因此目前2013年版世界卫生组织软组织肿瘤分类将其视为横纹肌肉瘤的一个单独亚型。
这一亚型肿瘤年龄分布宽泛,自婴幼儿至老年人均可发生,大部分为儿童及青少年。肿瘤主要发生于头颈部,其他部位如四肢及附睾等处也有报道。临床表现为无痛性肿物,或出现压迫所致症状。大体一般境界清楚,切面灰白色、编织状。镜下可以出现多种形态。部分肿瘤可表现为形态温和的梭形细胞增生,胞质嗜酸性、纤维样,类似真正的平滑肌分化。细胞一般呈长束状排列,使人有成人型纤维肉瘤中鱼骨样表现的感觉。部分肿瘤可见伴横纹的横纹肌母细胞。还可表现为类似纤维肉瘤、平滑肌肉瘤、恶性外周神经鞘瘤的梭形细胞增生。硬化性表现显著时,背景为广泛透明样基质,伴局灶腺泡状结构,因此形成假血管样表现。部分硬化性区域可类似骨肉瘤。免疫组化方面,该亚型横纹肌肉瘤弥漫表达desmin。Myogenin则一般不表达,罕见情况下局灶阳性。MyoD1阳性。
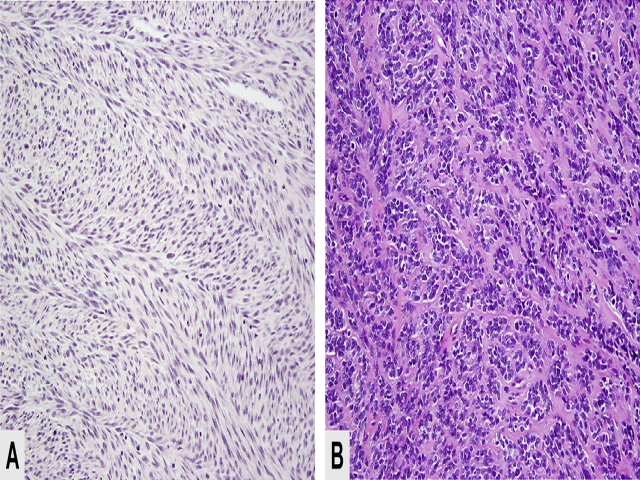
图7. 梭形细胞型/硬化性横纹肌肉瘤。左图示梭形细胞呈均一的束状、鱼骨状排列。右图示硬化性胶原性背景中,小巢状肿瘤细胞由于中央淡染,形成硬化性“假血管”样表现。
相关研究表明,这一亚型的分子遗传学改变可以分为三种情况:(1)婴儿或先天性病例中具有NCOA2、VGLL2相关的基因融合;(2)成人及儿童的梭形细胞性横纹肌肉瘤常见MYOD1 p.L122R基因突变,而MYOD1突变的硬化型/梭形细胞性横纹肌肉瘤会有一部分(可高达1/3)同时具有PIK3CA基因的突变;(3)部分病例尚无已知分子遗传学异常。
该组肿瘤患者的预后与分子遗传学有显著相关性。最近有研究表明,儿童及成人的MYOD1突变型硬化型/梭形细胞性横纹肌肉瘤临床表现激进,即使经积极化疗预后也较差。婴儿伴VGLL2相关基因融合的硬化型/梭形细胞性横纹肌肉瘤患者似乎预后尚好。
横纹肌肉瘤诊断策略
横纹肌肉瘤各亚型有明显的年龄分布差异,因此儿童可发生胚胎性、腺泡状、梭形细胞型/硬化性亚型,而成人鉴别诊断还要考虑到多形性横纹肌肉瘤。随着微创、精准概念的推行,目前临床很推崇穿刺活检;这方面粗针穿刺活检要优于细针穿刺活检,因为一方面可以评估形态学结构,另一方面可以获取充分材料进行免疫组化及分子相关检测。应根据肿瘤形态学表现选择免疫组化指标。具体说来,如肿瘤形态学为小圆形蓝染细胞,无明显横纹肌母细胞分化,则应选择desmin、myogenin、MyoD1在内的一组指标;如果肿瘤有明确的横纹肌母细胞分化,则上述指标主要是为证实形态学判定。尽管形态学和免疫组化对于亚型判断有一定指导作用,但对于所有新确诊的横纹肌肉瘤均应进行FOXO1基因的FISH检测或其他分子相关检测,以排除FOXO1融合阳性腺泡状横纹肌肉瘤可能。如形态学提示硬化型/梭形细胞性横纹肌肉瘤,则应检测有无MYOD1突变,因为这对预后判定有指导作用。
点击下载英文文献
参考文献
Update on Myogenic Sarcomas[J].Surgical pathology clinics,2019,12(1):51-62.
DOI:10.1016/j.path.2018.10.003

















共0条评论