[导读] 作者:郑卫真, 孙菊杰, 刘雁冰, 毕钊,赵桐,王永胜;来源: 中国癌症杂志, 2019, 29 (6): 445-451;通信作者:王永胜 E-mail: wangysh2008@aliyun.com
[摘要]
背景与目的:新辅助化疗(neoadjuvant chemotherapy,NAC)是局部晚期乳腺癌患者的标准治疗模式,2018年有研究报道了一个多变量预测模型,用于预测临床腋窝淋巴结阳性(clinical lymph node-positive,cN+)患者NAC后腋淋巴结病理完全缓解(ypN0)的概率。分析乳腺癌NAC后ypN0的相关因素,验证Olga Kantor预测模型的临床应用价值。
方法:纳入山东大学附属山东省肿瘤医院2014年4月—2018年5月收治的350例临床腋淋巴结阳性NAC后行腋窝淋巴结清扫术(axillary lymph node dissection,ALND)的患者,并进行Olga Kantor预测模型的验证;由于该模型采用术后病理学评估乳腺原发肿瘤反应无助于术前预测ypN0,因此采用术前影像评价替代术后病理学评估进行改良,分别分析验证模型和改良模型的独立预测因素,计算受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under curve,AUC)评估两模型的预测效能。
结果:验证模型中年龄、分型分组及病理乳房原发肿瘤反应为ypN0的独立预测指标,改良模型中年龄、分型分组及临床乳房原发肿瘤反应为ypN0的独立预测指标(P均<0.05)。验证模型及改良模型的AUC分别为0.788和0.782(P>0.05)。改良模型分数≤3分、4~7分及≥8分患者NAC后ypN0概率分别为2.5%(1/40)、22.4%(51/228)和68.3%(56/82)。
结论:Olga Kantor预测模型可以较为准确地评估cN+患者ypN0概率,改良模型具有同等的预测效能且更贴合临床实际,有助于NAC后腋窝处理模式的合理选择:得分≤3分推荐直接行ALND,4~7分可选择前哨淋巴结活检(sentinel lymph node biopsy,SLNB),≥8分推荐行SLNB。
前哨淋巴结活检术(sentinel lymph node biopsy,SLNB)是临床腋淋巴结(axillary lymph node,ALN)阴性早期乳腺癌患者腋窝处理的标准治疗模式[1]。近年来在临床腋淋巴结阳性(clinical lymph node-positive,cN+)、接受新辅助化疗(neoadjuvant chemotherapy,NAC)后ALN转阴(ypN0)的患者中,SLNB的可行性也被证实[2]。Sentina和ACOSOG1071研究显示,采用双示踪剂、检出>2枚前哨淋巴结,可使NAC后ypN0患者假阴性率降低到10%或以下[3-4]。基于上述研究,NAC后SLNB已被纳入NCCN指南及St. Gallen专家共识[5-6]。但目前NAC后行SLNB的总体假阴性率仍然较高,优化患者选择、提高选择的敏感性是NAC后SLNB进一步开展需要解决的问题[4]。NAC后更可能达到腋窝病理完全缓解(ypN0)的患者,其接受SLNB假阴性事件的发生概率将显著降低。2018年Kantor等[7]研究并发表了一个多变量预测模型,用于预测初始cN+患者NAC后ypN0的概率,建模组(n=13 396)和验证组(n=5 719)的受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under curve,AUC)分别为0.781和0.788,具有较高的准确性;但作者认为此模型需要进一步的外部验证。本研究旨在探索NAC后ypN0的独立预测因素,验证Olga Kantor预测模型的临床应用价值;由于该模型采用术后病理评估乳腺原发肿瘤反应无助于术前预测ypN0,我们采用术前影像评价替代术后病理学评估进行改良,为NAC后腋窝处理模式的合理选择提供支持。
回顾性分析山东大学附属山东省肿瘤医院2014年4月—2018年5月收治的确诊为乳腺癌并接受NAC的患者458例,其中350例临床腋淋巴结阳性(cN+)患者NAC后接受常规乳房手术及ALND的患者(cT1-4N1-3M0)纳入预测模型研究。
所有患者NAC前均接受原发肿瘤的空芯针穿刺(规格12~14 G,取材3~5条;多灶性患者需分别取材)。ALN采用细针抽吸细胞学检查或空芯针穿刺病理学检查。所有入组患者均接受足疗程含蒽环类和(或)紫杉类药物方案的新辅助化疗。
所有患者NAC后均接受常规乳房手术(包括保乳、乳房切除或重建)以及标准的ALND,要求至少清扫Ⅰ、Ⅱ水平,清扫淋巴结数目>10枚。激素受体(hormone receptor,HR)阳性定义为雌激素受体或孕激素受体≥1%[8],人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性定义为免疫组织化学或荧光原位杂交技术(fluorescence in situ hybridization,FISH)测定阳性[9],乳房原发肿瘤反应根据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1版进行评估[10],疾病进展或稳定患者乳房原发肿瘤反应均为无反应,部分缓解为部分反应,完全缓解为完全反应。
ypN0的相关因素采用单因素分析法,将差异有统计学意义的因素纳入多因素分析,寻找ypN0的独立预测指标。
对350例患者先后进行Olga Kantor预测模型的验证及改良研究,其中验证模型以NAC前乳腺原发肿瘤超声影像大小与术后切除肿块大小对比作为乳房原发肿瘤反应的计算依据(同Olga Kantor预测模型),改良模型以NAC前后乳腺原发肿瘤超声影像大小作为计算依据。根据Olga Kantor预测模型计算验证及改良模型的模型分数(表1)[7]。
采用SPSS 19.0软件进行统计学分析,χ2检验及t检验评价ypN0的相关因素,P<0.05为差异有统计学意义。将差异有统计学意义的因素纳入多因素logistic回归分析。计算验证模型及改良模型的AUC评估预测模型的预测能力,Z检验评价两模型间AUC的差异。
在350例入组患者中,30.86%(108/350)的患者在NAC后达到ypN0。单因素分析结果表明,年龄、分子分型、Ki-67、组织学分级、临床乳房原发肿瘤反应、病理乳房原发肿瘤反应与ypN0差异有统计学意义(P均<0.05,表2)。分别将病理乳房原发肿瘤反应(验证模型)和临床乳房原发肿瘤反应(改良模型)作为乳房原发肿瘤反应的两种方法依次纳入logistic多因素分析,验证模型中年龄、分子分型、Ki-67及病理乳房原发肿瘤反应是NAC后腋窝ypN0的独立预测指标,改良模型中年龄(OR=7.469,95% CI:2.310~24.151)、分型分组及临床乳房原发肿瘤反应是NAC后腋窝ypN0的独立预测指标(P均<0.05,表3)。
验证模型及改良模型分数与达到ypN0的比例见表4,总体趋势见图1。Olga Kantor预测模型的总体趋势见图2。验证模型及改良模型AUC为0.788和0.782,差异无统计学意义(P=0.579,图3)。
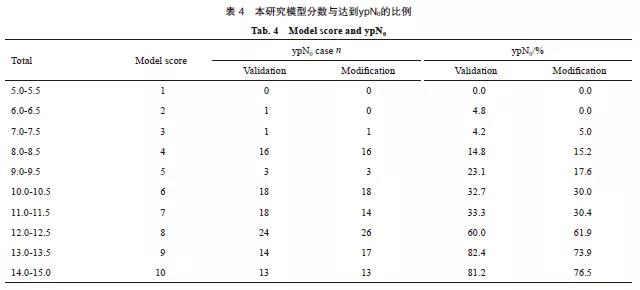
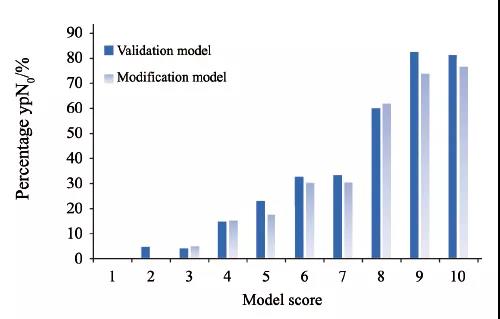
图 1 本研究总体趋势
Fig. 1 General trend in validation and modification model
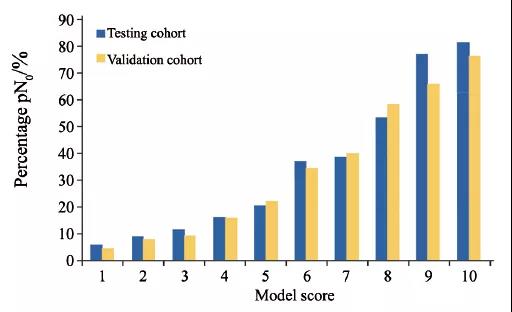
图 2 Olga Kantor预测模型总体趋势
Fig. 2 General trend in Olga Kantor predictive model
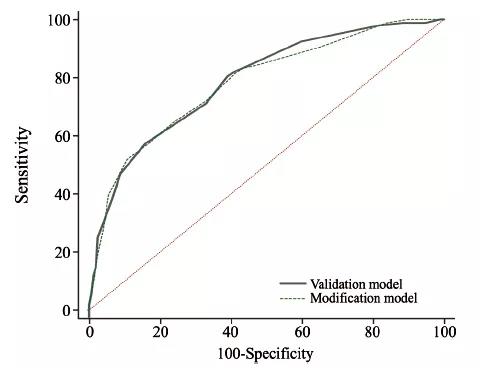
图 3 验证模型及改良模型ROC曲线
Fig. 3 ROC curve for validation and modification model
NAC目前是局部晚期乳腺癌患者的标准治疗模式[11]。而病理学完全缓解(pathological complete response,pCR)被认为是患者长期生存获益的指标,NAC后达到pCR的患者生存率得到显著改善[12]。研究证明,40%~75%的cN+患者NAC后可达pCR[13-15],这部分患者NAC后接受常规ALND会延长住院时间,医疗费用增加,手术并发症发生率增高。基于Sentina和ACOSOG 1071研究,NAC后SLNB已被纳入NCCN指南及St. Gallen专家共识[5-6]。但目前NAC后行SLNB的患者总体假阴性概率仍然较高。一方面可以通过改进SLNB的技术降低假阴性率,包括NAC前阳性淋巴结放置标志夹并于术中检出、使用双示踪剂、检出≥3枚SLN及对SLN进行免疫组织化学检测等[5-6,16];另一方面可以通过优化患者的选择方法来提高选择的灵敏度[7]。在理想情况下,外科医师能够预测哪些患者的化疗反应较好,并为NAC后SLNB选出最有可能在NAC后达到ypN0的患者。Olga Kantor预测模型旨在预测初始cN+患者NAC后达到ypN0的概率,通过对入组的患者(n=19 115)进行建模(n=13 396)及验证(n=5 719),得出年龄、肿瘤分子分型、肿瘤组织学级别、组织学类型以及初始腋窝淋巴结分期均为NAC后ypN0的独立预测指标。建模组和验证组的ROC曲线的AUC分别为0.781和0.788 [7]。该模型可以较为准确地预测初始cN+患者在NAC后达到ypN0的概率,得分高的患者更有可能在NAC后达到ypN0,更适合进行SLNB替代ALND,但作者认为此模型需要进一步地进行外部验证。
Olga Kantor预测模型的数据来源于美国国家癌症数据库(National Cancer Database,NCDB)[17],未记录NAC后乳房原发肿瘤影像学大小,因此该预测模型使用术后肿瘤病理大小代替此指标,计算其与术前影像大小的差别评价乳房原发肿瘤反应,不能于术前预测ypN0,存在临床使用的局限性。理想的预测模型应于NAC后手术前进行ypN0预测评价。本研究首先以NAC前原发肿瘤超声影像大小与术后病理大小对比作为乳房原发肿瘤反应的计算依据,验证Olga Kantor预测模型ypN0的独立预测指标及模型的预测效能;之后对该模型进行改良,以NAC前后原发肿瘤超声影像大小作为计算依据,分析改良模型ypN0的独立预测指标及预测效能。
本研究通过单因素分析及logistic回归分析发现年龄、分子分型及乳房原发肿瘤反应为ypN0的独立预测因素。与Olga Kantor预测模型相比,cN分期及病理分型在本研究中差异无统计学意义(P>0.05)。导致此差异的因素可能与本研究为单中心回顾性分析、样本量较小(n=350)有关。本研究对Olga Kantor模型预测的准确性进行验证,AUC为0.788,证实Olga Kantor预测模型在本中心具有较高的准确性。改良模型的AUC为0.782,与验证模型的AUC差异无统计学意义(P=0.579)。因此,改良模型具有同等的预测效能且更贴合临床实际。
Olga Kantor模型的其他局限性包括:NCDB数据库未记录患者NAC的方案、剂量及周期数,只要接受过NAC的患者均被纳入Olga Kantor模型,而本研究仅纳入接受足疗程含蒽环和(或)紫杉类药物方案NAC的患者;其次,Ki-67及月经状况等在Olga Kantor模型中未被分析,而本研究发现Ki-67标记指数为验证模型ypN0的独立预测指标。
Olga Kantor模型可为cN+患者NAC后进行SLNB提供一种可靠的选择方法。模型得分≤3分的患者ypN0概率为2.5%(1/40),推荐直接行ALND;得分4~7分的患者ypN0的概率为22.4%(51/228),可考虑行SLNB(NAC前在阳性淋巴结放置标记夹并于术中检出、使用双示踪剂及检出>2枚SLN以控制假阴性率);得分≥8分的患者ypN0的概率为68.3%(56/82),推荐直接行SLNB;值得注意的是,得分为10分患者ypN0的概率为76.5%(13/17),这部分患者未来甚至可以避免腋窝清扫术。目前SOUND[18]及ASICS临床试验已经开始对避免腋窝手术进行研究。但由于得分为10分的患者样本量小,因此是否能避免腋窝手术值得进一步研究。
综上所述,Olga Kantor预测模型可以较为准确地评估cN+患者ypN0概率,改良模型具有同等的预测效能且更贴合临床实际,有助于NAC后腋窝处理模式的合理选择。
王永胜. 乳腺癌前哨淋巴结活检: 共识与展望[J]. 中国普外基础与临床杂志, 2009, 16(7): 505-509.
MORROW M, DANG C T. Sentinel node biopsy after neoadjuvant chemotherapy: a new standard for patients with axillary metastases?[J]. JAMA, 2013, 310(14): 1449-1450.
KUEHN T, BAUERFEIND I, FEHM T, et al. Sentinel-lymph-node biopsy in patients with breast cancer before and after neoadjuvant chemotherapy (SENTINA): a prospective, multicentre cohort study[J]. Lancet Oncol, 2013, 14(7): 609-618.
BOUGHEY J C, SUMAN V J, MITTENDORF E A, et al. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial[J]. JAMA, 2013, 310(14): 1455-1461.
GRASISHAR W J, ANDRSON B O, BALASSANIAN R, et al. Breast cancer, Version 2. 2018 featured updates to the NCCN guidelines [EB/OL]. National Comprehensive Cancer Network. http://www. NCCN.org.
CURIGLIANO G, BURSTEIN H J, P WINER E, et al. De-escalating and escalating treatments for early-stage breast cancer: the St. Gallen international expert consensus conference on the primary therapy of early breast cancer 2017[J]. Ann Oncol, 2017, 28(8): 1700-1712.
KANTOR O, SIPSY L M, YAO K, et al. A predictive model for axillary node pathologic complete response after neoadjuvant chemotherapy for breast cancer[J]. Ann Surg Oncol, 2018, 25(5): 1304-1311.
《乳腺癌雌、孕激素受体免疫组织化学检测指南》项目组. 乳腺癌雌、孕激素受体免疫组织化学检测指南[J]. 中华病理学杂志, 2015, 44(4): 237-239.
《乳腺癌HER2检测指南(2014)》编写组. 乳腺癌HER2检测指南(2014)[J]. 中华病理学杂志, 2014, 43(4): 262-265.
EISENHAUER E A, THERASSE P, BOGAERTSS J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1) [J]. Eur J Cancer, 2009, 45(2): 228-247.
ERSOY Y E, KADIOGLU H. Review of novel sentinel lymph node biopsy techniques in breast cancer patients treated with neoadjuvant chemotherapy [J]. Clin Breast Cancer, 2018, 18(4): 555-559.
BONNEFOI H, LITIÈRE S, PICCART M, et al. Pathological complete response after neoadjuvant chemotherapy is an independent predictive factor irrespective of simplified breast cancer intrinsic subtypes: a landmark and two-step approach analyses from the EORTC 10994/BIG 1-00 phase Ⅲ trial [J]. Ann Oncol, 2014, 25(6): 1128-1136.
RESCIGNO J, ZAMPELL J C, AXELROD D. Patterns of axillary surgical care for breast cancer in the era of sentinel lymph node biopsy[J]. Ann Surg Oncol, 2009, 16(3): 687-696.
BUZDAR A U, IBRAHIM N K, FRANCIS D, et al. Significantly higher pathologic complete remission rate after neoadjuvant therapy with trastuzumab, paclitaxel, and epirubicin chemotherapy: results of a randomized trial in human epidermal growth factor receptor 2-positive operable breast cancer[J]. J Clin Oncol, 2005, 23(16): 3676-3685.
HENNESSY B T, HORTOBAGYI G N, ROUZIER R, et al. Outcome after pathologic complete eradication of cytologically proven breast cancer axillary node metastases following primary chemotherapy[J]. J Clin Oncol, 2005, 23(36): 9304-9311.
中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2017年版)[J].中国癌症杂志, 2017, 27(9): 695-759.
BILIMORIA K Y, STEWART A K, WINCHESTER D P, et al. The National Cancer Data Base: a powerful initiative to improve cancer care in the United States[J]. Ann Surg Oncol, 2008, 15(3): 683-690.
GENTILINI O, VERONESI U. Abandoning sentinel lymph node biopsy in early breast cancer? A new trial in progress at the European Institute of Oncology of Milan (SOUND: sentinel node vs observation after axillary ultrasound)[J]. Breast, 2012, 21(5): 678-681.



















共0条评论