[导读] 编译整理:强子
随着资讯的日渐发达,病理医师日常可能经常遇到临床同仁、甚至患者要求“做免疫组化”!但,且不说免疫组化是否可以解决所有问题,也不谈是否所有病例都需要免疫组化,仅就免疫组化这一检测手段来说,其结果会受到各种因素的影响。
免疫组化标记物方面,最为大众所熟知的可能要数乳腺癌相关标记物了,其中ER、PR、HER2等的检测“历史悠久”,且对临床诊疗具有显著指导意义。不过,即使这样相对成熟的标记物,其结果也会受到诸多因素的影响。有鉴于此,威斯康辛医学院(Medical College of Wisconsin)病理专家Julie M. Jorns在美国病理医师学会(College of American Pathologists,CAP)官方期刊《Archives of pathology & laboratory medicine》对乳腺癌标记物的部分问题进行了文献综述。为帮助大家更好的了解这些问题,我们将该文要点编译介绍如下。
概述
对于乳腺癌患者来说,雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、HER2/neu(HER2)状态具有预后及治疗意义早已是不争的事实。一般预后好、管腔A型的高分化浸润性癌ER/PR表达水平最高,多为弥漫、强阳性;相反,HER2阳性肿瘤则更具侵袭性,常为更高级别、更高增殖。不过,针对HER2的靶向治疗可以改善预后。需要注意的是,随着疾病进展,ER/PR及HER2也可以发生改变,因此CAP及美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)指南建议对于所有新确诊的原发、复发、转移性乳腺癌均应进行ER、PR、HER2检测。
目前对这些指标的检测方面,ER、PR一般为免疫组化评估蛋白表达;早期研究中有1%的着色即可视为阳性,因为当时的研究表明即使低水平表达也意味着无病生存方面较好,当然高表达者无病生存更佳。后续随着内分泌治疗的引入,低表达患者的获益不多,因此1%的判定阈值受到了质疑和挑战。
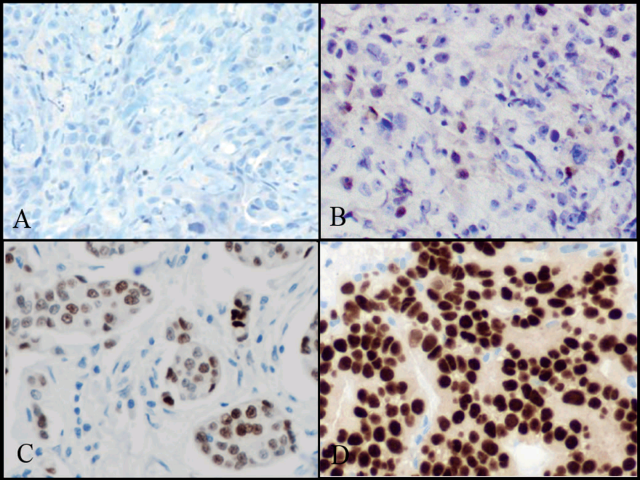
图1. 浸润性乳腺癌中不同结果的ER:(A)阴性,0%;(B)局灶阳性;(C)斑片状阳性;(D)弥漫阳性。
HER2可通过免疫组化来评估蛋白表达水平、和/或通过原位杂交来评估基因是否扩增。目前CAP/ASCO指南并未指定何种方案更好,只是对于结果不明确的情况下推荐用另一种方案验证。不过,免疫组化相对简便、且费用低。免疫组化检测HER2的结果为半定量,根据阳性结果的不同而分为0、1+、2+、3+;阳性肿瘤细胞比例的阈值为10%(具体如5%肿瘤细胞为连续的膜阳性着色,应判读为2+等细节问题,可参阅最新的相关指南)。
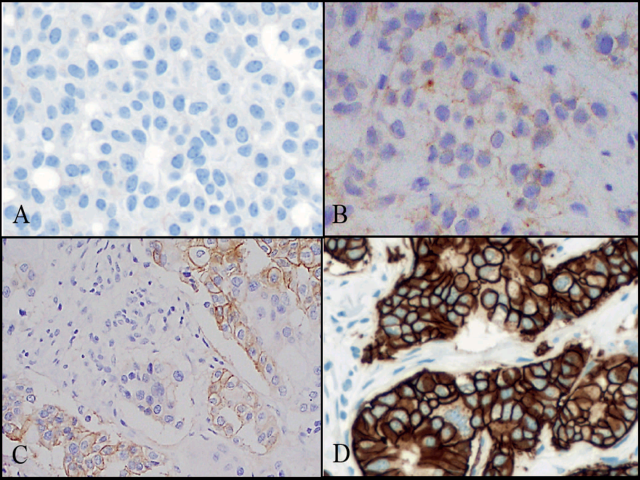
图2. 浸润性乳腺癌中HER2/neu免疫组化的不同结果:(A)0;(B)1+;(C)2+;(D)3+。
HER2的原位杂交检测可以用单探针,但大部分实验室均采用双探针。其具体判读结果请参阅相关指南。需要注意的是,按照最新指南,部分原位杂交检测结果需结合免疫组化结果才能得出明确为有扩增或无扩增的结论。尽管这样做看似麻烦,但却避免了结果不明确的情况出现。
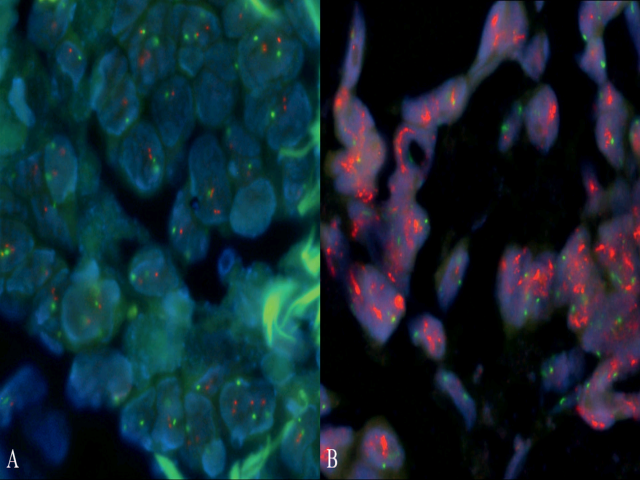
图3. HER2/neu原位杂交无扩增(A)及有扩增(B)实例。
检测前的影响因素
热缺血时间
热缺血是肿瘤血供中断、但尚处于体内温暖环境、相关酶类仍在发挥作用的状态。热缺血时间延长多见于手术困难而导致耗时增加的情况,也可见于肿瘤内部分快速增大而血供不及的情况。由于热缺血时间难以控制、难以测定,因此热缺血时间延长对肿瘤及相关标记物检测结果的影响还所知甚少。
冷缺血时间
冷缺血时间是指自肿瘤离体、直至进入福尔马林固定的时间。大部分研究均表明,固定延迟、或所谓冷缺血时间延长导致ER、PR、HER2阳性结果降低。对ER/PR而言,冷缺血时间延长导致假阴性更多见表现为表达水平降低。
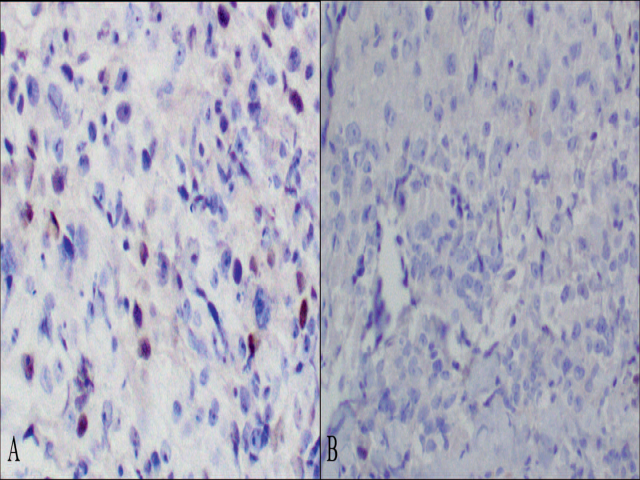
图4. 活检标本中,ER结果为低水平阳性(A),但切除标本中由于冷缺血时间超过8小时而表现为阴性(B)。
CAP/ASCO操作手册中强调,需记录冷缺血时间,并建议控制冷缺血时间在1小时以内。不过也有研究认为冷缺血时间在4小时内是可以接受的,尤其标本可以冷藏的情况下。
对于粗针穿刺活检标本而言,冷缺血时间一般是以分钟计算的,但最好也要记录这一时间以供质控。对切除标本来说,准确记录冷缺血时间需要知道标本离体时间、标本固定时间。当然,对于较大标本来说,标本进入固定液的时间并不代表标本固定时间,因为肿物周边可能会有正常乳腺组织,而福尔马林是缓慢渗透的。因此,对于可以迅速送检的单位来说,切开固定、或注射固定液固定可以缩短冷缺血时间。
固定
ER、PR、HER2的检测一般是指10%中性缓冲福尔马林固定液固定6-72小时、石蜡包埋切片,如果这些条件有所改变,必须至少做出明确记录。固定时间延长可导致生物标记物丢失从而得出假阴性结果;固定时间不足6小时也会有不一样的结果。
其他
有乳腺癌病史、和/或高度考虑乳腺癌转移的情况下,可能细胞学标本要更方便获取。因此酒精固定、风干细胞学标本对乳腺标记物检测结果的影响方面,近些年也有大量研究。脱钙剂会对原位杂交结果有显著不利影响,但对免疫组化结果不利影响相对小。对此有要求的同道可以自行查阅相关文献。
检测中的因素
进行ER、PR、HER2检测的实验室需达到相关认证要求。正式应用于临床前需对抗体及相关检测过程进行优化及验证。需通过内对照、外对照来确保检测质量,同时需参加外部能力检测来确保检测结果的精准、结果解读的精准。同时,需参考相关指南中检测结果阳性、阴性比例来确定自己实验室的结果是否可靠,当然具体需结合本实验室检测标本的组织学结果来解读。
对照
免疫组化检测ER/PR时,可用具体病例中的乳腺组织作为内对照;结果判读时需结合内对照、外对照结果,尤其结果为阴性时更是如此。如对照染色失败,则应重新检测。对某些特殊的高分化浸润性癌来说,ER、PR为阴性则要提出质疑并重复检测;当然,也可能需质疑组织学诊断。
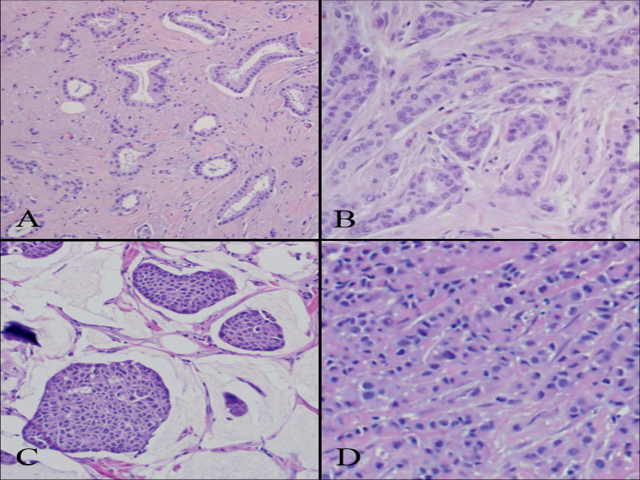
图5. 某些高分化浸润性癌几乎总是ER阳性,如小管癌(A)、导管癌(B)、黏液癌(C)、小叶癌(D)。
对于HER2检测来说,一般不像ER/PR那样有恰当的内对照,此时外对照则更加重要。需要注意的是,高级别导管原位癌常为HER2阳性,可作为阳性对照。不过,HER2的结果评估是对浸润性癌而言的。
某些特殊问题
多个肿瘤的检测问题
2010年版CAP/ASCO的ER/PR指南中,对于同时发生的多发肿瘤强调“至少对其中之一进行检测,推荐对最大的进行检测”。不过,组织学表现不同和/或级别不同的较小肿瘤也有必要进行检测。
切除标本再次检测问题
活检标本中一般可以可靠的判定ER、PR、HER2情况,并由此而指导临床治疗,比如是首选新辅助化疗、还是首先手术。不过,切除标本中重新检测的情况也相对常见。CAP/ASCO指南中提出适用于重新检测的情况有:生物学标记和组织学表现之间不一致,相关检测结果不明确,活检标本中无内对照等。如前所述,由于手术标本冷缺血时间延长等,可能会导致术后标本反而出现假阴性结果。不过,新辅助化疗后有肿瘤残余的情况下是否需对术后标本进行重新检测,应根据肿瘤特征(新辅助化疗前、与新辅助化疗后特征进行比较)、多学科讨论结果而定。需要注意的是,新辅助化疗后未达病理完全缓解的患者ER/PR和/或HER2结果出现反转者,有一定预后意义:转为三阴者总生存更差。
小结
ER、PR、HER2检测及结果对于乳腺癌患者的诊断及治疗意义重大!不过,某些因素如固定液的不同、冷缺血时间的延长、固定时间的延长或缩短,都会导致假阴性或不明确的结果。注重细节、遵循指南,有助于确保检测质量!
点击下载英文文献
参考文献
Breast Cancer Biomarkers: Challenges in Routine Estrogen Receptor, Progesterone Receptor, and HER2/neu Evaluation[J].Archives of pathology & laboratory medicine,2019.
DOI:10.5858/arpa.2019-0205-RA


















共0条评论