[导读] 【引用本文】黄 亮,蔡永华,张兴伟,等. 中低位直肠癌新辅助放化疗后病理完全缓解预测因素分析[J]. 中国实用外科杂志,2019,39(7):694-697.
摘要
目的 探讨预测中低位直肠癌新辅助放化疗后病理完全缓解(pCR)的临床因素。方法 回顾性分析2013年1月至2016年10月中山大学附属第六医院收治的行新辅助放化疗联合全直肠系膜切除手术治疗的185例进展期中低位直肠癌病人的临床病理资料,包括年龄、治疗前癌胚抗原(CEA)、病理类型及分期、新辅助化疗方案、放疗结束至手术间隔时间等。根据肿瘤治疗反应分为pCR组(49例)和non-pCR组(136例),计算pCR率并分析其影响因素。结果 术后49例(26.5%)病人达到pCR,103例病人病理学疗效分级为0或1,总降期率为55.8%。单因素分析显示,肿瘤T分期(P=0.004)和N分期(P=0.032)、治疗前CEA水平(P=0.039)、化疗方案(P=0.003)与pCR相关;多因素分析显示,T2分期和化疗方案中含有奥沙利铂是pCR的独立影响因素。结论 T2分期和以氟尿嘧啶为基础同时联合奥沙利铂的化疗方案是影响中低位直肠癌新辅助放化疗pCR的独立预测因素。
术前新辅助放化疗联合全直肠系膜切除(TME)已成为中低位进展期直肠癌的标准治疗方案[1]。相比术后放化疗,新辅助放化疗具有病人依从性好、局部复发率低,更好地保护器官功能,同时减轻治疗副反应的优势。文献报道,新辅助放化疗的病理完全缓解(pCR)率为13.0%~22.2%,pCR病人不仅对放化疗敏感,而且其远期生存也明显优于非pCR病人[2-4]。因此,直肠癌病人新辅助放化疗后pCR相关预测指标具有重要的临床指导价值。本文回顾性分析2013年1月至2016年10月中山大学附属第六医院收治的行新辅助放化疗+手术治疗的189例直肠癌病人的临床资料,通过分析pCR相关的临床病理指标,判断其预测价值,指导并优化中低位直肠癌病人的治疗方案。
1.资料与方法
1.1.研究对象 以初治可手术切除的Ⅱ~Ⅲ期直肠腺癌病人为对象。纳入标准:(1)签署知情同意书。(2)病理学检查诊断为直肠腺癌。(3)年龄18~75岁。(4)治疗前采用盆腔MRI或直肠超声检查分期。(5)Ⅱ期[T3~4,N0(N0定义为所有测量的淋巴结直径均<1.0 cm)]或者Ⅲ期[T1~4,N1~2(存在直径≥1.0 cm的淋巴结)]直肠癌。(6)通过指检或肠镜检查评价,病灶下端距肛缘<12 cm,并评估为可切除的病灶。(7)肿瘤病人体力状况(ECOG)评分为0~2分,未发现放化疗及手术禁忌证。(8)既往无其他恶性肿瘤病史,除外已治愈的皮肤基底细胞癌和宫颈原位癌。排除标准:存在远处不可切除的转移瘤;首诊未进行直肠MRI扫描或扫描失败;首诊肠镜病理学活组织检查证实为印戒细胞癌;未完成新辅助治疗。
共收治中低位局部进展期直肠癌病人189例,其中2例病人经新辅助治疗后拒绝手术,另有2例仅行局部切除而退出研究,最终纳入185例。其中男性122例,女性63例。年龄54(26~78)岁。所有病人均经多学科综合治疗协作组(MDT)讨论后制定方案,于新辅助治疗后4~12周内行根治性手术治疗,等待手术期间仍行规律新辅助化疗。
1.2.治疗
1.2.1 术前放疗方案 术前放疗采用三维放射(后方以及两侧)。放射野的上缘以L5或S1骶椎为标记,以会阴为下缘。前后方向照射野两侧范围为超出骨性盆腔1 cm,前缘为骶骨后方1 cm,后缘为股骨头中心。在肿瘤侵犯阴道、前列腺、膀胱等器官范围较广或怀疑前盆腔有淋巴结转移时采用二维照射。放疗予总剂量46 Gy,每日2 Gy。如果放疗过程中因副反应中断(2~3周),则给予额外的分割剂量(常为2次)。光子能量在10~16 MV。
1.2.2 术前化疗方案 根据化疗方案中有无奥沙利铂分为两种:(1)mFOLFOX6方案。奥沙利铂85 mg/m2静脉输注2 h,d1;亚叶酸钙400 mg/m2静脉输注2 h,d1;氟尿嘧啶(5-FU)400 mg/m2静脉推注,d1,然后2.4 g/m2 持续输注48 h。(2)De Gramont方案。亚叶酸钙400 mg/m2静脉输注2 h,d1;5-FU 400 mg/m2静脉推注,d1,然后5-FU 2.4 g/m2持续输注48 h。化疗与放疗同步进行,术后的化疗在手术后4~8周内进行。总化疗周期完成≥6个周期才能视为合格病例。
1.2.3 手术方案 规范实施TME,是否可行根治性切除须根据术中探查决定。首先,探查有无远处及腹膜转移。手术从原术野以外区域开始并遵循整块切除原则,不可进行分块切除。如显微镜下肿瘤切缘无癌细胞浸润为R0切除,有癌细胞浸润为R1切除,切缘有肉眼可见肿瘤浸润为R2切除。放疗与手术间隔时间为4~12周;化疗与手术的间隔时间为2~4周。
1.3 疗效评价 pCR定义为直肠癌新辅助放化疗后手术切除标本(包括清扫淋巴结)中显微镜下肿瘤细胞完全消失。手术切除标本由有经验的病理科医生采用第7版美国癌症联合委员会(AJCC)分期标准对肿瘤标本进行精确评估[5]。TRG0级:完全反应,肿瘤完全消退,无癌细胞残留;TRG1级:肿瘤中度消退,仅剩少量镜下癌灶;TRG2级:肿瘤轻度消退,可见残留癌细胞,但仍以纤维化为主要改变;TRG3级:肿瘤消退不良,残留大量的肿瘤细胞伴极少或无纤维化。
1.4 观察指标 共选择15项可能对pCR产生影响的临床病理相关指标,包括年龄,性别,治疗前癌胚抗原(CEA),治疗前CA19-9,治疗前T、N、TNM分期,肿瘤大小、距肛缘距离、环周大小、分化程度、环周切缘,放疗后等待时间,化疗方案,化疗疗程。
1.5 统计学处理 运用SPSS20.0软件进行数据分析,组间有效率比较采用χ2检验,多因素分析采用COX比例风险回归模型。P<0.05为差异有统计学意义。
2.结果
所有病人基线临床病理特征见表1。术前影像学证实淋巴结阳性病人155例(83.7%),肿瘤距肛缘距离为6(0~10)cm,放疗结束至手术中位间隔时间为50(25~105)d。所有病人均为R0切除,共有159例病人行保留肛门手术,保肛率85.9%。49例病人达到pCR(26.5%),103例病人病理学疗效分级为0或1,总降期率为55.8%。
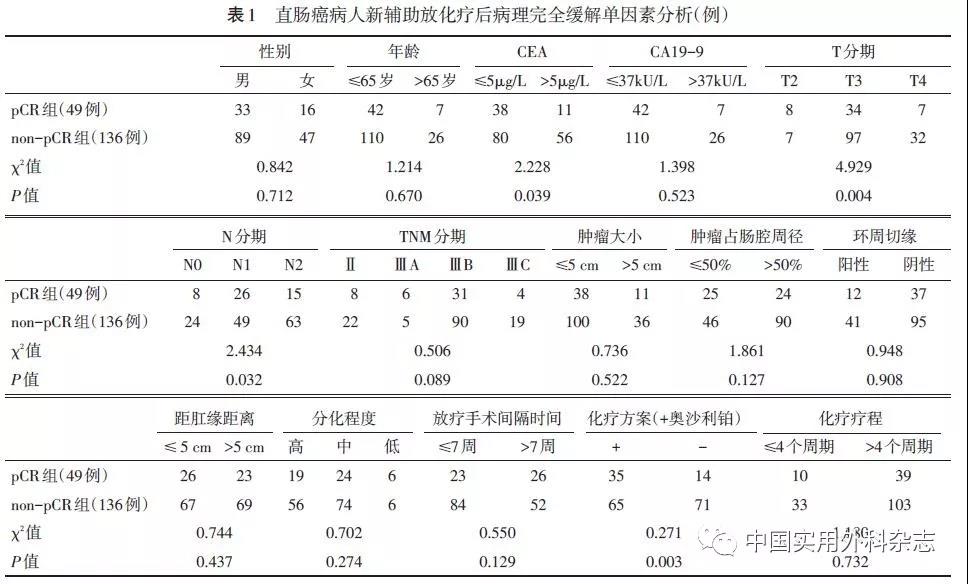
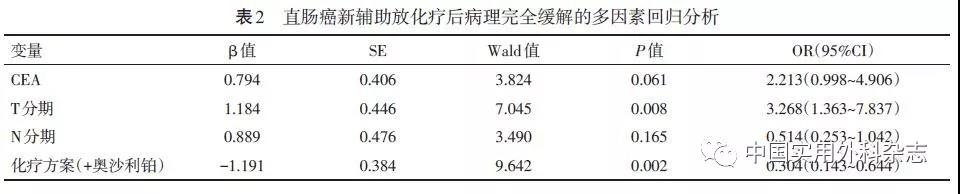
根据术后病理缓解情况将病人分为pCR组(49例)和非pCR组(136例)。单因素分析显示,术前CEA<5.0 μg/L(P=0.039)、原发灶T2(P=0.004)、N0(P=0.032)、化疗方案为mFOLFOX6(P=0.003)与新辅助放化疗后pCR相关(表1)。将上述4项因素纳入COX比例风险模型,多元回归分析显示,T分期及化疗方案是pCR的独立预测因素(表2),即:相比T3或T4期病人,T2期直肠癌病人更易获得pCR(53.3% vs. 24.1%,P=0.008);相比De Gramont化疗方案,联合奥沙利铂化疗的病人pCR率明显提高(35.0% vs. 16.5%,P=0.002)。T分期与pCR率呈负相关关系(T2:53.3%、T3:25.9%、T4:17.9%,R=-0.172,P=0.019)。
3.讨论
近年的研究表明,新辅助放化疗后pCR与病人无病生存和远期生存直接相关。因此,关于进展期直肠癌病人新辅助放化疗后pCR的预测是临床研究的热点[2-4]。临床上,对于ypT0N0病人,可选择局部切除或等待观察,从而避免根治性手术[6]。并且pCR病人术后辅助化疗也可调整,避免过度治疗[7-8]。Peng等[9]认为pCR与多个因素相关,如术前临床特点、影像学指标和病理学因素。本研究结果显示,直肠肿瘤T2分期和联合奥沙利铂化疗方案是pCR的独立预测因素。文献报道直肠癌新辅助治疗pCR率为13.0%~22.2%[2-4],本研究中T2分期病人仅为8.1%
(15/185),而pCR率高达26.5%,这可能与本研究化疗方案中联合奥沙利铂的病人所占比例较高(54.1% vs. 45.9%)有关。
多项临床研究已证实了5-FU类药物在直肠癌新辅助治疗中的重要作用,但对于化疗方案中联合奥沙利铂是否能进一步增强疗效、提高pCR率并改善预后,目前仍有争议。Allegra等[10]采用随机对照方法比较两种新辅助化疗方案,发现含或不含奥沙利铂治疗方案的3个终点指标:肿瘤局部控制率(11.3% vs. 12.1%)、无病存活率(69.2% vs. 64.2%)和总存活率(81.3% vs. 79.1%)差异均无统计学意义。而FOWARC研究在观察奥沙利铂在局部进展期中低位直肠癌新辅助治疗中应用效果时,证明了mFOLFOX6化疗联合放疗方案具有更高的pCR率,并同时降低了直肠癌肝转移的风险[11]。这与本研究结果一致。这可能是由于本研究和FOWARC研究均采用了mFOLFOX6方案,将奥沙利铂剂量提高到85 mg/m2。而Allegra等[10]则采用奥沙利铂(50~60 mg/m2)单周方案,持续给药亦可能增加副反应,导致部分病人难以耐受。因此,对于化疗耐受性较好且对局部控制要求较高的进展期直肠癌病人,可考虑在新辅助化疗方案中联合奥沙利铂。
既往研究发现,肿瘤大小与放化疗敏感性相关,而肿瘤T分期又与肿瘤大小相关[12-13]。Rodel等[14]发现,进展期直肠癌病人中,25%(4/16)的T2期病人达到pCR,而T3期病人仅10.1%(27/268)获得pCR,T4期病人无pCR。Peng等[9]发现,相比于T4期,T1~T3期病人有更高的pCR率(34.4% vs. 21.1%)。同样,本研究亦发现,T分期与pCR率负相关(T2:53.3%,T3:25.9%,T4:17.9%,R=-0.172,P=0.019),故笔者推测肿瘤T分期越晚,肿瘤负荷则越大,达到pCR所需要的对应化疗疗程和放疗剂量也相应增加。
多个研究发现,术前实验室检查,中性粒细胞与淋巴细胞比、治疗前CEA与pCR相关。CEA检测不仅简便易行,并且可预测复发转移以及监测治疗效果[15-17]。Moureau-Zabotto等[18]报道,相比于CEA水平较高的病人,治疗前低CEA者有更好的pCR率。然而,并非所有的研究均支持这一结论。相反,Kalady等[19]发现CEA<5 μg/L和pCR并不相关。本研究中,单因素分析显示pCR组病人术前CEA水平偏低,虽然多因素分析无统计学意义,但术前CEA水平低的病人仍具有更高的pCR率(32.2% vs.16.4%,P=0.061),但这也可能与病例数偏少有关。
综上所述,治疗前T2分期以及奥沙利铂+5-FU类药物的新辅助化疗方案配合术前同步放疗可以使进展期中低位直肠癌病人获得更好的pCR率,是新辅助放化疗后pCR的独立预测因素。
(参考文献略)















共0条评论