[导读] 来源:生物探索
作为一种经典的实验技术,免疫组化(IHC)已成为实验达人的必备技能之一。IHC的实验流程和方法并不难,但在实验过程中存在许多变量,容易遇到各种问题,因此,想要做出漂亮的实验结果并非易事,正所谓“细节决定成败”。下面小编将简单介绍IHC的相关知识及在实验过程中经常遇到的问题和应对策略,从此,让成败与细节Say“拜拜”!
免疫组化(IHC)检测原理?
那么什么是免疫组化检测?它的检测原理是什么?在进行深度剖析前,一些重要知识需要了解一下。免疫组化检测即抗原-抗体的特异性结合反应以及显色反应。通过化学反应使标记抗体的显色剂(荧光素、同位素、酶等)显色来检测组织切片中的抗原,从而对其进行定位、定性和定量。
显色常用的酶为辣根过氧化物酶(HRP),常用的显色底物为DAB(3,3’-二氨基联苯胺),偶尔用AEC(3-氨基-9-乙基咔唑)。碱性磷酸酶(AP或AKP)也是目前免疫诊断试剂最常用的标记酶之一,稳定性好、灵敏度高。
表1. 免疫组化(IHC)显色系统的选择

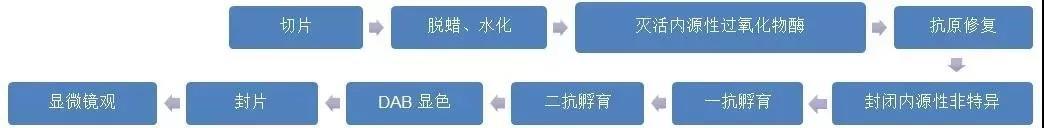
石蜡切片免疫组化(IHC)实验流程
那么,怎样做出漂亮的染色结果呢?小伙伴们,莫急!为了有一个全局概念,我们先来看一下石蜡切片免疫组化的实验流程吧!每一步都存在许多决定成败的小细节,它们可以是陷阱,也可以是获得好的实验结果的基石。
脱蜡水化不充分
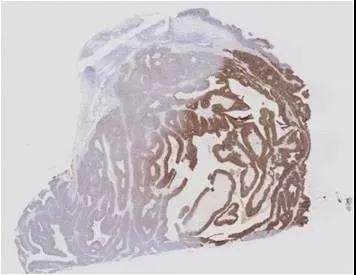
脱蜡水化的目的是使组织恢复到固定后的状态,暴露抗原以便与一抗结合。通常用二甲苯或二甲苯替代物脱蜡,再用乙醇梯度洗脱二甲苯。若脱蜡和水化不全会引起染色不均匀(如下图)、产生非特异性背景着色等问题。脱蜡不足是免疫组化失败的最常见原因,原则上要彻底、完全脱去切片上的蜡。
内源性过氧化物酶
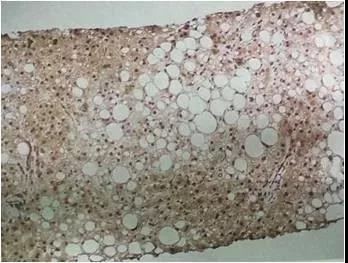
许多组织中存在内源性过氧化物酶,它通过与DAB结合而着色。在一抗孵育前,一般用3%H2O2灭活约10~20min,避免内源性过氧化物酶造成假阳性结果。H2O2需现用现配,且4℃避光保存,否则易引起非特异背景(如下图)。H2O2孵育时间过长也会易引起脱片。部分组织还含有内源性碱性磷酸酶,可用左旋咪唑进行灭活。
抗原修复
由于组织在甲醛或多聚甲醛固定过程中,会发生蛋白之间交联及醛基的封闭作用,从而掩盖抗原决定簇、失去抗原性。通过抗原修复,可以使细胞内的抗原决定簇重新暴露,提高抗原检测率。抗原修复技术通常分为蛋白酶诱导的表位修复(PIER)和热诱导的表位修复(HIER)两大类。
在PIER方法中,蛋白酶K、胰蛋白酶、糜蛋白酶和胃蛋白酶等蛋白水解酶可以使隐藏的抗原表位暴露,恢复其与抗体的结合。PIER的缺点在于恢复免疫反应性的成功率低,且有可能破坏组织形态和目的抗原。因此,需要选择性使用,严格控制浓度和作用时间。
HIER是在脱蜡入水后,将组织切片浸没在抗原修复液中并加热。修复液的主要成分为柠檬酸盐、三羟甲基氨基甲烷、去垢剂和螯合剂。最常用的修复液为pH 6~10的柠檬酸盐溶液和EDTA溶液。HIER对时间、温度、缓冲液和pH特别敏感,精确控制温度和时间是达到最佳修复的关键。总体来说,HIER的成功率比PIER高得多。
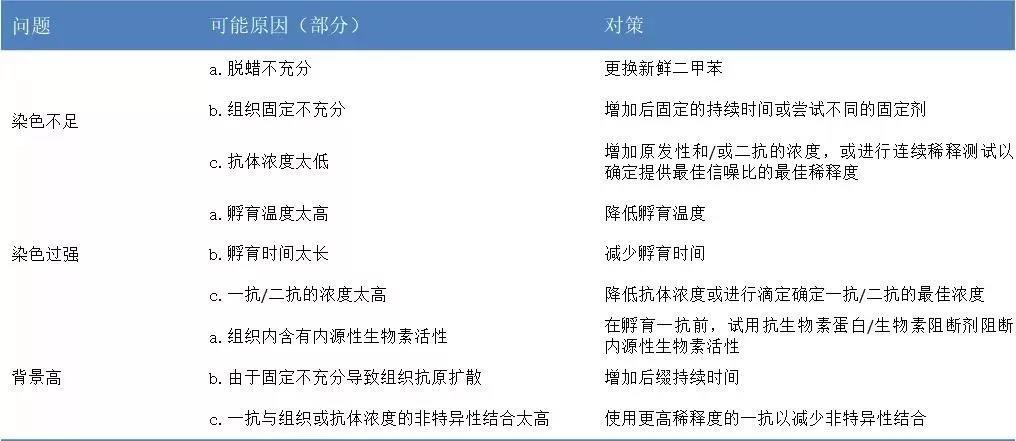
免疫组化染色的常见问题(部分)及对策
免疫组化(IHC)中存在的细节性问题“千千万”,每一种都有可能影响实验的成败,这里我们仅简单列举几种免疫组化染色中常见的问题和解决方法,如果想了解更多关于IHC的相关问题,可以持续关注我们。
表2.免疫组化(IHC)染色的常见问题(部分)及对策


















共0条评论