[导读] 乳腺癌术后的病理报告是病历中最重要的部分之一,也是确定乳腺癌诊断的唯一标准。根据这份报告,姐妹们可以了解到以下知识:
乳腺肿物究竟是良性还是恶性的:这决定了后续的手术类型是局部切除还是扩大范围。

图片来源:摄图网
免疫组化结果非常重要,根据免疫组化结果,我们可以了解乳腺癌的分子亚型,从而使治疗更有针对性。
可以说是现阶段临床治疗方法的选择、患者病情的评估,很大程度上要依靠免疫组化结果的。
免疫组化是什么?
免疫组化,通俗的含义就是把乳腺癌组织中的癌细胞放大到分子级别,看看在这个水平上有哪些跟别的细胞不一样的特征,比如说:有的癌细胞表面会表达一些别的细胞没有的受体蛋白,有的癌细胞所产生的某种蛋白比正常细胞多出很多倍,等等。
举个通俗易懂的比喻,我们对抓到的罪犯进行搜身,看看他们身上都有哪些特征,可能有的身上只拿了一把刀,有的身上拿着定时炸弹。如果癌细胞相当于人体组织中的罪犯,那么免疫组化的标记物则相当于罪犯身上的刀子、炸弹等,很显然拿炸弹的那类罪犯肯定比拿刀子的更危险一些。另外,还可以培训警犬来识别这些罪犯身上特殊物品,让它们帮助我们在更多人群中找到甚至剿灭罪犯——从而治疗肿瘤。
那么,对乳腺癌细胞而言,最重要的免疫组化标记物都哪些呢?这些免疫组化指标又都有些什么含义呢?
最常用的乳腺癌免疫组化标记物
ER、PR与激素依赖性乳腺癌
ER:雌激素受体
ER(+),阳性提示可以口服药物内分泌治疗,加号越多越好。而ER(-)阴性则说明内分泌治疗可能是无效的。
PR:孕激素受体
PR(+)阳性与ER(+)的指导意义相似,也提示可以口服药物内分泌治疗,加号也是越多越好。而PR(-)阴性说明内分泌治疗可能无效。
图片来源:摄图网
实际上,正常乳腺上皮细胞内依然存在ER、PR表达。当细胞发生癌变时,ER和PR出现部分和全部缺失。如果细胞仍保留ER和(或)PR阳性,代表该乳腺癌细胞的生长和增殖仍然受内分泌的调控,称为激素依赖性乳腺癌。
如果ER和(或)PR缺失,则该乳腺癌细胞的生长和增殖不再受内分泌的调控,称为非激素依赖性乳腺癌。
当ER、PR两者同时(+)则预后最好,可以术后或术前使用内分泌治疗。
如果一个阳性一个阴性,雌激素阳性(ER+)要好于孕激素阳性(PR+)。而且内分泌治疗依然有效。
但若两者都是阴性(-)则说明不受激素调控,那么预后最差——这类罪犯没有弱点、不受控制。
Her-2与乳腺癌靶向治疗
人表皮生长因子受体2(HER2),这个指标在免疫组化领域也表示为C-erbB2。
Her-2(-),为乳腺癌组织Her-2
Her-2(+),也就是1个加号,为乳腺癌Her-2轻度表达;
Her-2(+++),也就是3个加号,的乳腺癌组织为HER2过度表达。
介于之间的Her-2(++),也就是2个加号,则称之为乳腺癌组织Her-2中度表达,这类情况比较复杂,需进一步做分子检测,如荧光原位杂交法(FISH)的方法证实Her-2的基因是否存在扩增,如果FISH阳性,就可以确认存在Her-2过表达。
Her-2(-)与Her-2(+)的乳腺癌不需要使用靶向治疗药物(常用为赫赛汀),而Her-2过度表达的乳腺癌则可以选用靶向治疗药物,如赫赛汀等作为一线或二线治疗药物。
Ki-67:肿瘤细胞表达越低越好

图片来源:摄图网
乳腺癌也分A、B、C型
治疗方法大不一样!
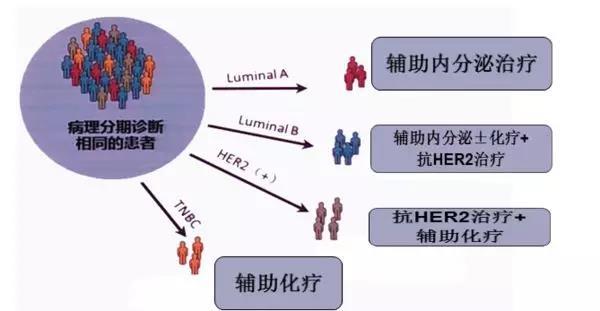
在乳腺癌中,联合Ki67指数高低与ER、PR阳性与否,可以对乳腺癌做更细的分类:
Luminal A型
ER和(或)PR阳性,Her-2阴性,Ki-67低表达(<14%)
这一亚型几乎不需要化疗,单纯内分泌治疗能达到很好的效果。但要结合临床分期,如淋巴结状况及其他危险因素等综合而定。
Luminal B型(含Her-2过表达者)
这类亚型一般要选择多种方法的综合治疗方案。
因为存在激素受体的阳性表达,所以内分泌治疗在一定程度上是有效的。但不可避免需要使用其他化疗药物进行辅助,如细胞毒性治疗(紫杉醇、吉西他滨、环磷酰胺、顺铂等)。
若存在Her-2过表达,则可以使用赫赛汀等靶向药治疗。
三阴乳腺癌(TNBC)
ER(-)和PR(-)Her-2(-),Ki67高表达(≥14%)。这类乳腺癌不适用内分泌治疗,且预后相对不好。
“三阴乳腺癌”患者和“基底样”患者有近80%的重合,但前者还包含一些特殊组织学类型,如低危(典型)髓样癌及腺样囊性癌。可用基底角蛋白染色有助于判定真正的“基底样”肿瘤。
这类患者没有可用的靶向药,且内分泌治疗常常是无效的,此时可使用细胞毒性治疗(紫杉醇、吉西他滨、环磷酰胺、顺铂等)化疗方案进行治疗。
小总结
图片来源:摄图网
ER(+)和(或)PR(+)阳性可以内分泌治疗,且预后相对好。
Her-2过表达:(+++)和部分FISH检测为基因扩增的(++),预后相对不好,但条件允许的情况下最好使用靶向治疗药物(赫赛汀)。
最后,Ki67表达越低越好。

















共0条评论