[导读] 感谢陈世昌老师提供
1.简介
程序性死亡1(PD-1)和程序性死亡 - 配体1(PD-L1)靶向单克隆抗体的免疫疗法极大地改变了几种类型恶性肿瘤的治疗和预后。 PD-1是存在于活化的T细胞和B细胞表面上的受体,并与其配体PD-L1和编程的死亡配体2(PD-L2)结合。 PD-L1存在于许多正常组织中,包括胎盘,血管内皮,上皮,肌肉,胰岛细胞,以及其他细胞类型中的B细胞,T细胞和巨噬细胞[ 1]]。 PD-1与PD-L1的结合诱导了抑制T淋巴细胞的细胞毒性/溶细胞效应功能的途径,该过程也称为T细胞耗竭。这是对局部炎症的一种重要的自我调节反应,使得局部组织不会像免疫反应中的旁观者那样受到损害[ 2 ]。 PD-L1也在肿瘤细胞表面表达,其中一些已发现上调PD-L1表达的方法,导致宿主免疫应答的抑制和对肿瘤的耐受性。因此理论上遵循抑制PD-1 / PD-L1途径将“释放断裂”并诱导免疫系统攻击肿瘤细胞。最终目标是提高总体存活率,这已经在多个疾病部位的多个临床试验中得到证实。
免疫检查点抑制剂首先被批准用于黑素瘤,特别是ipilimumab(细胞毒性T淋巴细胞抗原4抑制剂,Bristol-Myers Squibb),于2011年3月获得FDA批准。 2014年9月,第一种抗PD-1抗体,pembrolizumab(Merck)为美国FDA批准用于转移性黑色素瘤。从那时起,针对PD-1或PD-L1的治疗性单克隆抗体已被FDA批准用于非小细胞肺癌(NSCLC),肾细胞癌,膀胱癌,头颈癌,Merkel细胞癌,霍奇金淋巴瘤,胃癌,肝细胞癌和微卫星不稳定性高- 无论组织学如何,其他疾病都有待批准。有趣的是,多种癌症类型的早期研究显示,用抗PD-1抗体治疗的患者的结果有所改善,其抗肿瘤被发现具有PD-L1表达,促使进一步研究PD-L1作为PD-1应答的预测生物标志物,尽管PD- 1具有多个其他配体。在多种癌症类型的nivolumab(抗PD-1抗体,Bristol-Myers Squibb)的1期研究中,使用鼠抗人PD-L1单克隆抗体5H1来评估来自42名患者的治疗前肿瘤标本。在该研究中,PD-L1阳性由5%或更多的肿瘤细胞定义。 17例PD-L1阴性肿瘤患者均无客观反应,25例(35%)PD-L1阳性肿瘤患者中有9例有反应(P-0.006)[ 3]]。在I期nivolumab试验中评估来自黑素瘤,NSCLC,肾细胞癌,结肠直肠癌或前列腺癌患者的免疫组织化学(IHC)特征的组,包括PD-1,PD-L1和PD-L2表达,以及模式对免疫细胞浸润和淋巴细胞亚群进行评估,对41例治疗前肿瘤标本进行评估,发现其评价特征为肿瘤PD-L1表达与抗PD-1治疗的客观反应最相关[ 4 ]。 PD-L1单克隆抗体5H1再次用于该研究[ 4],但后来放弃了有利于Dako使用兔抗人克隆28-8开发的商业化验。
在美国食品和药物管理局注册了四种PD-L1 IHC检测方法,在两种不同的IHC平台(Dako和Ventana)上使用四种不同的PD-L1抗体(22C3,28-8,SP263,SP142 ),每种平台都有自己的评分系统。对于每种可用的PD-1和PD-L1抑制剂,已经批准了不同的抗体克隆和平台,使得试验之间的比较变得困难。本综述将重点关注导致PD-1和PD-L1抑制剂在NSCLC中获得批准的试验,特别关注PD-L1表达如何与PD-L1状态的确定和患者的细化相关的反应和评价相关。选择PD-1 / PD-L1定向治疗。我们还将讨论评估测定的可互换性的协调研究以及对免疫疗法的反应的潜在替代生物标志物。
2. PD-1抑制剂
Pembrolizumab(抗PD-1抗体,Merck)和nivolumab被FDA批准用于先前治疗的转移性NSCLC,并且pembrolizumab也被FDA批准用于PD-L1表达大于50%的患者的一线设置和无论PD-L1状态如何,在一线设置中与卡铂/培美曲塞联合使用。
2.1二线治疗
2.1.1 Nivolumab
CheckMate 017,nivolumab与多西紫杉醇在先前治疗的鳞状NSCLC中的3期试验,使用自动化IHC测定法评估PD-L1 [Dako]和兔单克隆抗人PD-L1抗体,克隆28-8 [Epitomics ],样品分类当在预先指定的表达水平为1%,5%或10%时观察到肿瘤细胞膜的染色时为阳性[ 5 ](参见表1)。无论PD-L1状态如何,患者均观察到相似的客观反应率,PD-L1表达既不是预后也不是任何有效终点的预测[ 5]]。相反,在Checkmate 057中,使用28-8克隆和Dako IHC的先前治疗的非鳞状NSCLC中nivolumab的3期试验,使用nivolumab治疗的PD-L1阳性患者有一个优势,整体中位数几乎翻倍与多西紫杉醇相比,用nivolumab治疗的PD-L1阳性率至少为1%的患者的生存率(OS)[ 6 ]。在观察PD-L1阴性的患者时,nivolumab和多西紫杉醇组之间的OS没有显著差异[ 6]]。作者得出结论,尽管nivolumab和多西紫杉醇在非鳞状PD-L1阴性患者中与多西紫杉醇相比OS没有改善,但nivolumab仍然是一种合理的治疗选择,因为它具有改善的安全性,并且当它们确实发生时反应的持久性[ 6 ] 。实际上,无论PD-L1表达如何,nivolumab都被FDA批准用于二线环境中的转移性NSCLC。 CheckMate 017和CheckMate 057的2年更新证实,非鳞状NSCLC患者的PD-L1阳性和用nivolumab治疗的益处更大; 而鳞状NSCLC患者的PD-L1表达既不是预测性的,也不是预后性的[ 7]。 pembrolizumab KEYNOTE试验不包括通过组织学观察PD-L1阳性和反应的亚组分析数据。
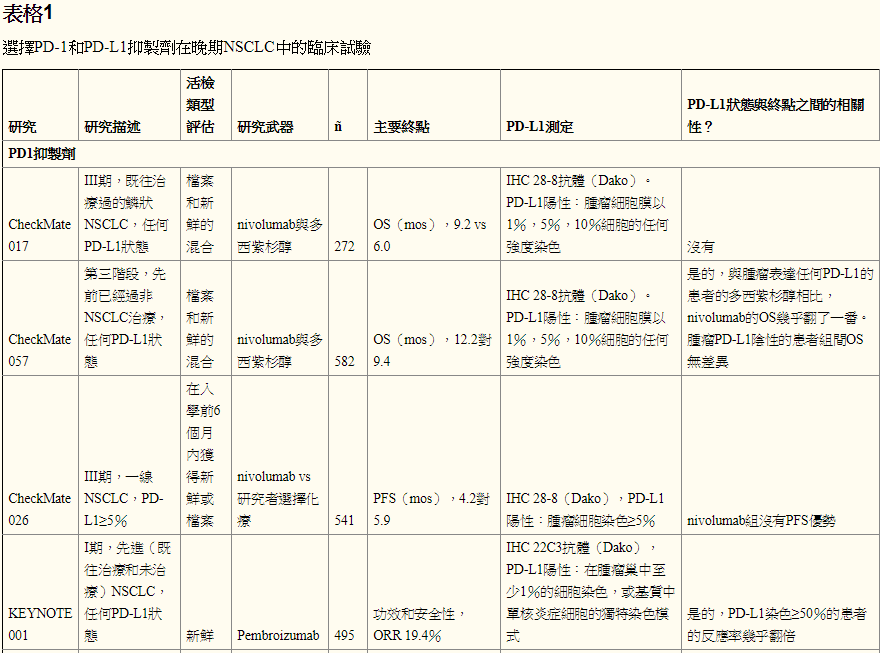
pembrolizumab治疗晚期NSCLC的阶段1b研究KEYNOTE 001使用抗PD-L1抗体克隆22C3 [Merck]评估不同水平的PD-L1表达,膜染色定义的阳性率至少为1%肿瘤巢内的细胞[ 8]。 PD-L1染色至少50%与pembrolizumab的疗效改善相关[ 8 ]。根据KEYNOTE 001的数据,2015年10月,pembrolizumab被FDA批准用于转移性NSCLC患者,这些患者在一线治疗后进展,PD-L1阳性肿瘤使用伴随诊断PD进行1%染色评估-L1 IHC 22C3 pharmDx测试。来自KEYNOTE 001的长期随访数据显示OS随着PD-L1肿瘤比例评分的增加而增加[ 9]。在pembrolizumab与多西紫杉醇,KEYNOTE 010的2/3期试验中,所有患者的PD-L1表达至少1%的肿瘤细胞,使用22C3抗体和Dako IHC评估[ 10 ]。在一般患者人群中,与多西紫杉醇相比,pembrolizumab治疗患者的OS明显更长[ 10]。对于PD-L1染色至少50%的患者亚组具有显著更长的OS与pembrolizumab与多西紫杉醇相比,以及显著更长的无进展存活(PFS)[ 10 ]。 KEYNOTE 010数据通过不同水平的PD-L1表达进一步分析,染色分别为1%-24%,25%-49%,50%-74%和大于或等于75%[ 11]]。在用pembrolizumab治疗的患者中,OS,PFS和客观缓解率(ORR)通常随着PD-L1表达的增加而增加,PD-L1表达的患者中最长的OS和PFS以及最高的ORR大于或等于75肿瘤细胞的百分比[ 11 ]
2.2一线治疗
2.2.1 Nivolumab
在CheckMate 012中,在第一线设置中进行nivolumab的1期多线试验,使用经验证的IHC测定[Dako]和28-8克隆评估PD-L1表达,阳性定义为肿瘤细胞的至少1% [ 12 ]。在使用组合nivolumab和铂类双联化疗治疗的患者队列中,PD-L1表达与OS或PFS之间没有关联,在PD-L1表达水平上观察到相同的反应[ 12 ]。在使用nivolumab单药治疗的患者队列中,无论PD-L1表达如何,均观察到临床活性,PD-L1表达较高的患者的ORR较高[ 13]]。然而,在第一线设置中nivolumab的3期试验CheckMate 026证明,即使在PD-L1表达超过5%的患者中,nivolumab和化疗组之间的PFS也没有差异[ 14 ] [ 15 ] .Nivolumab is未在第一线设置中获得FDA批准。
2.2.2 Pembrolizumab
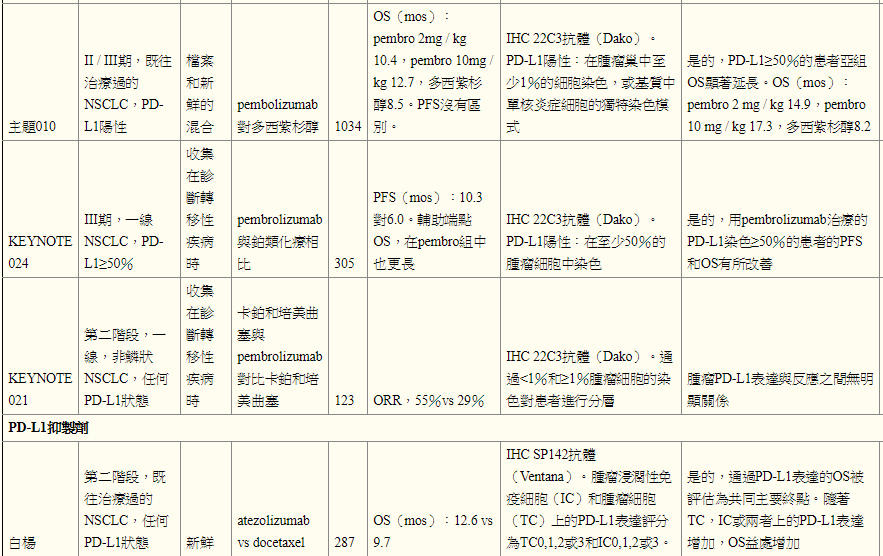
在一线环境中的3期试验中,通过22C3 pharmDx IHC检测评估,pembrolizumab与PD-L1表达超过50%的患者的铂类化疗相比,显著改善OS和PFS [Dako] [ 16 ]。作为该试验的结果,2016年10月,pembrolizumab在一线治疗中被批准用于PD-L1表达超过50%的患者。可以假设第一线pembrolizumab试验满足其主要终点而不是第一线nivolumab试验的差异与患者选择有关。
在卡铂和培美曲塞用或不用pembrolizumab治疗第一线非鳞状NSCLC的2期研究中,ORR的主要终点存在差异,pembrolizumab和化疗组为55%,化疗组为29%组和PFS的差异,13.0个月对8.9个月[ 17]。探索性分析发现,无论PD-L1表达如何,ORR的发生率相似[ 17]。这些数据表明,将细胞毒性疗法与PD1 / PD-L1抑制剂相结合的效果高于单独化疗。作为该试验的结果,pembrolizumab与卡铂/培美曲塞联合使用于2017年5月被美国FDA批准用于一线治疗中的转移性非鳞状NSCLC,而不管肿瘤PD-L1表达。正在进行验证性III期临床试验。
3. PD-L1抑制剂
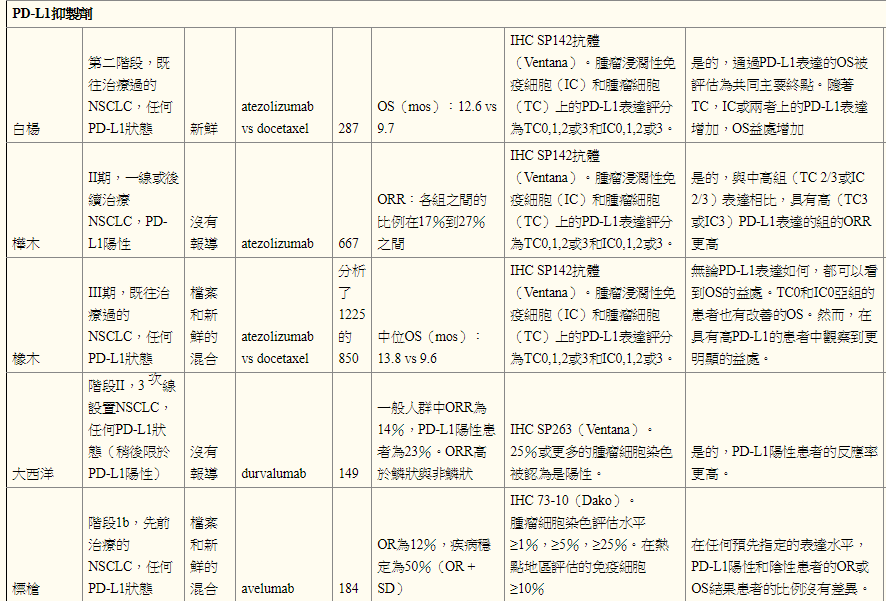
Atezolizumab是一种人源化IgG1单克隆抗PD-L1抗体[F Hoffmann-La Roche / Genentech],根据两项国际随机试验的结果,FDA批准用于既往治疗的转移性NSCLC,无论PD-L1状态如何, POPLAR和OAK。在POPLAR中,使用Ventana SP142 IHC测定法[Ventana Medical Systems,Tucson,AZ,USA] [ 18 ] 评估了atezolizumab与多西紫杉醇相比的2期研究,PD-L1在肿瘤和肿瘤浸润性免疫细胞中的表达。表达PD-L1的肿瘤细胞被评分为总肿瘤细胞的百分比(TC3≥50%,TC2≥5%且<50%,TC1≥1%且<5%,TC0<1%)和肿瘤浸润免疫细胞评分为肿瘤面积百分比(IC3≥10%,IC2≥5%且<10%,IC1≥1%且<5%,IC0<1%)[ 18]]。使用atezolizumab治疗的患者有OS益处,并且OS的改善与肿瘤细胞和肿瘤浸润性免疫细胞上的PD-L1 IHC表达相关[ 18 ]。在atezolizumab组中患有TC0和IC0 PD-L1状态的患者的OS与多西紫杉醇组相似[ 18 ]。 POPLAR的长期随访显示,几乎在PD-L1表达的每个亚组中,atezolizumab组与多西紫杉醇的中位OS均有改善,除了中位OS相同的TC0和IC0组[ 19 ]。在OAK,atezolizumab与多西紫杉醇的3期试验中,使用atezolizumab治疗的患者有OS优势,中位OS为13.8 vs 9.6个月[ 20]。无论PD-L1表达如何,甚至在PD-L1表达低于1%的患者中也观察到这种益处,与多西紫杉醇相比,使用atezolizumab的总生存率提高了25%[ 21 ]。使用Ventana SP142测定法评估肿瘤细胞和肿瘤浸润细胞的PD-L1表达[ 20 ]。
Avelumab [Pfizer]是人IgG1单克隆抗体PD-L1抑制剂。在1b期试验(JAVELIN实体瘤)研究先前治疗过的转移性或复发性NSCLC患者中的avelumab时,使用Dako试验用兔单克隆抗体克隆73-10评估肿瘤和免疫细胞上的PD-L1表达[ 22 ]。在预定的≥1%,≥5%,≥25%的水平评估肿瘤细胞染色。认为免疫细胞在PD-L1染色阳性≥10%,并在热点评估[ 22 ]。在任何预先指定的表达水平下,PD-L1阳性和阴性患者的客观反应和OS结果患者比例均不同[ 22 ]。
Durvalumab [Astra Zeneca],前身为MEDI4736,是人IgG1单克隆抗体PD-L1抑制剂。对于转移性NSCLC患者,三线设置的1/2期数据显示一般人群的ORR为14%,PD-L1阳性患者的ORR为23%[ 23]。使用SP263测定评估PD-L1,阳性定义为25%或更多肿瘤细胞的染色。有趣的是,鳞状细胞癌(21%)的ORR高于非鳞状(10%)患者[ 23 ]。
在PD-1 / PD-L1和细胞毒性T淋巴细胞相关蛋白4(CTLA-4)抗体的大多数已完成的联合免疫治疗研究中,PD-L1表达似乎与晚期NSCLC患者的结果无关。在pembrolizumab加ipilimumab(KEYNOTE 021,队列D和H)的1/2期研究中,由22C3抗体和ORR或中位OS确定的PD-L1状态之间没有联系[ 24 ]。在使用Ventana SP263测定评估PD-L1状态的durvalumab加tremelimumab(抗-CTLA-4抗体,AstraZeneca)的1b期研究中,如果≥25%的肿瘤细胞显示膜染色,则认为阳性的样品,临床证据在PD-L1阳性肿瘤和PD-L1阴性肿瘤患者中均观察到活性[ 25]。然而,在nivolumab加ipilimumab(CheckMate 012)的1期多项研究中,该组合在肿瘤表达PD-L1的患者中具有增加的临床活性,如28-8抗体所确定的[ 26 ]。在肿瘤PD-L1表达超过50%的患者中,获得反应的患者比例接近90%[ 26 ]。先前接受治疗的晚期NSCLC患者使用或不使用tremelimumab进行durvalumab的3期试验(ARCTIC研究)正在使用SP263检测评估PD-L1状态,目前正在进行[ 27]。
4. PD-L1分析
评估PD-L1表达以试图预测对PD-1或PD-L1抑制剂治疗的反应并不像人们想像的那样简单。在批准这些药物的临床试验中,PD-L1评估没有统一性。具有相关IHC平台的不同伴随诊断抗体克隆用于每种批准的抗PD-1或抗PD-L1抑制剂,并且不清楚这些测定是如何可互换的。当考虑到医院实验室随后面临决定哪个PD-L1诊断IHC平台和克隆使用给定成本限制时,这是有问题的。鉴于这是唯一一种仅在NSCLC的PD-L1阳性情况下被批准的药物,它可能是最具临床意义的携带被批准用于pembrolizumab的22C3试验,而无论PD-L1表达如何,都可以使用其他批准的药剂。在各种试验中“PD-L1阳性”的定义存在差异,一些研究包括用PD-L1阴性肿瘤分析无价值的样品。评估PD-L1表达细胞的差异也有所不同,一些研究发现与反应和肿瘤细胞PD-L1染色有关,有些研究发现与反应有关,肿瘤和肿瘤浸润免疫细胞染色相结合。另外,一些试验需要在登记前进行活组织检查,而其他试验依赖于档案组织,这是有问题的,因为PD-L1表达被认为随时间而变化。例如,PD-L1表达显示在黑素瘤肿瘤微环境中的小鼠模型中由IFN-γ动态诱导[28 ]。还有肿瘤内异质性[ 29 ],因此在一个时间点对一个部位进行活检可能不是最合适的生物标志物。
除了PD-L1抗体和平台的变异外,还有其他技术问题需要考虑PD-L1测试。与新鲜冷冻组织相比,评估福尔马林固定组织可低估PD-L1表达[ 30 ]。加迪奥等人。当在福尔马林固定组织和新鲜冷冻组织中评估具有多种不同抗PD-L1抗体的样品时,发现了一系列PD-L1表达[ 30 ]。关于细胞学制剂中PD-L1测试的数据很少,这可能在临床上存在问题,因为这是一些机构中的主要样本类型[ 31]。因为PD-L1上只有两个小的亲水区域可以用于IHC检测,所以IHC抗体通常在结构独特的位点结合PD-L1,与治疗性PD-L1抗体相比[ 1 ]。
在用于治疗晚期NSCLC的二线治疗中比较PD-1 / PD-L1抑制剂与多西紫杉醇的荟萃分析中,PD-1 / PD-L1抑制剂的益处仅限于PD-L1> 1%亚组。 [ 32 ]。对于PD-L1> 1%的患者与PD-L1<1%的患者接受PD-1 / PD-L1抑制剂治疗,ORR的优势比为2.18(95%CI 1.45-3.29; p = 0.0002)[ 32 ]。在一项单独的荟萃分析中,包括来自13项试验的1,612名患者,PD-L1阳性组的总体反应率在统计学上显著更高(RR 2.06 [95%CI 1.50 - 2.83])[ 33 ] 。作者得出结论,PD-L1过表达可被认为是NSCLC中免疫检查点抑制剂反应的预测生物标志物,与以往的治疗方法或肿瘤组织学无关[33 ]。第三项荟萃分析包括来自各种癌症类型的51项PD-1 / PD-L1抗体试验的6,800名患者,发现与PD-L1表达阴性的肿瘤相比,具有阳性PD-L1表达的肿瘤具有显著更高的临床反应率(41.4%对26.5%),RR = 1.92(95%CI:1.53-2.41,P<0.001)[ 34 ]。
为了帮助制定指南,有必要尝试标准化IHC检测。在2015年3月的一次公共研讨会上,FDA,美国临床肿瘤学会(ASCO)和美国临床研究协会(AACR)宣布了旨在协调PD-1 / PD-L1定向治疗的伴随诊断的努力,涉及制药和诊断公司之间的合作[ 35 ]。蓝图PD-L1 IHC比较项目是国际肺癌研究协会,AACR和四家制药公司(Bristol-Myers Squibb,Merck&Co.Inc,AstraZeneca和Genentech / Roche)之间的合作[ 36]]。
点击下载英文文献
参考文献:略
















共0条评论