作者及单位:王磊,王维格,李小秋,朱雄增(复旦大学附属肿瘤医院病理科 复旦大学上海医学院肿瘤学系),郭晔 (复旦大学附属肿瘤医院病理科 复旦大学上海医学院肿瘤内科)
来源:本文转自《中华病理学杂志》2014年5月第43卷第5期
淋巴瘤的分类主要是根据疾病独特的组织学形态、免疫表型、遗传学改变以及临床特点来定义不同的淋巴瘤病种,依据上述原则,绝大部分淋巴瘤病例都可以准确归入现有分类框架中的某一类型或亚型。然而,也确实存在一部分病例因其肿瘤形态、免疫表型或遗传学特点介于两种或两种以上的明确类型之间而难以精确归入其中任何一类。鉴于此,有人提出灰区淋巴瘤的概念对这部分病例加以描述。2008年世界卫生组织(WHO)造血与淋巴组织肿瘤分类中新增列的“具有弥漫性大B细胞淋巴瘤(DLBCL)和经典型霍奇金淋巴瘤(CHL)中间特点、不能进一步分类的B细胞淋巴瘤,即灰区淋巴瘤(GZL)”就属于这样的情形。原发于纵隔的GZL最为常见,该组肿瘤在形态和免疫表型上具有原发纵隔大B细胞淋巴瘤(PMBL)和结节硬化亚型CHL二者杂合或移行性特点。但与PMBL或CHL相比,纵隔GZL通常显示更高的生物学侵袭性,且缺乏有效的治疗方法,正确识别这部分病变故而具有重要的临床意义。除了原发纵隔的病变,部分累犯外周淋巴结或其他结外部位的B细胞肿瘤也可显示DLBCL和CHL中间特点,但这部分病变目前还少有研究。我们回顾性分析一组发生在不同部位、具有DLBCL和CHL中间特点的GZL病例,总结其临床和病理学特征,探讨诊断和鉴别诊断标准,以期提高对该类肿瘤的认识。
材料与方法
1.材料:收集复旦大学附属肿瘤医院病理科2009年1月至2012年12月诊断为GZL的16例连续病例,其诊断均经三位淋巴专科病理医师复核并达成一致。研究病例均有存档石蜡包埋肿瘤组织蜡块或部分未染色切片,临床资料源自医院电子病史,部分信息系作者咨询临床医师或患者获得。
2.组织形态观察:常规制备HE染色切片并在光学显微镜下观察。组织学观察项目包括:肿瘤细胞生长模式(结节状或弥漫性浸润)、瘤细胞形态[包括中心母细胞样细胞、免疫母细胞样细胞、细胞质透亮的细胞、诊断性霍奇金或RS(HRS)样细胞、腔隙型细胞、“干尸”细胞、间变性细胞等]、有无肿瘤性坏死以及背景反应性细胞的构成(包括小淋巴细胞、嗜酸性粒细胞、组织细胞和浆细胞等)。
3.免疫组织化学染色:采用全自动免疫组织化学仪(BenchMarkXT,美国Roche公司)EnVision两步法染色,第一抗体包括CD45、CD20、PAX5、CD3、CD5、CD30、CD15和EB病毒(EBV)潜伏膜蛋白1(LMP1)(CD20购自美国Ventana公司,其余抗体购自丹麦Dako公司),具体操作步骤参考试剂盒说明书和全自动免疫组织化学仪标准操作流程。染色结
果半定量判读为以下4种类型:(1)弥漫强阳性(记作“+”),90%以上的瘤细胞弥漫强阳性着色;(2)异质性阳性(记作“H+”),瘤细胞有强弱不等的抗原表达,且阳性细胞占所有瘤细胞的比例在25%~90%之间;(3)灶区阳性(记作“F+”),10%~25%的肿瘤细胞强阳性或异质性阳性着色;(4)阴性(记
作“-”),无阳性肿瘤细胞或阳性瘤细胞比例少于10%。
4.统计学分析:应用SPSS 13.0软件进行统计分析。外周型及中央型病例与各临床病理特征之间的关系采用卡方检验、秩和检验以及Spearman相关分析。P<0.05示差异有统计学意义。
结果
1.临床情况(表1):
男性10例,女性6例(男∶女为1.7∶1.0);年龄范围为15~74岁,平均年龄和中位年龄分别为40.2岁和30.0岁。5例主要表现为纵隔肿块,伴或不伴邻近解剖区域淋巴结肿大(以下称作“中央型”病例);8例表现为外周淋巴结肿大而无纵隔累犯(以下称作“外周型”病例);另有3例表现为外周淋巴结肿大但纵隔情况不详;外周型病例中有2例伴有结外病灶(乳腺和双侧胸腔累犯各1例)。13例行骨髓活检的病例中1例见肿瘤累犯。13例患者有完整的临床分期、治疗及随访信息。其中,Ann ArborⅠ、Ⅱ、Ⅲ和Ⅳ期的病例分别有1、6、5和1例。11例患者接受CHOP(环磷酰胺+多柔比星+长春新碱+泼尼松)方案6~8个周期的化疗,其中,8例联合使用抗CD20利妥昔单抗(R-CHOP)进行免疫化疗,3例在化疗结束后补充局部放射治疗,2例对CHOP方案不敏感的病例分别改用ESHAP(依托泊苷+甲泼尼龙+顺铂+阿糖胞苷)方案和ABVD(阿霉素+博来霉素+长春碱+达卡巴嗪)方案化疗。另外2例患者接受大剂量化疗加自体干细胞移植治疗。4例患者(包括接受干细胞移植的2例)获得完全缓解,5例获得部分缓解,2例疾病稳定,2例出现疾病进展。随访时间14~54个月,平均和中位随访时间分别为34.4和41个月。2例死亡(例1和例9分别于诊断后17和21个月死亡),7例带病生存,4例无病生存。比较5个(例5、10、12、13、14)中央型和8个(例2、3、4、7、8、9、11、16)外周型病例,发现前者患者年龄相对较轻(中央型平均年龄和中位年龄分别为32.4岁和27岁,外周型平均年龄和中位年龄分别为43.4岁和45.5岁,P<0.01),而两组患者在性别分布(P=0.685)、临床分期(P=0.674)、治疗结果(P=0.647)以及临床结局(P=0.933)等方面差异均无统计学意义。
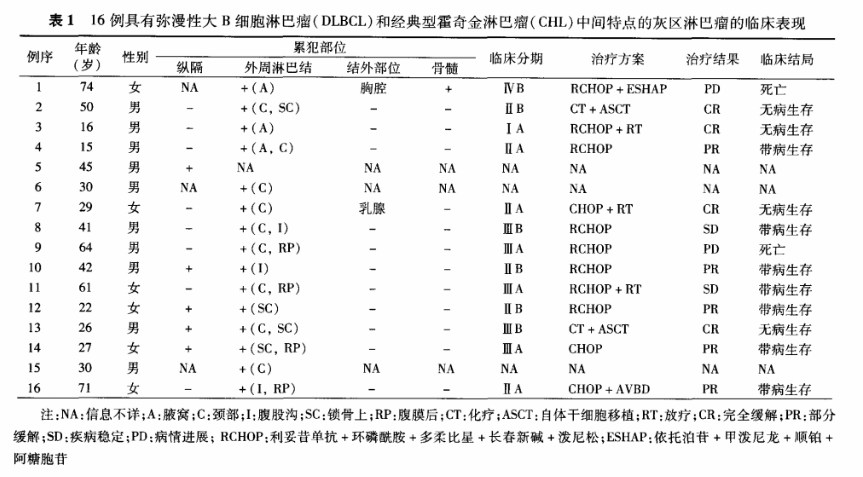
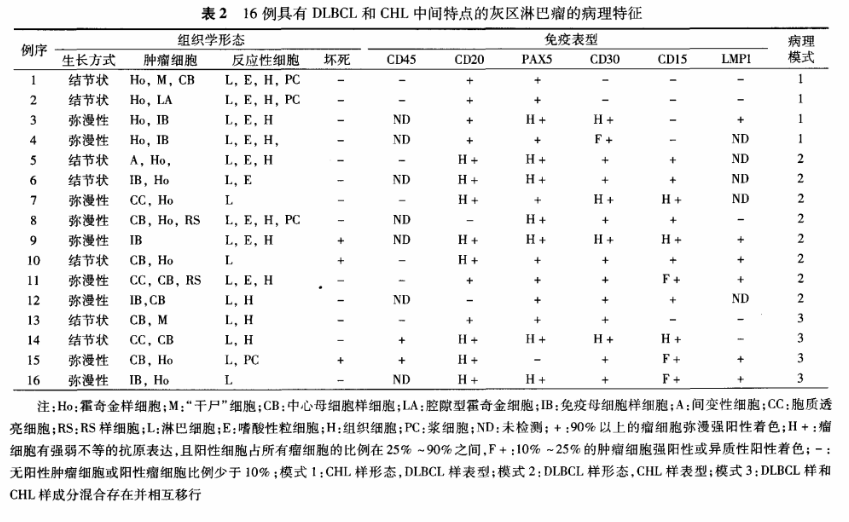
2.病理学表现:本组16例GZL根据组织学形态和免疫表型特点(表2),可以归纳为以下三种模式:(1)模式1:4例(例1~4)呈现这一模式。肿瘤组织学形态与CHL极为相似,肿瘤性大细胞为散在分布、形态典型的诊断性HRS样细胞(图1)、“干尸”细胞或免疫母细胞/中心母细胞样细胞,部分富含腔隙型霍奇金细胞并伴纤维胶原组织增生的病变,形态类似于结节硬化型CHL。病灶中的背景细胞包括小淋巴细胞、嗜酸性粒细胞、组织细胞和浆细胞等。所有病例均未见肿瘤性坏死。虽然形态类似于CHL,但肿瘤细胞的免疫表型却和DLBCL更为接近,表现为CD20(图2)和PAX5均呈弥漫强阳性表达,而CD30和CD15表达水平下调(CD15均阴性,CD30阴性或仅有少数细胞呈强弱不等的异质性阳性表达,图3)。3例检测病例中有1例肿瘤细胞表达EBV-LMP1。(2)模式2:包括8例(例5~12)。形态上主要表现为组成成分相对单一的肿瘤性大细胞呈弥漫性浸润(图4),部分病例有纤维胶原组织增生而呈现灶性结节状生长模式。多数病例的肿瘤细胞呈中心母细胞样形态,没有显著的大核仁,但也有部分病例伴有数量不等、核仁显著的免疫母细胞样或典型HRS样肿瘤细胞。与模式1病例相比,本组病例的背景细胞数量较少,2例出现灶性肿瘤性坏死。虽然肿瘤形态与DLBCL相似,但免疫表型却更接近于CHL,大部分病例CD20、PAX5表达水平有不同程度下调,呈异质性阳性或阴性(图5),与之相反,所有病例均表达CD30(图6)和CD15,且有5例CD30和CD15染色结果为强阳性。本组4例检测病例中有3例肿瘤细胞表达EBV-LMP1。(3)模式3:4例(例13~16)归入这一类型。同一肿瘤病灶的不同区域形态变异较大,部分区域类似于CHL,部分区域又与DLBCL相似,且不同形态的肿瘤成分相互移行、难以明确区分(图7)。肿瘤细胞体积大到中等大,呈现中心母细胞、免疫母细胞、HRS样细胞等多种形态。背景细胞多为小淋巴细胞和组织细胞,嗜酸性粒细胞和浆细胞相对少见。4例均表达CD20(图8)和CD30(图9),但CD20多为异质性阳性,3例有灶性或异质性CD15阳性表达,2例表达EBV-LMP1。16例GZL肿瘤细胞均不表达T细胞标志物。外周型病例分别有3、4和1例呈现模式1、2和3病变,中央型病例也分别有3例和2例表现为模式2和模式3病变,但缺乏模式1病变(P=0.230)。此外,5例中央型病变中有4例显示有纤维胶原分隔和肿瘤结节状生长,而8例外周型病变中仅1例显示该特点,这一差异有统计学意义(P=0.032)。6例受检外周型病例中有4例EBV-LMP1阳性,而3例中央型病例中仅1例有阳性表达(P=0.524)。
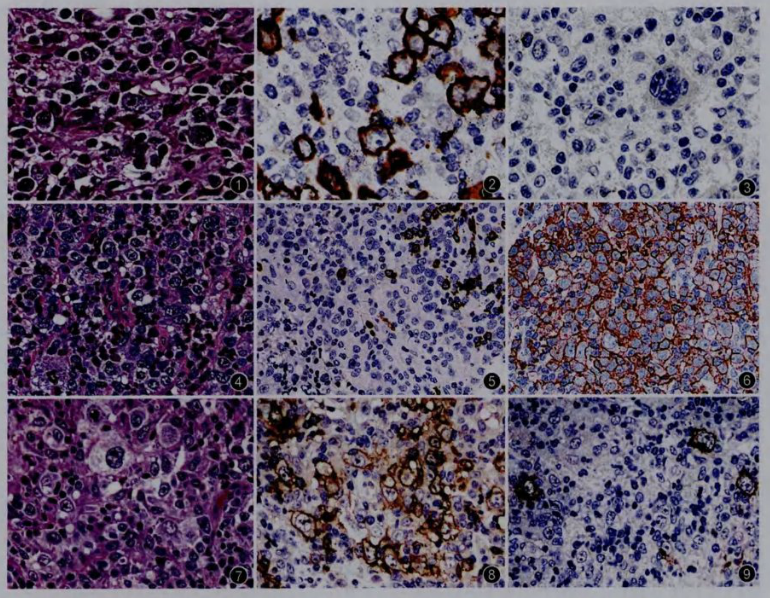
图1~3 模式1病变的组织学形态和免疫表型(例2) 高倍放大
图1 示反应性细胞背景中散在分布的霍奇金样细胞 HE
图2 示所有肿瘤细胞强阳性表达CD20 EnVision法
图3 示肿瘤细胞CD30阴性 EnVision法
图4~6 模式2病变的组织学形态和免疫表型(例8) 高倍放大
图4 示形态一致的肿瘤性大细胞呈弥漫性浸润 HE
图5 示肿瘤细胞CD20阴性 EnVision法
图6 示肿瘤细胞弥漫强阳性表达CD30 EnVision法
图7~9 模式3病变的组织学形态和免疫表型(例15) 高倍放大
图7 示肿瘤细胞形态多样,可见DLBCL样和CHL样成分混合存在并相互移行 HE
图8 示肿瘤细胞表达CD20但呈异质性阳性着色 EnVision法
图9 示肿瘤细胞阳性表达CD30 EnVision法
讨论
近年来,随着免疫组织化学和分子生物学技术在病理诊断实践中日益广泛应用,人们认识到有一部分淋巴瘤病例因特点介于霍奇金淋巴瘤和非霍奇金淋巴瘤之间而难以归入前者或后者。原发于纵隔的GZL就是这样的范例,这类肿瘤不但本身形态和免疫表型兼具PMBL和结节硬化性CHL部分特点,而且还经常与典型的PMBL或CHL病变同时存在(即组合性淋巴瘤)或先后发生。遗传学和某些临床表现的相似性也提示纵隔GZL和典型的PMBL以及CHL在起源或生物学上密切相关,它们可能共同构成一组形态和表型多样、纵隔大B细胞肿瘤的连续谱系。但是,相比预后相对较好的PMBL或CHL,GZL在临床上通常呈现更高的侵袭性和较差的预后,提示后者可能是有别于前两者的一类独立疾病。除了累犯纵隔的中央型病变,部分GZL也可在纵隔以外的外周淋巴结发生。
作为一种相对少见的肿瘤,GZL的病理特征和诊断要点并不为人们所熟知。此外,由于GZL的形态或表型特点和DLBCL或CHL高度相似乃至部分重叠,准确界定并区分这三者也并非易事。我们复习了一组符合WHO定义的GZL病例,发现这一类肿瘤的病理学改变可以归纳为三种独特的模式:(1)CHL样形态,DLBCL样表型(CD20、PAX5强阳性,CD30表达水平下调,CD15阴性);(2)DLBCL样形态,CHL样表型(CD20、PAX5表达水平下调,CD30和CD15阳性);(3)无论形态还是表型均兼具DLBCL和CHL二者特点(DLBCL样和CHL样成分混合存在并相互移行)。可见,肿瘤形态与表型的不一致或者肿瘤内部形态和表型的多样异质性构成了GZL最主要的病理特征和诊断依据。显而易见,GZL的鉴别诊断主要包括DLBCL和CHL。模式1型GZL常需和CHL以及富于T细胞/组织细胞的大B细胞淋巴瘤作鉴别。典型的CHL病例肿瘤细胞CD30强阳性,CD20表达水平下调(完全阴性、少数细胞阳性或者阳性细胞数量虽多但呈异质性阳性),B细胞程序相关转录因子表达障碍(PAX5弱阳性、OCT-2或BOB.1失表达),CD15或EBVLMP1阳性也通常更支持CHL的诊断。值得注意的是,多组研究均提示CD20表达是CHL的负性预后因子,因此,对于那些CD20和PAX5表达水平较高的CHL样病例,可能诊断为GZL更为合适。部分富于T细胞/组织细胞的大B细胞淋巴瘤可出现HRS样肿瘤细胞,后者CD20和PAX5的表达模式也和模式1型GZL十分相似,但富于T细胞/组织细胞的大B细胞淋巴瘤通常不表达CD30、CD15或EBV-LMP1,借此可和GZL区分。模式2型GZL常需和DLBCL及淋巴细胞消减型CHL作鉴别。区分模式2型GZL和非特殊类型的DLBCL的关键在于CD20和PAX5表达模式的不同,对于那些CD20染色呈弱阳性或异质性阳性结果、且可见到少量诊断性HRS细胞的“DLBCL”病例,需检测CD15、CD30、EBV-LMP1等以明确有无GZL可能。DLBCL通常不表达CD15,借此可与GZL鉴别。本研究有1例(例11)模式2型GZL呈CD20和PAX5弥漫强阳性,但考虑到瘤细胞同时表达CD15、CD30及EBV-LMP1,我们还是作出了GZL的诊断。淋巴细胞消减型CHL无论免疫表型还是生物学行为(侵袭性相对较高)都和模式2型GZL极为相似,目前区分二者主要还是根据肿瘤细胞的形态,GZL的瘤细胞多为中心母细胞样大细胞,尽管有时也可混有少量的HRS细胞,但一般不容易让人想到CHL的诊断,倘若是明显的诊断性HRS样细胞(特别是多核或分叶核细胞)弥漫性增生,则诊断CHL更为合适。本组16例GZL有6例EBV-LMP1阳性,其中有3例患者为60岁以上老年人,这部分病例需与老年人EBV阳性的DLBCL作鉴别。后者在形态和表型上也和CHL或GZL有着诸多相似乃至重叠之处,例如也可出现HRS样肿瘤细胞,或者呈现CD30阳性或CD20下调的表型等,但老年人EBV阳性的DLBCL一般不表达CD15。需要强调的是,一些其他类型的EBV相关的B细胞淋巴组织增生性病变(如淋巴瘤样肉芽肿病、EB病毒阳性的皮肤黏膜溃疡等)也具有类似的形态或表型特点,诊断GZL时还需注意和这些疾病作鉴别。
本组GZL患者以成年男性为主,这与既往文献报道一致。临床表现除了纵隔肿块为主的中央型病变,还包括无纵隔累犯的外周淋巴结肿大。多数(11/13)患者表现为临床Ⅱ或Ⅲ期疾病,未见骨髓累犯。GZL具有较高的侵袭性,且迄今为止尚无理想治疗方案。本组绝大部分患者都接受了规范的、联合利妥昔单抗的免疫化学治疗,多数采用的是针对侵袭性更高的DLBCL的R-CHOP方案。尽管如此,疗效并不十分理想,仅4/13的病例获得完全缓解,获得缓解的多系临床Ⅰ、Ⅱ期病例,而病情稳定或出现进展的全部是III、Ⅳ期病例,提示疾病分期可能和预后相关。4例获得完全缓解的病例中,2例曾在化疗后补充放射治疗,另2例接受自体干细胞移植,提示采用这些综合治疗的措施或许能使患者获益。
比较中央型和外周型病例,我们发现中央型病例通常患者更为年轻,但两组在患者性别、疾病分期、治疗结果等临床参数方面并无统计学差异。有趣的是,二者病理特征似乎不尽相同。例如,中央型病变更易见到纤维胶原组织增生和结节状分隔,更多呈现模式2和模式3型改变,且多数EBV阴性;而外周型病变则少有纤维胶原分隔,更多表现模式2和模式1型改变,且有相当部分病例与EBV相关。但由于病例数较少,上述差异并非均有统计学意义,可能还需更大样本研究才能得出结论。
GZL的遗传学和分子生物学特征目前还不甚清楚。最近一项关于纵隔结节硬化性CHL、PMBL及GZL甲基化状态的研究表明三者的表观遗传学特点密切相关,但与非特殊类型的DLBCL完全不同。不但如此,GZL的表观遗传学印记也有别于PMBL或CHL,从而提示前者是不同于后二者的疾病,将其作为独特病种在WHO分类中单独列出完全必要。外周型GZL研究较少,这类病变的发病是否也和表观遗传学调控机制相关目前还不得而知。本研究显示外周型GZL中EBV的检出率较之中央型病变为高。由于EBV感染正常B细胞后常会导致细胞形态和免疫表型发生转化,我们推测外周型GZL形态和表型特点或许与EBV相关,当然,这样的假设是否成立还需要更大样本以及更多后续研究工作予以验证。
















共0条评论