[导读] 核心提示:旧岁惊艳ASCO,今日看尽长安花。我们已开发出NTRK1、NTRK2、NTRK3单个和组合断裂探针,特别适合于伙伴基因众多的NTRK检测。本文尽量客观全面地从文献综述角度比较NGS、FISH、IHC三种方法检测NTRK1/2/3及对应蛋白的优缺点,浓缩成14个要点。
自去年ASCO惊艳亮相后,近日拉罗替尼(larotrectinib,商品名Vitrakvi,文献研究也称LOXO-101)也经FDA优先审评后正式上市。这两天,朋友圈都在热传其“广谱”性(多癌种,17种以上)和高效性(客观缓解率80%),但鲜有文章关注其用药前的精准检测。这里重点摘录几篇文献的检测方法及数据,结合我们的分析,提炼出以下关键点,供大家参考。
这是第一款TRK抑制剂(原肌球蛋白受体激酶,tropomyosin receptor kinase)被批准上市,其靶点是NTRK酪氨酸激酶区域,属于TKI小分子药物。NTRK是编码TRK的基因,有NTRK1、NTRK2、NTRK3三位家族兄弟,分别位于染色体1q22、9q21、15q25不同区段,对应编码的蛋白称为TRKA、TRKB和TRKC。酪氨酸激酶区域都位于NTRK基因的3’端。伙伴基因与NTRK基因发生融合后,TRK融合蛋白将处于持续活跃状态,引发信号级联反应,从而驱动促进TRK融合肿瘤的扩散和生长。
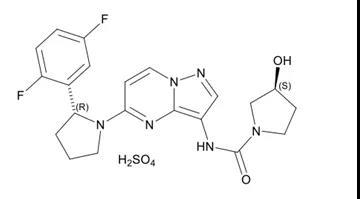
如上图,larotrectinib结构式
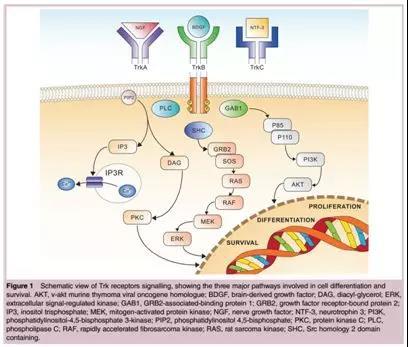
如上图:NTRK1/2/3表达的蛋白TrkA/B/C与下游信号通路形成级联反应
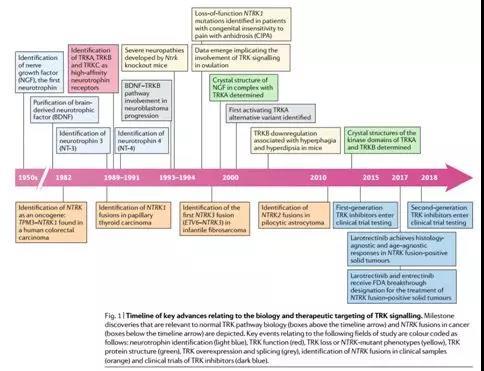
如上图,NTRK信号通路研究关键历史(Nature Reviews, Vol15, 2018)
其“广谱”性表现为只要NTRK基因与别的伙伴基因发生融合就是其适用靶标,可有效治疗17种肿瘤类型(2017 ASCO报道):肺癌、甲状腺癌、黑色素瘤、胃肠癌、结肠癌、软组织肉瘤、唾液腺癌、婴儿纤维肉瘤、阑尾癌、乳腺癌、胆管癌、胰腺癌。

如上图,成人和儿童不同肿瘤NTRK阳性率
然而,虽然NTRK1/2/3在很多肿瘤中都可发生融合异常,但其总体阳性率实在太低了,还不够1%。但在部分少见/罕见癌种中其阳性率还是相对较高的,其中大于25%的癌种(甚至可大于90%)有先天性婴儿纤维肉瘤、唾液腺(乳腺样)分泌性癌(MASC)、分泌性乳腺癌;而介于5-25%的癌种为乳头状甲状腺癌、Spitz痣、先天性中胚层肾瘤、乳头状甲状腺癌(放疗照射后)、桥脑胶质瘤(Pontine glioma)。而发病率大的肿瘤中其阳性率甚至还低于1%(如肺癌、结直肠癌)。需要注意,larotrectinib做临床的NTRK阳性病例数也仅有55例(原始数据)和67例(补充数据)。
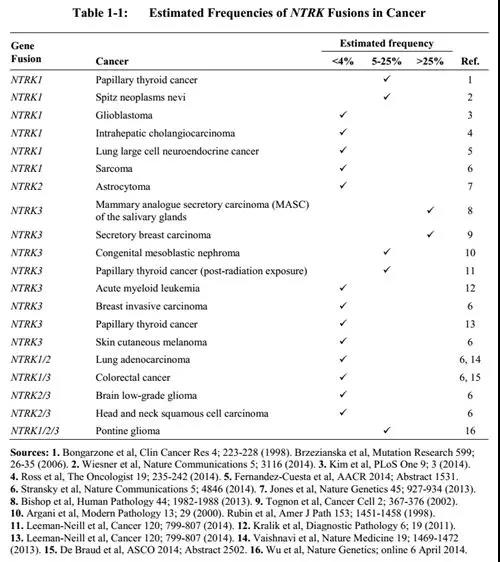
如上图,NTRK各基因在不同癌种中的发生率
即便目前仅有100多例的阳性数据,但还是有很多东西可挖掘。这些阳性大多数为不同大小的NGS panel,为经过CLIA认证的实验室检测出来的,比如其中有Foundation Medicine、Memorial Sloan Kettering Cancer Center和University ofWashington。55例阳性中用NGS检出43例(78%)。
小部分为用FISH探针检测出来的,且其中为部分用ETV6断裂探针所代替(婴儿纤维肉瘤中NTRK3-ETV6融合为特征性分子异常,ETV6有商品化探针,而与之融合的NTRK3却没有)。另外,文献报道的NTRK1和NTRK2断裂探针也多是研究者自己设计合成的,很少见有商品化的探针。
临床试验中也用Pan-TRK免疫组化来检测TRKA、TRKB和TRKC的表达情况,用的是Abcam公司的兔单抗(克隆号EPR17341),在Leica Bond III机器上完成,抗原修复用的是BOND Epitope Retrieval Solution 2。

如上图,Loxo Oncology公司在larotrectinib开展临床试验时的一份附件,用NGS、FISH、RT-PCR三种方法检测都可接受,且描述了NTRK与伙伴基因融合的表述汇总

如上图,Loxo Oncology公司说明在婴儿纤维肉瘤的ETV6-NTRK3检测中可用ETV6断裂探针来替代

如上图,一例高分化乳头状甲状腺癌伴甲状腺外淋巴结转移发生ETV6-NTRK3融合,但作者用的是ETV6断裂探针来替代检测
NTRK与不同伙伴基因融合也有一定的规律。在2018年8月31日Nature子刊ModernPathology发表的文献”Molecular characterization of cancers with NTRK gene fusions”分析了11502例患者,其中31例(占比0.27%)为阳性。最常见的融合是ETV6-NTRK3(n=10)和TPM3-NTRK1(n=6);胶质瘤中NTRK融合阳性最多(14/982,1.4%),且最常见的为NTRK2(n=6)。而在上述55例原始数据中,ETV6-NTRK3融合占28例(51%),TPM3-NTRK1占9例(16%),LMNA-NTRK1融合占5例(9%),IRF2BP2-NTRK1融合占2例(4%),SQSTM1-NTRK1融合占2例(4%),且还有9种不同伙伴基因分别与NTRK1、NTRK2、NTRK3发生融合,例数都只有1例。
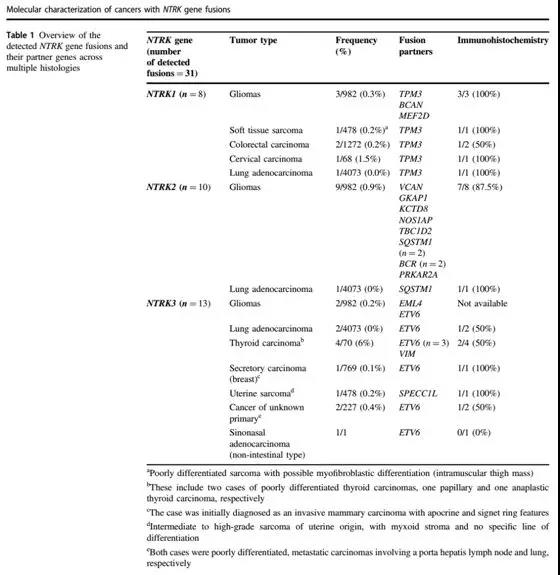
如上图,11502例患者中NTRK1/2/3与不同伙伴基因融合的发生率汇总。需要注意:4073例肺腺癌中总共只有4例NTRK阳性,发生率极为之低
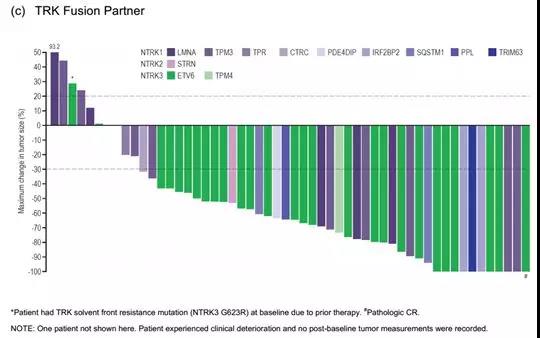
如上图,NTRK1/2/3与不同伙伴基因融合,对larotrectinib治疗的反应也有所差别
由于NGS在美国开展相对成熟、灵敏度相对FISH而言更高(可发现丰度较低的融合基因reads)、且进保险,而FISH探针NTRK1/2/3未有商品化探针、RT-PCR检测这么多的融合伙伴基因很难实现,所以,虽然临床试验中写了三种方法,但NGS的阳性比例占绝大比例(78%,43/55)。需要注意,附件中并没看到不同丰度reads的融合对疗效的影响如何。一般而言,NGS检测需从FFPE或新鲜样本中提取几十ng以上的RNA,用于建库及捕获。
然而,不同大小的NGS panel往往需要设计RNA或DNA探针,来捕获这三个基因,特别是较大的NTRK2和NTRK3基因(DNA片段分别长达39万和35万碱基对),外显子较多,融合类型复杂且分布不一,且只能针对已知融合位点(序列)设计捕获探针,成本较高,且不同厂家的panel性能可比性还有待积累。这些都是NGS技术用于NTRK1/2/3融合基因检测的缺点。
而Loxo Oncology公司在官方网站上也罗列了10种NGS panel供参考。然而,在我们国内,相关NGS独立实验室的panel性能还未见有较权威的验证数据发表。

如上图,Loxo Oncology公司推荐的10种NGS panel
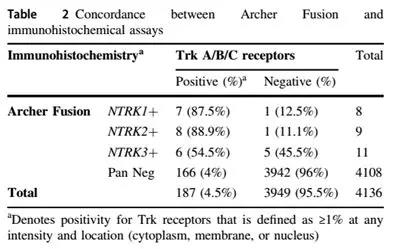
针对NTRK蛋白的IHC检测也见有一些文献数据,但相对较少。以Abcam公司的pan-Trk兔单抗(克隆号EPR17341)发表的数据为主,见下图Nature Modern Pathology文献中的数据及讨论。作者的IHC灵敏度为75%(且NTRK3阳性病例中45%为IHC假阴性),作者也提及Hechtman等人的灵敏度及特异性分别为95.2%和100%,Rudzinski等人的为97%和98%。不同作者有不同的结果,是否与所有机器、抗原修复方法等也有相关不得而知。Murphy等人认为TRK IHC有100%阴性预测值,但在IHC阳性表达病例中仅有9%为NTRK融合阳性。可能pan-Trk可用于NTRK融合基因的初筛,但有一定的漏诊率(这篇文献表现为NTRK1/2约为15%,NTRK3为45%)。当然,相对后续高昂的用药费用而言,准确的检测/诊断至关重要,有条件者肯定是需要做FISH或NGS来确诊的。需注意:TRKA/B/C蛋白表达可见于胞浆、胞膜和胞核等不同位置,且有不同强度。
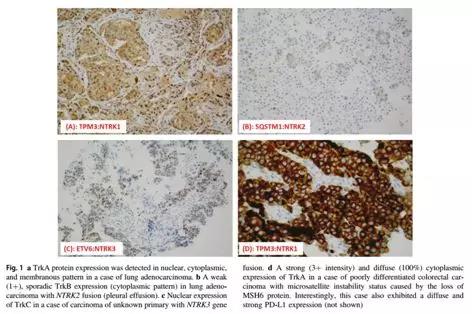
如上图,TRKA/B/C蛋白表达的强度不一,位置多样
讲了这么多,轮到主角出场了:NTRK1/2/3 FISH探针!伙伴基因众多,是NTRK设计为断裂探针(一头标红,一头标绿)的天然优势。且不管是与哪个基因融合,NTRK都可表现为红绿分离的阳性信号,且可结合组织形态原位观察、发现典型阳性类型之外的其他不典型信号(往往伴随复杂易位或复杂核型)。在去年ASCO开始报道后,我们就着手开发了出来NTRK1断裂探针、NTRK2断裂探针和NTRK3断裂探针,且可形成三个一起检测的产品包(需要三张玻片)。产品代码如下:
F.01103-01NTRK1(1q22-q23.1)基因断裂探针
F.01289-01NTRK2(9q21)基因断裂探针
F.01290-01NTRK3(15q25)基因断裂探针
F.01348-01NTRK1/NTRK2/NTRK3探针
(自我表扬5秒钟~~)
外周血培养中期染色体和样本检测图如下:
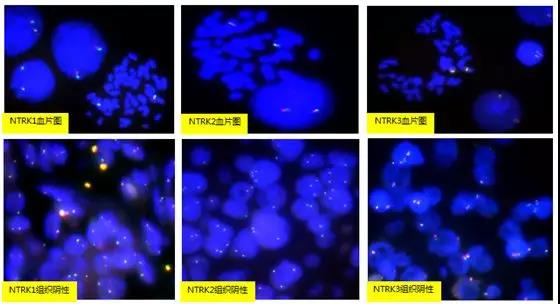
需要注意,NTRK1/2/3断裂探针的红、绿端探针位置。NTRK1、NTRK2基因都是从左向右转录,5’在左边,3’在右边。NTRK3基因是从右向左转录,5’在右边,3’在左边。而我们的NTRK1断裂探针、NTRK2断裂探针和NTRK3断裂探针都是左边标记红色,右边标记绿色。
这是什么意思呢?如上面所述,NTRK基因是靠3’端带有酪氨酸激酶区域的片段与伙伴基因发生融合,融合后导致TRK融合蛋白处于持续活跃状态,引发信号级联反应,从而驱动促进TRK融合肿瘤的扩散和生长。而酪氨酸激酶区域所表达的氨基酸段是larotrectinib的靶向区域,TRK融合蛋白含有酪氨酸激酶区域的氨基酸段,用药才有效,否则无效。
所以,断裂探针出现不典型阳性信号时,比如1绿1黄、1红1黄,总之不是典型的1红1绿1黄信号,我们就要分析了。NTRK1、NTRK2的3’端(右端)为绿色,出现1绿1黄时为不典型阳性(因为靠近3’端的酪氨酸激酶区域还存在);而出现1红1黄时为阴性(因为靠近3’端酪氨酸激酶区域的绿色区段缺失了,融合探针不表达酪氨酸激酶结构域,药物无效)。而NTRK3断裂探针因为红绿端位置与NTRK1、NTRK2相同,但其5’和3’恰好反过来,所以情况与NTRK1/2恰好相反,1红1黄为不典型阳性,1绿1黄为阴性。
当然,这是理论上分析的大概率事件,碰到具体样本时也有可能恰好对应3’端缺失但酪氨酸激酶区域还在(虽然概率较低),而用药有效。
总而言之,碰到这类不是典型1红1绿1黄阳性信号表现为一定的比例(比如大于20%时),有条件者还是需要结合NGS分析或核型培养来相互验证。
这类断裂探针的信号点大小、红绿探针间距与ALK、ROS1等断裂探针类似,开展时可参考ALK、ROS1断裂探针阈值15%,当然严谨的做法是分别取阴性样本来做阈值建立。
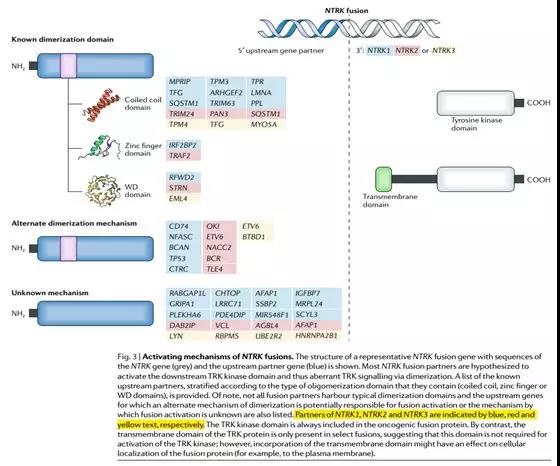
如上图,NTRK1/2/3可以不同的伙伴基因融合,都涉及到酪氨酸激酶结构域区段;甚至在与RFWD2、STRN、EML4等基因融合时还涉及到Transmembrane domain区段。(Nature Reviews, Vol15, 2018)
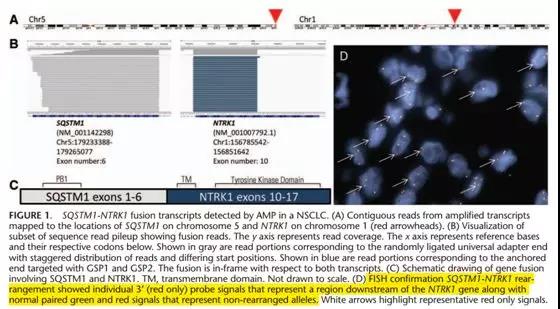
如上图,NTRK1断裂探针1红1黄阳性(3’为红色)。假如此例样本用我司探针的话则为1绿1黄阳性(3’为绿色)(Journal of Thoracic Oncology, 2015)
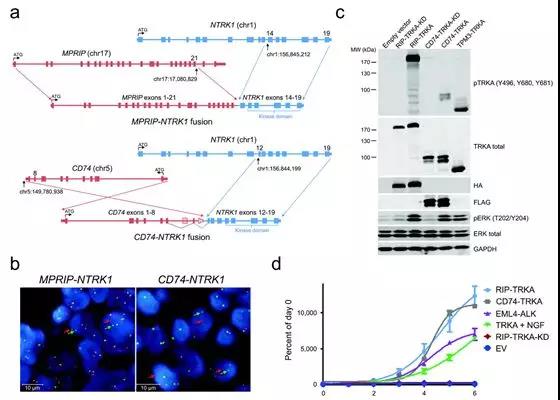
如上两图,判读标准(3’单红也算阳性),下b图注意也伴有拷贝数增加异常。(Nat Med, 2014)
需要注意,2018年的Nature Modern Pathology这篇文献显示,有29%的NTRK融合阳性病例表现为单一的NTRK融合异常,并不伴有其他细胞遗传学异常。这也提示为什么在部分病例中巨大肿物经拉罗替尼治疗后可明显缩小,这就是靶向治疗精准治疗啊。
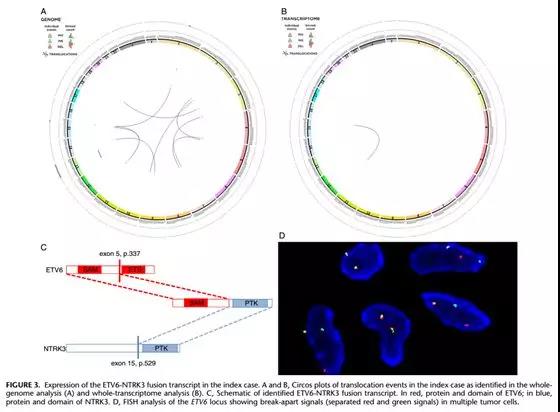
如上图,全转录组分析显示为单一的细胞遗传学融合异常(只有ETV6-NTRK3融合)(Am J Surg Pathol 2016, 40:1051-1061)
由于NTRK1/2/3基因分别位于染色体1q22、9q21、15q25不同区段,三个靶标的其他信号异常(如多体、多红、多绿等)提示其染色体核型或基因组可能比较复杂,且往往预后不佳,有条件者需结合NGS、核型分析进一步验证。
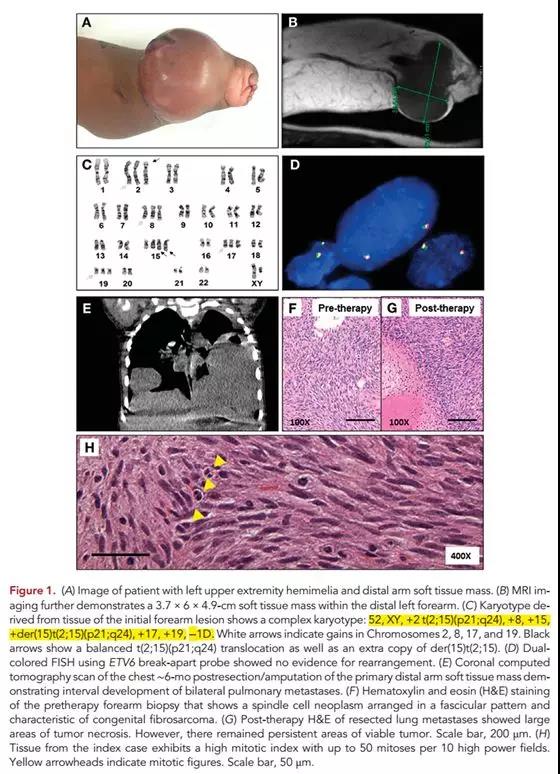
如上图,婴儿纤维肉瘤,ETV6断裂探针阴性,核型分析显示复杂核型,且伴有EML4-NTRK3融合。(Cold Spring Harb Mol Case Stud, 2015)
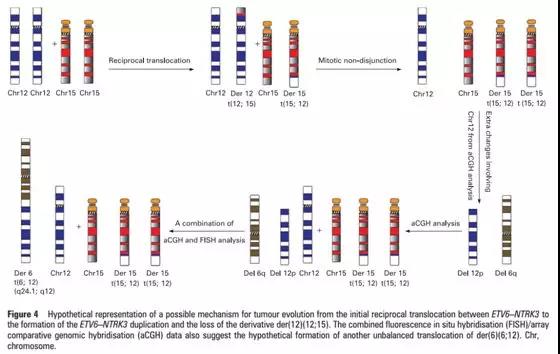
如上图,分泌性乳腺癌,ETV6-NTRK3融合并伴拷贝数增加。(J Clin Pathol 2009, 62:604-612)
虽然拉罗替尼刚刚被批准上市,但其耐药机制已有研究,涉及到多个氨基酸位点的突变,这些只能用NGS方法来检测了。
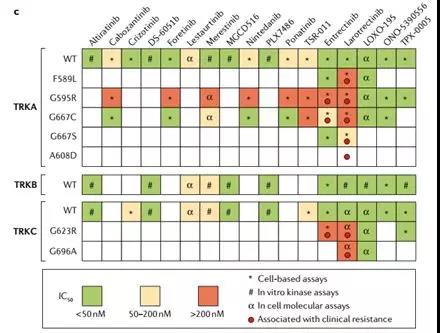
如上图,TRKA/B/C蛋白的部分热点突变。(Nature Reviews, Vol15, 2018)
需要注意,国内已获批准的克唑替尼(Crizotinib)的靶点不但是针对ALK、ROS1和MET,也可针对NTRK融合基因,其也是一种TRK抑制剂,只是与TRK的结合活性明显比ALK、ROS1和MET低。(Nature Reviews, Vol15, 2018)
另外,Cabozantinib也可靶向MET、RET、AXL、TRKA和TRKB。Ponatinib最早是作为BCR-ABL1抑制剂,后来发现也可靶向NTRK融合蛋白;Nintedanib是抗血管生成药物(VEGFR TKI),但也可抑制PDGFR、FGFR和TRK激酶。
Larotrectinib和Entrectinib为第一代TRK抑制剂已有临床研究及刚被批准上市,第二代的TRK抑制剂如LOXO-195、TPX-0005、ONO-5390556等药物在体外研究中也显示出良好的针对TRK耐药突变位点的活性,并且在较低的药物浓度范围下就可其作用。Larotrectinib耐药后,未来的TRK抑制剂也更值得期待。
部分引用文献:
1: Gatalica Z et al. Molecular characterization of cancers with NTRK gene fusions. 2018, Modern Pathology.
2: Laetsch TW et al. Larotrectinib for paediatric solid tumours harbouring NTRK gene fusions: phase 1 results from a multicentre, open-label, phase 1/2 study. www.thelancet.com/oncology Vol 19 May 2018.
3: Drilon A et al. Efficacy of Larotrectinib in TRKFusion-Positive Cancers in Adults and Children.2018, N Engl J Med, February 22.
4: Cocco E et al. NTRKfusion- positive cancers and TRK inhibitor therapy. 2018, Nature Reviews Clinical Oncology, Vol 15.


































共0条评论