[导读] 本文观点取自南京军区南京总院病理科周晓军与马恒辉的《组织固定处理及包埋常见问题与对策》
组织固定
组织固定的目的在于保存组织。组织离体后要尽快地用固定液浸泡,以达到渗透组织的目的,并使组织具有一定的硬度。这样不仅可以防止组织的自溶改变,而且还可以防止组织中的有效成分在后续的一系列处理过程中改变性状。所以,固定标本尤其是固定大块或条索状标本时要尽可能的保持标本正常时的状态,不得发生扭曲。
目前,10%中性缓冲福尔马林是应用最广的常用固定液之一[1,2],它对大多数的病理标本都具有良好的固定作用,穿透速度快,组织硬化程度小。组织经10%中性缓冲福尔马林固定后,可以保存数月而不会发生不良变化,且细胞核和细胞质的微细部分均保存良好,多数也可进行免疫组化染色(图1-5)。
目前,不少科室在使用自动化仪器设备时,因为程序设置不当,标本没有足够的时间在固定液停留,有的甚至用乙醇脱水直接替代了固定步骤,导致组织固定效果不佳.另在戊二醛,、Helly,、Zenker,、Bouin中固定的组织,必须及时取出冲洗,保留在适当的液体中。如果放置时间过长可能会导致固定过度,甚至影响染色[3](图6)。
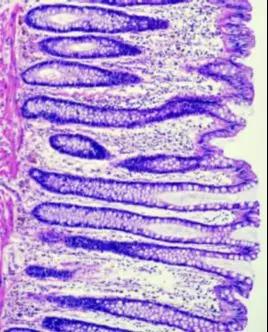
图1.外科手术结肠组织标本,标本离体后立即投入固定液; 固定液首先接触上皮部分,有效地保存了上皮及绒毛结构,并有效地阻止了细胞的自溶和腐败。
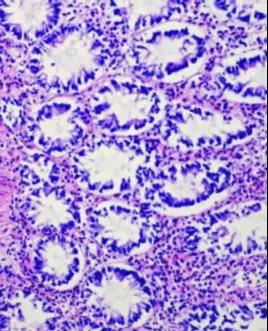
图2.组织取自动物实验的消化道肠黏膜,自溶引起上皮与基底部分脱落和分离,腺体结构欠完整。
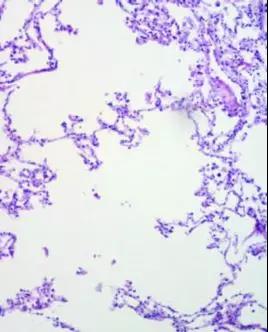
图3.肺组织切片,组织结构不良。由于没有良好的固定,组织正常的结构及相互关系在组织处理过程中不复存在。
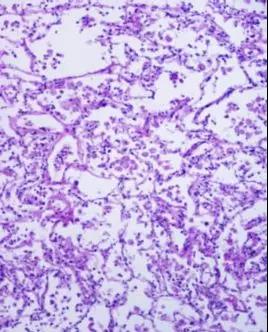
图4.肺组织固定良好,组织结构完整。
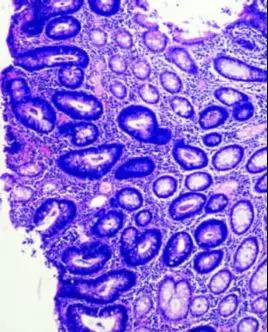
图5.肠黏膜组织固定不佳,细胞成分未被有效保存,染色差,特别是腺体部分的细胞核与细胞质深染,缺乏明显对比。
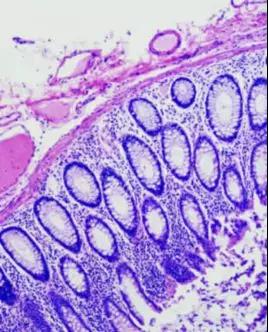
图6.肠黏膜组织固定良好。腺体结构完整,细胞清晰,细胞核与细胞质染色对比鲜艳。
组织处理
组织处理包括三个主要步骤:脱水、透明和浸透,目的在于从组织标本中移去多余的水分,引入一种遇热融化、遇冷凝结的介质(如石蜡),有利于组织切片[4]。
脱 水
脱水不彻底是组织处理最常见的问题之一。脱水的原理和机制有两方面:一是使用亲水性的试剂,从组织中吸收水分;二是使用溶水性的试剂,不断从组织中溶解组织中的液体。乙醇是常规组织制片最常用的脱水剂,如果时间宽裕,可从低浓度开始多换几次,这样可防止组织脱水过度造成扭曲。如果时间紧凑,可从95%乙醇开始,接着行无水乙醇脱水。通常的方案是从60%~65%乙醇开始,换2次95%乙醇,2次无水乙醇。如果使用的乙醇浓度高于70%,中性缓冲福尔马林中的磷酸盐,将会在组织中沉积,沉积的结晶会妨碍组织切片。所以,组织脱水时应尽量避免在高浓度的乙醇如无水乙醇中停留的时间过长,否则会造成组织过硬、扭曲,影响切片[5](图7、8)。

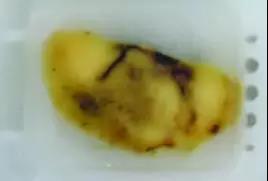
图7、8.蜡块中的淋巴结组织未充分脱水和透明导致浸蜡不完全:白色区域较软,石蜡未能浸透,蜡块将难以切片。
透 明
切片着色不均多数是因为透明或浸透的蜡液中混有一定的水分。组织开放式处理,空气中湿度较大;组织密闭式处理,固定液中的水分,或因加温引起的水珠,滴入液中。这类问题在小标本中比较多见,如皮肤、乳头状瘤。胃、肠、黏膜活检等标本[3]。可以改用对水宽容度性大一些的透明剂,如用甲苯替代二甲苯来解决此类问题(图9、10)。
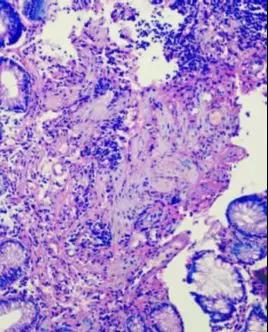
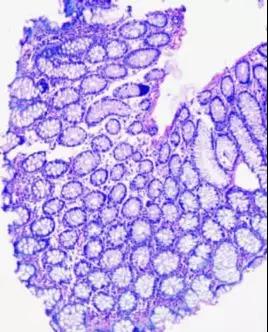
图9、10.肠黏膜活检小标本,深部肌层和腺体有着色不均的现象,部分区域组织发白,可能为浸蜡时有水珠滴入,影响浸蜡质量,导致切片染色不均。
浸 蜡
真空和加温是现代化组织处理仪器提供的有利条件和手段,但是应该慎用。不少单位在使用现代化的仪器进行组织处理时,因使用的程序不当,标本的处理容易出现过度或不足的现象。根据我科使用的情况,建议推荐使用如下程序,便于大家在设计使用时参考:
(1)固定程序2次,固定液为10%中性缓冲福尔马林,时间为45 min,设置加温50℃,加压,搅拌。
(2)脱水程序8次,前4次为95%乙醇,后4次为100%乙醇,时间均为60 min,仅在最后一次的95%和100%乙醇设置加压、搅拌。
(3)透明程序2次,第一次为硬脂酸和石蜡,比例为3:2,第一次为硬脂酸和石蜡,比例为2:3,时间均为60 min,均设置加温65℃。加压,搅拌。
(4)浸蜡程序2次,均为56~58℃纯蜡,时间均为为60 min,设置加温65℃,加压,搅拌。
参考文献:
[1] Bancroft J D. Theory and practice of histological techniques[M].London: Churchill livingstone,2008: 53 - 74.
[2] Carson F L. Histotechnology. A self-instructional text[M]. Chicago:
American Society of Clinical Pathologists Press,2009: 4 - 44.
[3] 马恒辉,周晓军. HE 染色常见问题与对策[J]. 临床与实验病理学杂志,2008,24(4): 478 - 81.
[4] 马恒辉,周晓军. 如何提高组织处理的技术水平[J]. 临床与实验病理学杂志,2011, 27(4) : 415 - 8.
[5] 马恒辉,周晓军. 组织切片常见问题与对策[J]. 临床与实验病理学杂志,2009,25(2) : 211 - 4.























共0条评论